大黄蒽醌苷对大鼠脑缺血再灌注损伤及肠道菌群的影响
虞夏晖,朱雨晴,王于俊,徐义培,郭 莹
(浙江中医药大学生命科学学院,浙江 杭州 310053)
缺血性脑卒中即为现代医学中的缺血性脑血管病,是指血管阻塞引起脑缺血、缺氧损伤进而导致局灶或全脑的功能障碍,具有发病率高、致残率高、复发率高等特点,严重危害人类健康[1]。目前为止,临床上的首要治疗原则是使缺血脑组织尽早恢复或再通血液灌注,重新获得血氧供应,但这些治疗措施在使闭塞脑血管再通的同时常使缺血组织病理损害加重甚至不可逆,临床症状恶化,这种现象被称为脑缺血再灌注损伤[2]。近年来研究表明,肠道菌群在缺血性脑卒中的发生发展中起到重要作用[3-4]。Benakis 等[5]报道肠道菌群可通过调节肠道 γδT 细胞,从而影响缺血性脑卒中的损伤。
大黄是我国传统的四大中药之一,具有泻下通便、活血逐瘀等多种功效[6],蒽醌苷作为其中主要的有效成分,对大鼠脑缺血损伤具有显著保护作用[7],但其防治机制尚不明确。现代研究表明,蒽醌苷类成分难以吸收,大多滞留于肠道发挥药效作用[8],大黄蒽醌苷对脑缺血性损伤的治疗作用可能和其在肠道的位置有关,也有文献形式中药苷类成分药效的发挥和肠道菌群的相互作用有关[9-10]。本实验旨在研究大黄蒽醌苷对脑缺血再灌注损伤大鼠的治疗效果,并比较该成分对肠道菌群的影响,探讨其抗脑缺血性损伤机制与肠道菌群的相关性。
1 材料
1.1 动物 健康清洁级SD 大鼠,雄性,体质量(280±20)g,购自浙江省实验动物中心,实验动物生产许可证号SCXK(浙)2014-0001。
1.2 试药 药用大黄Rheum officinaleBaill(浙江天道医药有限公司,批号 170302)。超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)、一氧化氮合酶(NOS)、乳酸(LD)、乳酸脱氢酶(LDH)检测试剂盒(南京建成生物工程研究所);白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(上海源叶生物科技有限公司);TTC 染料(美国 Sigma 公司);伊红美兰培养基(EMB)、胆盐-七叶苷-叠氮钠琼脂、双歧杆菌选择性培养基(BBL)、乳酸杆菌选择性培养基(LBS)(青岛海博生物科技有限公司);其余试剂均为分析纯。
1.3 仪器 SpectraMax M3 酶标仪(美国 MD 公司);FA2 104N 电子分析天平(上海菁海仪器有限公司);DRP-9272电热恒温培养箱(上海森信实验仪器有限公司);SW-CJ-2G 型双人净化工作台(苏州净化设备有限公司);立式压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂)。
2 方法
2.1 分组与给药 乙醇回流提取法得到蒽醌粗提取物,再以70%甲醇,葡聚糖凝胶LH-20 柱色谱纯化得到蒽醌苷提取物[11],按后续实验要求用蒸馏水将提取物配制成不同质量浓度。大鼠随机分为假手术组、模型组及大黄蒽醌苷高、中、低剂量组(30、15、7.5 m/kg),每组 9 只。大鼠脑缺血再灌注同时灌胃给药,连续 7 d,1 次/d,假手术组、模型组大鼠灌服等量生理盐水。
2.2 模型建立 大鼠称定质量后,腹腔注射10%水合氯醛(剂量 300 mg/kg)麻醉,参考 Longa 等[12]报道的方法建立大脑中动脉局灶性栓塞(MCAO)模型,假手术组大鼠不插栓线。缺血60 min 后抽出栓线,松开颈总动脉夹作再灌注,以大鼠苏醒后出现同侧Horner 征和对侧前肢提爪为造模成功。
2.3 神经功能评分 大鼠灌胃给药7 d 后,参考Longa等[12]报道的5 分制评分法进行评分:无精神损伤症状,为0 分;不能完全伸展对侧前爪,为1 分;向对侧转圈,为 2分;向对侧倾倒,为 3 分;不能自发行走,意识丧失,为4 分。
2.4 脑梗死范围百分比测定 大鼠灌胃给药7 d 后麻醉,断头取脑,生理盐水冲洗残血,-20 ℃下速冻20 min,置于脑槽中切片,TTC 染色,Image J 软件测定脑梗死范围百分比。
2.5 脑组织指标检测 取大鼠缺血侧脑组织,称定质量后加生理盐水制成10%组织匀浆,3 000 r/min 离心10 min,取上清液,-20 ℃下保存。按试剂盒说明操作步骤测定脑组织中 SOD、NOS、LDH 活性及 MDA、LD、NO、IL-1β、TNF-α 水平。
2.6 肠道菌群检测[13]分别在灌胃给药 1、7 d 后,无菌条件下收集大鼠粪便,各组取0.1 g,置于装有玻璃珠的无菌试管中,按1 ∶9 比例加入灭菌生理盐水涡旋振荡至粪便均匀化,10 倍稀释法用生理盐水将粪便悬液依次稀释至10-8浓度。选用合适的稀释液作为肠道菌群检测液进行选择性培养,取50 μL 适宜稀释度的菌悬液接种于各选择性培养基上,涂布均匀,平行3 次,大肠杆菌和肠球菌于37 ℃下培养24 h,双歧杆菌、乳酸杆菌于37 ℃下厌氧培养48 h,以菌落形态、革兰氏染色和生化反应鉴定细菌,计算各平板上菌落数,结果以每1 g 粪便中菌落数的对数值表示(l g CFU/g)。
2.7 统计学分析 通过SPSS 17.0 软件进行处理,数据以()表示,组间均数比较采用单因素方差分析(one way ANOVA)和 LSD 检验。P<0.05 表示有统计学意义。
3 结果
3.1 大黄蒽醌苷对大鼠神经功能评分的影响 表1显示,与假手术组比较,模型组大鼠神经功能评分显著升高(P<0.01);与模型组比较,大黄蒽醌苷高、中剂量组大鼠其评分显著降低(P<0.01)。
表1 大黄蒽醌苷对大鼠神经功能评分、脑梗死范围百分比的影响(, n=9)

表1 大黄蒽醌苷对大鼠神经功能评分、脑梗死范围百分比的影响(, n=9)
注:与假手术组比较,∗∗P<0.01;与模型组比较,△△P<0.01
组别 剂量/(mg·kg-1)神经功能评分/分脑梗死范围百分比/%假手术组 — 0.00±0.00 0.00±0.00模型组 — 2.44±0.53∗∗ 26.79±4.38∗∗大黄蒽醌苷低剂量组 7.5 2.00±0.71 23.64±3.64大黄蒽醌苷中剂量组 15 1.50±0.85△△ 16.97±1.69△△大黄蒽醌苷高剂量组 30 1.22±0.67△△ 9.65±1.55△△
3.2 大黄蒽醌苷对大鼠脑梗死范围百分比的影响 表1显示,与假手术组比较,模型组大鼠脑梗死范围百分比显著升高(P<0.01);与模型组比较,大黄蒽醌苷高、中剂量组大鼠其百分比显著降低(P<0.01)。然后,大鼠断头取脑,TTC 染色,测定脑梗死体积,结果见图1。
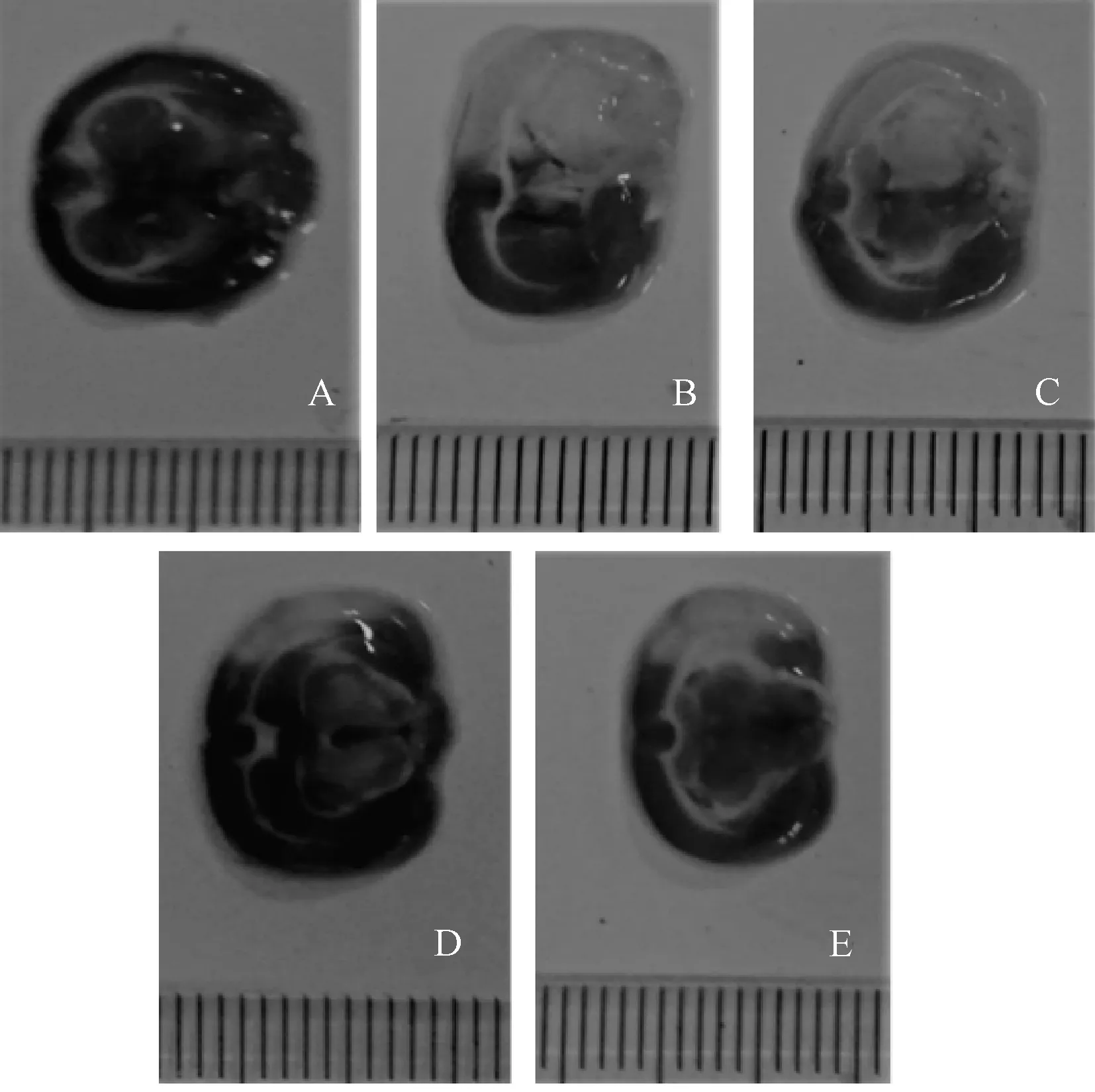
图1 各组大鼠脑组织TTC 染色
3.3 大黄蒽醌苷对 SOD、NOS、LDH 活性及 MDA、LD、NO、IL-1β 和 TNF-α 水平的影响 表2显示,与假手术组比较,模型组 SOD 活性显著降低(P<0.01),NO、LD、MDA 水平及 NOS、LDH 活性显著提高(P<0.01);与模型组比较,大黄蒽醌苷高、中剂量组上述指标显著改善(P<0.05,P<0.01),以高剂量组更明显。
表2 大黄蒽醌苷对 SOD、NOS、LDH 活性及 MDA、LD、NO、IL-1β 和 TNF-α 水平的影响(, n=9)
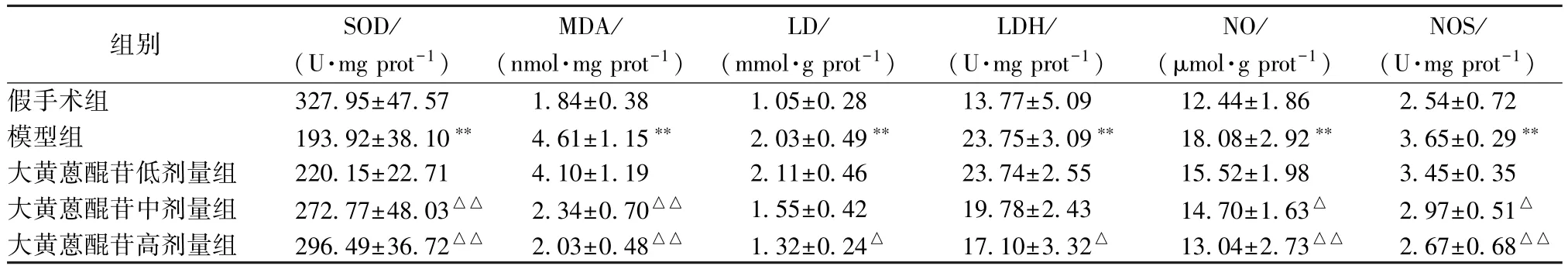
表2 大黄蒽醌苷对 SOD、NOS、LDH 活性及 MDA、LD、NO、IL-1β 和 TNF-α 水平的影响(, n=9)
注:与假手术组比较,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01
组别 SOD/(U·mg prot-1)MDA/(nmol·mg prot-1 )LD/(mmol·g prot-1 )LDH/(U·mg prot-1)NO/(μmol·g prot-1 )NOS/(U·mg prot-1)假手术组 327.95±47.57 1.84±0.38 1.05±0.28 13.77±5.09 12.44±1.86 2.54±0.72模型组 193.92±38.10∗∗ 4.61±1.15∗∗ 2.03±0.49∗∗ 23.75±3.09∗∗ 18.08±2.92∗∗ 3.65±0.29∗∗大黄蒽醌苷低剂量组 220.15±22.71 4.10±1.19 2.11±0.46 23.74±2.55 15.52±1.98 3.45±0.35大黄蒽醌苷中剂量组 272.77±48.03△△ 2.34±0.70△△ 1.55±0.42 19.78±2.43 14.70±1.63△ 2.97±0.51△大黄蒽醌苷高剂量组 296.49±36.72△△ 2.03±0.48△△ 1.32±0.24△ 17.10±3.32△ 13.04±2.73△△ 2.67±0.68△△
3.4 大黄蒽醌苷对 IL-1β、TNF-α 水平的影响 表3显示,与假手术组比较,模型组 IL-1β、TNF-α 水平显著升高(P<0.01);与模型组比较,大黄蒽醌苷高、中剂量组两者水平显著降低(P<0.01)。
表3 大黄蒽醌苷对IL-1β、TNF-α水平的影响(, n=9)

表3 大黄蒽醌苷对IL-1β、TNF-α水平的影响(, n=9)
注:与假手术组比较,∗∗P<0.01;与模型组比较,△△P<0.01
组别 剂量/(mg·kg-1)IL-1β/(pg·mL-1)假手术组 — 234.56±36.70 188.67±30.60模型组 — 363.33±67.47∗∗ 280.74±54.55∗∗大黄蒽醌苷低剂量组 7.5 320.56±55.03 226.83±42.90大黄蒽醌苷中剂量组 15 271.89±42.46△△ 202.22±27.62△△大黄蒽醌苷高剂量组 30 265.74±39.28△△ 202.41±30.94△△TNF-α/(pg·mL-1)
表4 大黄蒽醌苷对肠道菌群的影响(lgCFU/g,, n=9)

表4 大黄蒽醌苷对肠道菌群的影响(lgCFU/g,, n=9)
注:与假手术组比较,∗∗P<0.01;与模型组比较,△P<0.05,△△P<0.01
时间/d 组别 大肠杆菌 肠球菌 乳酸杆菌 双歧杆菌1假手术组 6.21±0.46 4.71±0.38 7.22±0.15 7.97±0.19模型组 7.78±0.23∗∗ 6.82±0.26∗∗ 6.26±0.23∗∗ 6.98±0.19∗∗大黄蒽醌苷低剂量组 7.81±0.11 6.71±0.21 6.33±0.34 7.28±0.17△大黄蒽醌苷中剂量组 7.56±0.26 6.46±0.17 6.38±0.27 7.38±0.17△大黄蒽醌苷高剂量组 7.09±0.20 6.14±0.07△△ 6.72±0.14△ 7.58±0.11△△7假手术组 6.28±0.44 4.82±0.13 7.28±0.24 7.99±0.23模型组 8.40±0.09∗∗ 7.75±0.16∗∗ 5.77±0.20∗∗ 6.39±0.06∗∗大黄蒽醌苷低剂量组 7.89±0.48△ 7.33±0.33△ 5.90±0.21 7.36±0.23△△大黄蒽醌苷中剂量组 7.15±0.30△△ 6.65±0.21△△ 6.50±0.25△△ 7.61±0.07△△大黄蒽醌苷高剂量组 6.35±0.30△△ 5.60±0.30△△ 6.83±0.21△△ 7.82±0.15△△
3.5 大黄蒽醌苷对肠道菌群的影响 表4显示,给药1 d后与假手术组比较,模型组大肠杆菌、肠球菌菌落数的对数值显著升高(P<0.01),乳酸杆菌、双歧杆菌菌落数的对数值显著降低(P<0.01);与模型组比较,大黄蒽醌苷低、中剂量组双歧杆菌菌落数的对数值显著升高(P<0.05),高剂量组能显著抑制肠球菌生成,促进双歧杆菌、乳酸杆菌生成(P<0.05,P<0.01)。给药 7 d 后与假手术组比较,模型组大肠杆菌、肠球菌菌落数的对数值显著升高(P<0.01),乳酸杆菌、双歧杆菌菌落数的对数值显著降低(P<0.01);与模型组比较,大黄蒽醌苷组(除低剂量组对乳酸杆菌无显著影响外)显著抑制大肠杆菌、肠球菌生成(P<0.05,P<0.01),促进乳酸杆菌、双歧杆菌生成(P<0.01)。
图2显示,假手术组中4种菌菌落数的对数值无明显变化(P>0.05);模型组大肠杆菌、肠球菌菌落数的对数值显著上升,乳酸杆菌和双歧杆菌菌落数的对数值显著下降(P<0.05,P<0.01);大黄蒽醌苷组随着剂量增加,大肠杆菌、肠球菌菌落数的对数值呈下降趋势,乳酸杆菌和双歧杆菌菌落数的对数值逐渐增加。
4 讨论
近年来,“菌-肠-脑”轴概念的提出为研究肠道菌群与脑卒中预后提供新的思路和方法,肠道可通过内分泌系统、免疫系统、迷走神经、一些胃肠激素和神经递质等与大脑相互作用[14-15],越来越多的研究表明,肠道菌群与中枢神经系统疾病的发生发展密切相关[16]。本实验显示,与假手术组比较,模型组大鼠肠道内大肠杆菌、肠球菌菌落数的对数值明显增加,乳酸杆菌、双歧杆菌菌落数的对数值显著减少,而大黄蒽醌苷可显著逆转上述现象,表明大鼠脑缺血再灌注损伤后肠道正常微生态平衡受到破坏,而大黄蒽醌苷可使脑缺血后肠道菌群失衡状态得到一定改善。
缺血性脑卒中可引发肠道微生物紊乱,损害胃肠道菌群的功能;反之,肠道微生物改变也会通过炎症反应等来影响大脑损伤的预后[3]。国外报道显示,肠道菌群可有效调节淋巴细胞数量,如调节性 T 细胞(Treg)和 γ δ T 细胞,其失调会对 Treg 细胞和白细胞介素(IL)17+γδT 细胞产生影响,并且两者均参与缺血性脑损伤[17];Benakis等[5]在IS 小鼠模型中发现,缺血性脑损伤急性期后Treg 细胞在缺血组织出现,并分泌大量抗炎细胞因子(IL-10),进而起到神经保护作用;卒中发生后肠道菌群从胃肠道转移到胃肠道以外的器官,应激状态也能促进菌群由消化道转移至血液,从而诱发系统的免疫和炎症反应[18],而免疫和炎症反应已被证实是脑缺血损伤发生机制中的关键环节[17]。本实验显示,与假手术组比较,模型组大鼠脑组织IL-1β、TNF-α 水平明显提高,而大黄蒽醌苷可有效降低,表明该成分能有效抑制炎症反应,进而改善脑缺血再灌注损伤。
正常的肠道菌群结构失衡时,将导致肠黏膜屏障受损,上皮细胞分泌产生更多的活性氧(ROS)[19];SOD 为人体最重要的自由基清除剂,但过多的氧自由基将大量消耗该因子,从而降低其活性[20],而大量 ROS 能攻击生物膜中不饱和脂肪酸,导致脂质过氧化产物MDA 大量产生,损伤组织 DNA[21];NO 以L-精氨酸为底物,在一氧化氮合酶(NOS)催化下产生[22]。研究表明,肠道菌群的紊乱、移位可导致肠道内毒素大量产生,内毒素又可通过诱导NOS合成NO,后者过量时可诱导神经细胞凋亡[23]。本实验显示,与假手术组比较,模型组大鼠脑组织SOD 活性降低,MDA、NO 水平升高,而大黄蒽醌苷可逆转上述现象。
LD 是肠道菌群固有的产物,肠道菌群失调大量繁殖会导致其水平明显升高,进而促进 LDH 活性提高[24]。本实验显示,脑缺血损伤提高大鼠脑组织LD 水平、LDH 活性,表明过多的LD 会损伤脑组织。
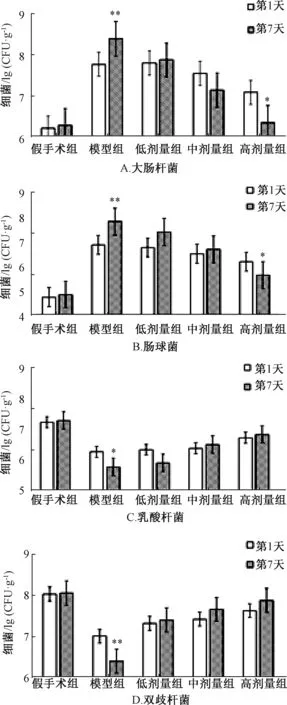
图2 大黄蒽醌苷对肠道菌群的影响
蒽醌苷作为常见糖苷类物质,由于其苷类结构特点而在机体肠道中难以直接吸收利用,需要通过与肠道菌群的相互作用来发挥药效[9]。本实验推测大黄蒽醌苷可能通过调节脑缺血再灌注损伤大鼠肠道菌群,维护肠道微生态平衡,从而缓解炎症反应、氧自由基损伤等,并改善脑缺血性损伤。但目前还无法确认肠道菌群在大黄蒽醌苷治疗大鼠脑缺血性损伤中是否起到主导作用,尚有待进一步研究。