圆二色谱法分析金属离子对鲍鱼脯氨酰内肽酶的作用
李 越,颜龙杰,翁 凌,2,章 骞,2,曹敏杰,2
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建 厦门 361021)
0 引言
脯氨酰内肽酶(prolyl endopeptidase,PEP,EC 3.4.21.26)是丝氨酸蛋白酶家族中的一种大型胞浆酶。PEP对底物的分解特征是能够识别肽链中的脯氨酸残基并实施切割,该酶与多个肌醇循环相关的生理过程有关,如精氨酸血管加压素和促甲状腺激素释放激素的代谢等[1]。PEP不同于典型丝氨酸蛋白酶的特征在于其所作用的底物长度具有一定的限制,其所能作用的底物长度不超过33个氨基酸[2-3]。限制PEP作用底物长度的因素除了底物自身性质外,PEP独特的结构亦是重要的影响因素[4]。PEP作为分子质量较大的蛋白酶,其冗长的一级结构赋予了其折叠为复杂且精巧的三级结构的能力。PEP除了催化三联体所在的核心催化区之外,还具有一个大部分由β折叠特征结构所构成的“螺旋桨”结构,该结构含有7个大致呈中心对称的“桨叶”,与核心催化区通过两个“铰链”结构连接,形成了将典型的丝氨酸蛋白酶的催化三联体包裹在中心的“匣式”外观[5]。由于该结构精密复杂,较长底物中所含有的脯氨酸残基并不能顺利通过“匣式”结构的周边抵达核心区域,导致了PEP对底物长度限制这一性质。这种“匣式”结构广受关注,并已被深入研究[6]。
先前关于PEP的研究多集中在哺乳动物和细菌真菌等领域,有关人PEP在直肠癌检测中的应用潜力[7]揭示了PEP在医学领域的深度挖掘价值。近年报道的水生生物中PEP研究多集中在鱼类[8-9],而对贝类PEP的研究尚未见报道。鲍鱼作为我国重要的高端水产动物,其可食部分腹足具有丰富的蛋白质。关于水产动物在贮藏过程中肌原纤维蛋白和胶原蛋白降解相关酶类,已有丝氨酸蛋白酶[10]、半胱氨酸蛋白酶[11]和金属蛋白酶[12]等。而PEP由于其对底物大小的限制,难以在胶原蛋白和肌原纤维蛋白降解的初期发挥作用。在活体中,作为胞浆酶的PEP应参与胶原蛋白和肌原纤维蛋白的新陈代谢。而对PEP活性的抑制作用,除了较为经典的Z-脯氨醛与SUAM-14746这两种PEP特异性抑制剂外,金属离子、脂肪酸[13]、合成小肽[14]对PEP的抑制作用亦被发现。对蛋白酶而言,金属离子具有多重作用效应,不仅可以作为金属蛋白酶中的必需基团促进其活性,也可以通过与非金属蛋白酶中活性区域发生可逆或非可逆的结合来抑制其活性[15]。
本文使用NCBI数据库中的皱纹盘鲍(Haliotisdiscushannai)脯氨酰内肽酶全长序列(KY214290)中的开放阅读框(open reading frame,ORF)对其进行体外表达,获取高表达、有活性的皱纹盘鲍PEP(Hdh-PEP)后,探讨了几种金属离子对该酶的抑制作用。使用圆二色谱分析确定不同金属离子对Hdh-PEP结构的影响,通过配套软件计算出其二级结构的比例变化并作出比较。通过不同金属离子对Hdh-PEP的作用效果进行分析,初步预测了金属离子的作用机理,为阐明金属离子对PEP的作用提供理论参考。
1 材料与方法
1.1 表达菌株
Hdh-PEP表达菌株(Hdh-PEP-E.coliBL21(DE3))为实验室自保种。沿用原核表达体系,含有以pET-28a为载体的皱纹盘鲍PEP表达载体,并能够可靠表达具活性的Hdh-PEP。完整序列由NCBI数据库获取(GenBank Accession:KY214290)。
1.2 主要试剂
磷酸氢二钠/磷酸二氢钠(AR)和其他无机金属盐类购自上海化学试剂公司;咪唑(AR)购自陇西试剂有限公司;β-巯基乙醇购自AMRESCO试剂公司。镍离子亲和纯化系统(Ni-NTA)购自美国GE Healthcare生物公司。荧光底物Suc-Gly-Pro-MCA购自日本PEPTIDE试剂公司;酵母粉,蛋白胨购自英国OXOID生物公司。
1.3 实验方法
1.3.1 Hdh-PEP的体外表达和纯化
使用酵母粉、蛋白胨和氯化钠配制成总体积为500 mL的标准LB液体培养基,调节pH值为7.0并密封灭菌。冷却至室温后将表达菌株接种至培养基中并加入终质量浓度为50 mg/L的卡那霉素,于37 ℃、200 r/min的条件下培养6 h至A600值为0.6左右后,18 ℃、90 r/min摇床继续培养30 min。之后迅速于超净台内加入异丙基硫代半乳糖苷(isopropylβ-D-thiogalactoside,IPTG)使其终浓度为0.2 mmol/L,18 ℃、90 r/min诱导表达15 h。
将诱导后的细胞离心收集,弃去培养基后,用溶菌缓冲液(25 mmol/L PBS,300 mmol/L NaCl,10 mmol/L 咪唑,5 mmol/Lβ-巯基乙醇,pH= 8.0)重悬细胞。将重悬均匀的细胞悬浮液使用超声波破碎装置处理,处理后的液体在4 ℃下离心,将上清上样于已用缓冲液平衡的Ni-NTA柱上。上样完毕后,使用缓冲液流洗3 h直至杂蛋白洗净。换用洗脱液进行目的蛋白洗脱,带有组氨酸标签的重组蛋白即被洗脱下来。依照洗脱时间收集不同组分进行蛋白质浓度的测定,并收集蛋白质浓度较高的组分。
1.3.2 Hdh-PEP的活性测定
选取对PEP专一的荧光底物Suc-Gly-Pro-MCA进行性质测定。酶活力测定参照Wang等[9]的方法,使用25 mmol/L的PBS缓冲液(pH=6.0),在20 ℃下反应10 min后,加入终止液(V(甲醇)∶V(水)∶V(异丙醇)=35∶30∶35)终止反应。在 380 nm 的激发波长下,利用荧光分光光度计测量其在 450 nm发射波长下的荧光强度,根据荧光强度值标定酶活力。

1.3.3 金属离子对Hdh-PEP活性的抑制作用测定
金属盐溶液将统一以1 mmol/L对应金属离子的最终浓度加入酶液中。以不添加金属离子的酶液作为对照。添加金属离子的酶液按照活性测定方法进行测定。
1.3.4 Hdh-PEP的圆二色谱分析
将纯化后的Hdh-PEP使用超纯水于4 ℃下进行透析并调整蛋白质质量浓度至0.2 g/L。以超纯水作为空白对照,扫描波长范围180~260 nm,步长1 nm。每个样品扫描3次,将平均值进行作图分析。通过CDNN软件计算出各二级结构占比。
1.3.5 金属离子对Hdh-PEP影响的圆二色谱分析
将金属盐溶液加入到PEP中,使其最终浓度为1 mmol/L,并在4 ℃下放置30 min。同时,将1 mL酶液在60 ℃下加热30 min作为高温失活处理组(HT),以未经处理的酶液作为对照。将样品进行圆二色谱分析,通过CDNN软件计算出各处理组中PEP二级结构的占比。
2 结果与分析
2.1 Hdh-PEP的表达与纯化
使用Hdh-PEP表达菌株成功诱导表达并纯化得到了高纯度重组PEP(见图1)。本研究的目的蛋白PEP相对分子质量为80.3 ku,表达载体自带的His标签以及载体序列所编码的肽段序列相对分子质量为5.1 ku,因此,表达蛋白的理论相对分子质量为85.4 ku。诱导表达的目的蛋白在超声破碎后的菌液上清液中大量存在,经Ni2+亲和层析柱后,得到高度纯化(见图1泳道P2),用于进一步研究。
2.2 Hdh-PEP的二级结构与三级结构预测
以NCBI数据库中已登录的Hdh-PEP的原始序列为基础,根据在线软件Prot Param tool (https://web.expasy.org/protparam/)预测,Hdh-PEP的理论相对分子质量为85.4 ku(含重组表达时载体自带标签),等电点为5.93。运用Softberry在线分析其二级结构(http://www.softberry.com/),初步模拟结果表明,Hdh-PEP主要由4种二级结构原件构成,其中,α螺旋占27.05%,β折叠占28.47%,β转角占10.06%,无规则卷曲占34.42%。其中,大量的β折叠和β转角集中出现在Hdh-PEP序列的前部,即“匣式”外观中的N端β螺旋桨型结构域。而α螺旋集中出现在序列后部,即催化区域。在此基础上,使用SWISS-MODEL在线建模,对Hdh-PEP进行三级结构的初步模拟。模拟结果显示 ,Hdh-PEP呈现出经典的PEP匣式结构(见图2),其三级结构明显由两个分界清晰的结构域组成。与图2a即Fulop等[5]对猪PEP的结构模拟结果相比,图2b中Hdh-PEP的三级结构与其基本相似,但在结构细节上仍有区别。

2.3 不同金属离子对Hdh-PEP的抑制效果
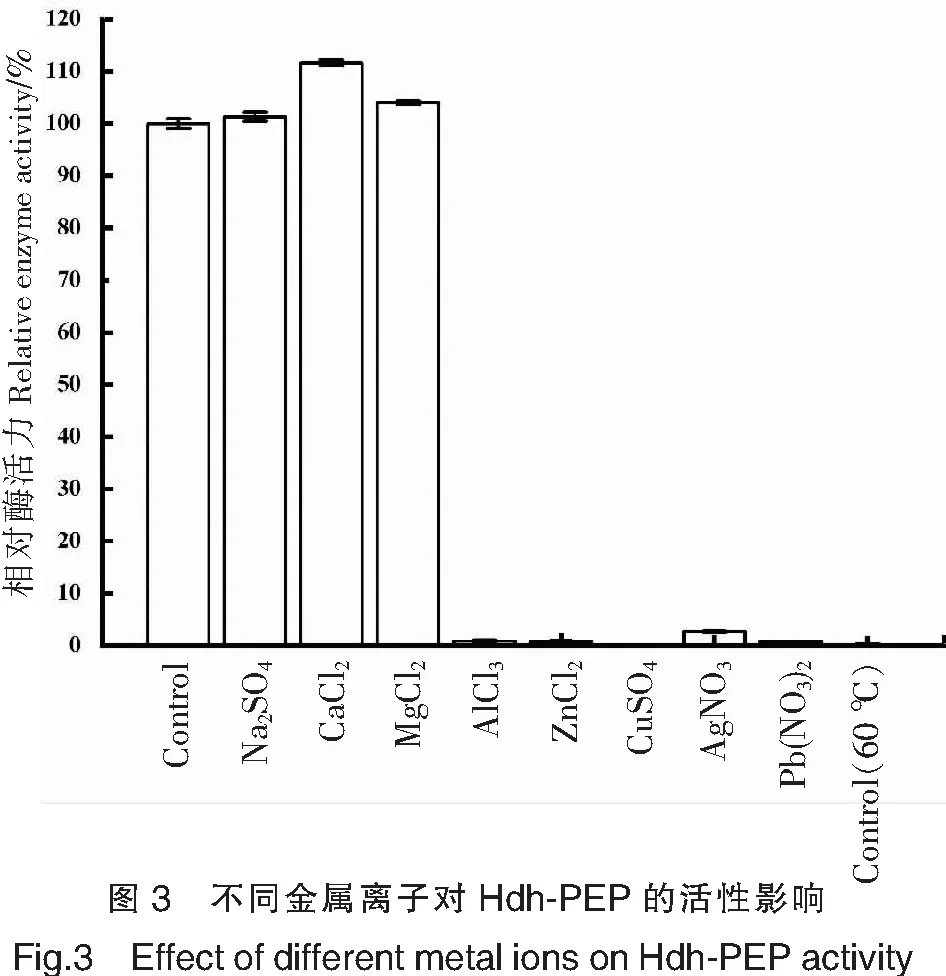
不同金属离子对Hdh-PEP的作用效果见图3。由图3可见,Na+和Mg2+对Hdh-PEP的活性没有产生影响。Ca2+作为多种蛋白酶的激活因子[15],对Hdh-PEP同样产生了促进作用,其相对酶活力增加了约10%。Al3+、Zn2+、Cu2+、Ag+和Pb2+在终浓度为1 mmol/L时对Hdh-PEP活性产生强烈的抑制作用,各组的相对酶活力基本消失。肖琳琳等[13]对鲈鱼PEP的研究表明,Cu2+是PEP的混合型抑制剂,能够有效抑制 PEP的活性。
2.4 Hdh-PEP的圆二色谱分析
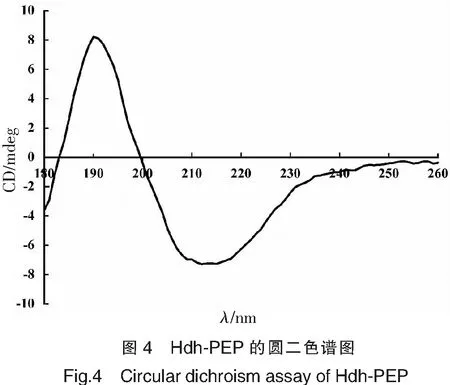
利用圆二色谱对Hdh-PEP进行波长范围为180~260 nm扫描后,汇总数据作图。由图4可见,Hdh-PEP在波长190 nm处出现正吸收峰,在200 nm处峰值变为负值。将图4所示的点阵序列数据导入软件CDNN,计算出Hdh-PEP的二级结构占比。结果表明,在Hdh-PEP的二级结构中,α-螺旋占比28.3%,反向平行结构占比17.4%,平行结构占比8.70%,β转角占比19.00%,无规卷曲占比28.50%。相比于软件预测的结果,圆二色谱扫描结果中的Hdh-PEP含有更多的β-转角结构与更少的无规卷曲结构,但其共同特征均为β-折叠与β-转角元素占据较多的结构比例,与三级结构模拟中体现出的Hdh-PEP的结构特征相符。
2.5 金属离子对Hdh-PEP构型变化的圆二色谱分析
对不同金属离子存在下的Hdh-PEP进行圆二色谱扫描分析,按照无抑制作用和有抑制作用对金属离子进行分组。由图5可见,Mg2+、Ca2+对Hdh-PEP无抑制作用的离子均未在与其共孵育后体现出与对照组相比的图形改变,总体趋势与原酶相近。说明这两种金属离子并未对Hdh-PEP的整体结构产生较大影响。结合节2.3结果,Ca2+对Hdh-PEP的活性具有约10%的促进作用,说明Ca2+可通过直接作用于活性中心的方式促进酶活性。
图6为具有抑制效果的金属离子对Hdh-PEP影响的圆二色谱图。与对照组相比,金属离子组的图线均在扫描范围内产生了偏移,说明其抑制效果与PEP的构象变化有关。本组中,在60 ℃失活温度下处理过样品的圆二色谱图的变化最为明显。各实验组的构象变化均通过CDNN软件计算后总结于表1中。

表1 不同条件处理后Hdh-PEP的二级结构占比

占比Percentage/%ControlMg2+Ca2+60 ℃Ag+Al3+Cu2+Pb2+Zn2+α螺旋 α-helix28.329.729.527.028.327.128.028.627.1反向平行Antiparallel17.413.614.117.617.320.518.417.618.2平行Parallel8.78.98.89.58.88.88.78.59.3β转角 β-turn19.018.218.318.919.019.619.219.119.1无规卷曲 Random coils28.530.530.132.028.827.928.027.530.8
3 讨论
PEP作为一种大型胞浆酶,因与多个激素代谢和神经系统失调进程相关,受到广泛关注。但PEP在生物体内含量低,利用天然蛋白研究其酶学特性有较大难度。本研究采用体外表达法获取了大量具有活性的Hdh-PEP,并研究了多种较常见的金属离子对其的抑制效果。对不同情况下Hdh-PEP的相对活性、圆二色谱数据和二级结构变化情况进行综合分析,可以得出以下结论:在无金属离子存在下,60 ℃作用下的Hdh-PEP失活伴随着α螺旋的减少和无规则卷曲的增加,表明该温度下Hdh-PEP已出现了结构上的损坏,导致其活性降低;Cu2+、Pb2+和Ag+虽然能够强烈抑制Hdh-PEP的活性,但在二级结构占比方面和对照组相比并无明显变化,说明这3种金属离子作用于Hdh-PEP使其失活的机理并非破坏其二级结构,而是倾向于与活性中心结合或是干扰其三级结构,从而使Hdh-PEP丧失活性。
Al3+作为具抑制效果组中相对原子质量最小的金属离子,却依旧有着较强的抑制作用,且Al3+的加入使Hdh-PEP中的反向平行结构明显增加,表明Al3+的抑制作用在一定程度上是由干扰Hdh-PEP的结构所引起的。此外,Al3+作为多种退行性神经疾病的诱因[17],其毒性多体现在和铁促自由基的竞争过程以及对抗氧化酶系统的抑制作用[18],Al3+在强烈抑制Hdh-PEP活性的同时,明显增加了Hdh-PEP的反向平行结构比例,在一定程度上反映了其结合能力对酶结构的影响。
值得注意的是,Mg2+与Ca2+虽不会抑制Hdh-PEP活性,却明显影响了Hdh-PEP的二级结构,且与对照组相比均呈现反向平行结构减少而α螺旋和无规则卷曲增加的趋势。这一差异并未在圆二色谱图中体现得较为明显。实际上,PEP对底物限制的一个重要因素即是“匣式”结构中富含β折叠结构的“螺旋桨”结构。Mg2+与Ca2+的作用可能通过解离部分β折叠结构改善了该结构域的通透性,其详细作用机理和应用潜质值得进一步挖掘。有文献报道,Ag+既可以通过与酶活性中心结合影响其活性,也会通过改变酶的构象破坏其活性[17]。在本研究中,Ag+并未显著影响Hdh-PEP的二级结构比例,其作用或为破坏Hdh-PEP活性中心与底物的结合路径,从而抑制酶活力。Pb2+作为细胞毒性离子,对Hdh-PEP产生强烈抑制效果,但Hdh-PEP的二级结构占比并无明显变化,提示Pb2+可能是通过结合Hdh-PEP的活性区域来抑制其活性的。
Zn2+作为生物体的必需元素之一,在很多金属离子相关酶类中充当辅基,维持多种蛋白酶在细胞质中的结构与功能。但Zn2+的低浓度长期暴露会在水生生物体内累计可观的毒性[19]。本研究中,Zn2+作用下的Hdh-PEP产生了近似于高温失活的构象变化。据此推测,Zn2+可作用于Hdh-PEP使其部分结构被破坏,从而使其丧失活性。
4 结论
金属离子的抑制作用与其生物毒性似乎直接相关,而对蛋白酶的抑制作用的详细机制却具有多样性。本研究通过圆二色谱法对常见金属离子作用下的Hdh-PEP进行二级结构含量分析,通过与对照组和60 ℃失活组的比较,初步推测了各金属离子在影响其活性时的作用机制。今后拟通过测定酶动力学参数等详细指标,对特定金属离子的抑制机理进行探讨,为PEP的生理功能研究提供理论基础。

