微泡菌ALW1几丁质酶Chi18A的克隆及信息学分析
李鹤宾,梁梅芳,陈仲巍,姜泽东,倪 辉,朱艳冰
(1.厦门医学院药学系,福建 厦门 361023;2.集美大学食品与生物工程学院,福建 厦门 361021)
0 引言
几丁质(chitin)又名甲壳素、壳多糖,是以N-乙酰-D-氨基葡萄糖为单体,通过β-1,4糖苷键连接而成的高分子多聚物。它广泛分布在节肢动物的外骨骼、甲壳动物的外壳、真菌细胞壁中[1],在地球上的天然高分子中,其蕴藏量仅次于纤维素,占第二位。尽管几丁质资源丰富,但是,由于它在水和有机溶剂中难以溶解,使得其应用非常有限。几丁质降解后可以生成多种产物,主要包括壳聚糖、几丁寡糖、N-乙酰葡糖胺(GlcNAc)、氨基葡萄糖等[2],它们在食品、医药和农业等领域应用广泛[3-6]。例如:壳聚糖有强化肝机能、增加肠内有益菌等生物活性,被广泛用作功能性食品或饮料补充剂;GlcNAc可用于治疗溃疡性结肠炎、炎症性肠病和骨关节炎等疾病。
几丁质酶作为几丁质的降解工具,它是一类能将几丁质专一性降解为N-乙酰-D-氨基葡萄糖或寡聚N-乙酰胺基葡萄糖的水解酶,其来源广泛[7-9]。几丁质酶不仅在植物的生长发育过程、昆虫的成长蜕皮阶段以及抵御病原真菌入侵方面发挥了巨大的作用,而且还能将其应用在几丁质废物清理和利用中[10-13]。
海洋环境中含有丰富的几丁质,特殊的生存环境使得从海洋环境中分离筛选产几丁质酶的微生物成为可能。先前的研究以腐烂海带为样品,筛选分离出一株微泡菌(Microbulbifersp.ALW1)[14],该菌株可以产生几丁质酶。本研究拟从微泡菌ALW1中克隆几丁质酶基因,并对其序列进行信息学分析,以期为今后研究几丁质酶的结构和功能奠定基础。
1 材料与方法
1.1 材料与试剂
微泡菌ALW1,由本实验室从腐烂的海带中筛选分离;EscherichiacoliDH5α菌株作为目的基因的克隆宿主菌,由本实验室保存。
pMD18-T载体、Taq DNA聚合酶、dNTPs、T4DNA连接酶和DNA标准为TaKaRa公司产品。细菌基因组DNA提取试剂盒购自广州东盛生物技术有限公司。柱式DNA胶回收试剂盒为天根生化科技(北京)有限公司产品。寡核苷酸引物的合成及DNA序列的测定均委托厦门铂锐生物科技有限公司完成。几丁质为Sigma-Aldrich公司产品,其余试剂均为分析纯产品。
1.2 主要仪器
C1000基因扩增仪,美国Bio-Rad Laboratories公司;BioPhotometer生物分光光度计,Eppendorf公司;5417R高速冷冻离心机,Eppendorf公司;SW-CJ-ZFD型双人单面净化工作台,苏州净化设备有限公司。
1.3 方法
1.3.1 几丁质酶的活力测定
将微泡菌ALW1接种于以几丁质为唯一碳源的培养基(0.5%几丁质,0.2% K2HPO4,0.1% MgSO4·7H2O,3.0% NaCl,0.001% FeSO4·7H2O,均为质量分数),25 ℃培养36 h后,取25 mL培养液在4 ℃下、10 000 r/min离心10 min,收集上清液,即为胞外粗酶液。以质量分数5.6%的几丁质胶体溶液作为底物,采用DNS法[15]测定几丁质酶的活力。取100 μL几丁质胶体溶液,加入100 μL粗酶液,在45 ℃下反应1 h后,立即煮沸10 min,加入200 μL DNS溶液,煮沸10 min,测定其在540 nm处的吸光度值。几丁质酶活力的定义:在上述条件下,每分钟催化产生1 μg还原糖(以葡萄糖计)所需的酶量为一个酶活力单位(U)。
1.3.2 几丁质酶基因的PCR扩增
根据菌株ALW1几丁质酶的基因序列设计合成引物,Chi-F:5′-GTCGATTGCTCTGGTTTGT-3′,Chi-R:5′-AAGCGAATCCAGATACGCC-3′。提取菌株ALW1的基因组DNA,将其作为模板进行目的基因的PCR扩增。PCR扩增条件:95 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,30次循环;72 ℃延伸10 min。扩增产物利用琼脂糖凝胶电泳检测后,回收目的基因片段。
1.3.3 几丁质酶基因的克隆
将回收的目的基因产物与pMD18-T载体在16 ℃连接16 h,连接产物转化至E.coliDH5α感受态细胞。在含有100 mg/L氨苄青霉素的LB固体培养平板上涂布IPTG诱导剂(10 μL,0.5 mol/L)和X-gal 底物(50 μL,20 g/L)后,将转化后的细胞涂布在培养平板上,37 ℃培养16 h。从平板挑选白色单菌落进行菌落PCR鉴定重组子,并将PCR阳性克隆子进行目的基因的测序验证。
1.3.4 基因及其编码产物的生物学信息分析
利用DNAMAN软件对目的基因进行序列分析;利用NCBI的BLAST程序在GenBank数据库中搜索蛋白质序列的同源性,并运用ESPript 3.0进行蛋白质序列比对分析;利用ExPASy的ProtParam工具进行蛋白质的理化性质预测;利用Signal P 4.1工具进行信号肽预测;利用SMART工具进行蛋白质的结构域分析;利用NPS服务器(https://npsa-prabi.ibcp.fr/)上的GOR4法进行蛋白质二级结构的预测;利用SWISS-MODEL进行蛋白质的三维结构模拟。
2 结果
2.1 几丁质酶的活力
以几丁质胶体为底物,利用DNS法测定菌株ALW1所产的细胞外几丁质酶的活性。结果显示,胞外粗酶液的比活力达0.8 U/mg。
2.2 几丁质酶基因的PCR扩增
以菌株ALW1的基因组DNA为模板,用几丁质酶的特异性引物进行PCR,琼脂糖凝胶电泳对扩增产物的分析结果(见图1)显示,扩增的目的条带在1600 bp左右。
2.3 几丁质酶基因的克隆
将几丁质酶基因插入pMD18-T载体后,转化至克隆宿主E.coliDH5α筛选阳性克隆子,利用PCR进行鉴定,结果为阳性(见图2),PCR条带的大小约为1600 bp,说明转化成功。将含有目的基因的重组质粒进行测序分析,结果显示,几丁质酶基因的大小为1644 bp。

2.4 几丁质酶基因及其编码产物的生物学信息分析
2.4.1 几丁质酶基因及蛋白质序列分析
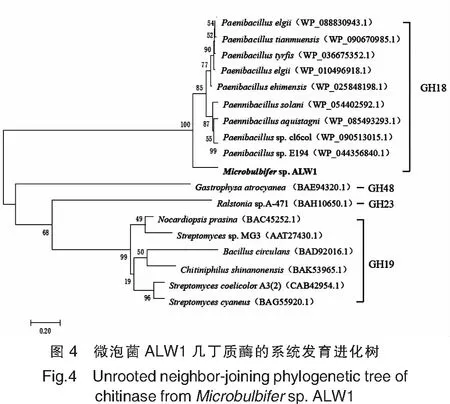
几丁质酶基因大小为1644 bp,预测编码547个氨基酸,N端1~27位氨基酸构成信号肽。将基因编码的蛋白质序列在NCBI的GenBank数据库中进行BLAST同源性搜索,显示其与来源于Paenibacillusehimensis(WP_025848198.1)、Paenibacilluselgii(WP_010496918.1)、Paenibacillustianmuensis(WP_090670985.1)、Paenibacilluselgii(WP_088830943.1)、Paenibacillustyrfis(WP_036675352.1)和Paenibacilluselgii(WP_063177939.1)的几丁质酶分别具有71%、70%、70%、70%、69%和69%的相似性,所以预测目的基因编码产物为几丁质酶。该几丁质酶蛋白质序列与其他来源的几丁质酶序列的比对结果见图3,结果显示,该几丁质酶含有GH18家族几丁质酶的催化模块DxxDxDxE,其中谷氨酸(Glu,E)活性位点为酸碱催化氨基酸残基(图 3黑色方框部分*所示 )。与谷氨酸相近的两个天冬氨酸(Asp,D)不但可以保证多糖链的N-乙酰基正确结合在-1位上,还可以降低谷氨酸的pKa值。将本研究的几丁质酶蛋白质序列与GH家族的几丁质酶蛋白质序列进行系统发育分析,结果如图4所示,该几丁质酶与来自GH18家族的几丁质酶聚在同一分支,将其命名为Chi18A。

2.4.2 几丁质酶Chi18A基因编码蛋白质的理化性质
利用ExPASy中的ProtParam工具对该基因编码的蛋白质序列进行分析,结果显示:氨基酸数为547,相对分子质量为57 469.75 u;理论等电点为4.63,负电荷残基总数为51,正电荷残基总数为24;分子式为C2509H3765N689O830S19,原子总数达7812;预计在大肠杆菌细胞内半衰期大于10 h,在酵母体内半衰期大于20 h,不稳定指数为46.54,该蛋白质分类为不稳定蛋白质。脂肪指数为66.76,总平均亲水性为-0.178。
2.4.3 几丁质酶Chi18A的二级结构和结构域预测
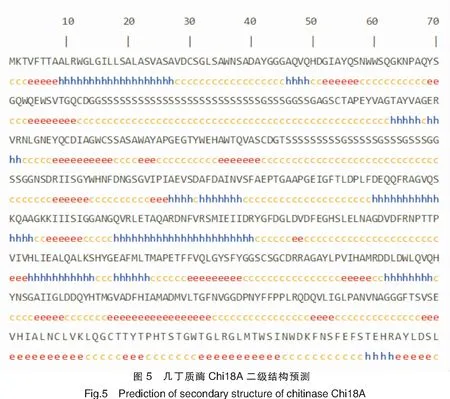
蛋白质的二级结构分析结果见图5,预测几丁质酶Chi18A的二级结构由28.15%的α-螺旋、18.10%的β-折叠和53.75%的无规则卷曲组成。SMART分析结果(见图6)显示,Chi18A的N端33~79位和126~175位氨基酸构成类型3几丁质结合结构域(Type-3 chitin-binding domains,Cht BD3),218~529位氨基酸为GH18家族酶的催化结构域(GH18 catalytic domain,Glyco_18)。


2.4.4 几丁质酶Chi18A基因编码蛋白质的三维建模
将菌株ALW1的几丁质酶Chi18A的蛋白质序列通过SWISS-MODEL进行三维模型的构建,结果如图7所示。模板为来源于Chromobacteriumviolaceum的GH18家族几丁质酶的晶体结构,登录号为4tx8.1.A,覆盖范围为125~546位氨基酸。几丁质酶Chi18A与其他已解析的18家族几丁质酶拥有相似的三级结构,即βα8的“TIM”桶状结构。中心部分是平行的β折叠组成的内桶,外桶由α螺旋组成,内外桶紧贴在一起。底物结合位点在筒底部无规则卷曲附近(见图7)
3 讨论
几丁质酶在食品、农业、能源和环境保护等领域发挥着重要作用。本研究从微泡菌ALW1的基因组中成功扩增了1644 bp的几丁质酶基因片段,该基因编码的蛋白质与其他菌株来源的几丁质酶具有70%左右的相似性。
几丁质酶属于GH家族,其中GH18、GH19、GH23、GH48含有几丁质酶。大多数细菌来源的几丁质酶属于GH18家族,少数真菌来源的几丁质酶属于GH19家族。本研究的几丁质酶属于GH18家族,该酶的结构域包括2个类型3几丁质结合结构域(Cht BD3)和一个GH18家族酶催化结构域。Watanabe等[16]报道 Cht BD3结构域在酶降解几丁质中发挥关键作用,它可持续作用几丁质底物并具有脱乙酰功能,更有利于几丁质酶催化域与底物结合,但具体机理并未完全阐述清楚。通常情况下,几丁质酶只含有一个几丁质结合结构域,本研究中的几丁质酶Chi18A有两个Cht BD3结构域,这样的结构有助于酶与不溶性几丁质的结合,从而提高酶水解能力。几丁质酶Chi18A的同源建模显示,该蛋白质含有(βα)8桶状结构,是GH18家族几丁质酶典型的结构。在GH18家族中,β3和β4链具有相似的结构,是两段高度保守的氨基酸片段,底物结合的部位就在保守序列β3和β4链形成的环状缝隙中。几丁质酶Chi18A的信息学分析与同源建模为研究其结构与功能的关系提供了理论参考。
4 结论
本文将来源于微泡菌ALW1的几丁质酶基因进行克隆和测序,并将该基因的编码产物进行信息学分析。结果显示,该几丁质酶的氨基酸序列与其他菌株来源的几丁质酶有70%左右的相似性。系统发育分析结果显示,该几丁质酶属于GH18家族,命名为Chi18A;二级结构分析预测Chi18A主要由无规则卷曲和α-螺旋组成,结构域分析预测Chi18A有2个Cht BD3结构域和1个GH18家族催化结构域,三维结构模拟分析显示该蛋白质含有(βα)8桶状结构。在后续的研究中,可进行该几丁质酶基因的体外表达、纯化和酶学性质研究以及几丁质酶Chi18A蛋白的分子改造,以改善其酶学性质。

