细菌四类胞外感觉结构域的概述
许阳阳,袁文肃
(天津大学生命科学学院,天津 300072)
细菌在生长繁殖过程中需要适应外界环境的变化以及接受外界信息的输入[1]。细菌通过多种信号传导途径适应外界环境的变化,最常见的有单组分系统、双组分系统以及化学传感系统[2]。其中,双组分调节系统(Two-component regulating system,TCS)是细菌体内最重要的信号转导系统,参与细菌大部分的生命活动,调节细菌适应外界的各种刺激反应,例如抗生素反应、渗透压反应、群体信号、营养反应等。
已知几大类跨膜TCS包括传感器激酶、化学受体、趋光系统[3]。其中,最常见的双组分转导系统通常包括组氨酸激酶传感器以及受体蛋白2个部分,组氨酸激酶传感器存在于细胞膜或细胞质中,根据接收外界刺激的位置不同将细胞感觉结构域分为胞外感觉结构域、膜嵌入感觉结构域和胞质内感觉结构域。组氨酸激酶传感器通过改变它们的磷酸化状态直接响应物理或化学信号,受体蛋白上保守的天冬氨酸接受来自激酶的磷酰基发生磷酸化,磷酸化的受体蛋白通过其C末端的效应结构域直接结合DNA引起细胞反应[4-8]。对大量细菌进行基因组测序后发现,部分细菌的双组分信号转导系统达200多个[9-11]。
化学感觉系统介导趋化性和基于第四型菌毛的运动性,其核心主要包括化学受体(也称甲基趋化蛋白)、CHeA组氨酸激酶和CHeW偶联蛋白形成的三元复合物。化学受体是位于信号通路输入端的功能性信号蛋白,具有检测高度特异性化学效应物,并将趋化信号传导至下游蛋白的功能[12]。细菌中含有大量的化学受体,它们在拓扑结构、传感模式、细胞位置以及配体结合结构域(Ligand binding domain,LBD)的类型上有所不同。组氨酸激酶传感器和甲基接受趋化蛋白[13-15](Methyl-accepting chemotaxis proteins,MCPs)在激酶和反应调节剂的磷酸转移过程中涉及的保守的信号域有相似性。随着科技的发展,基因组学的出现让研究者了解到组氨酸激酶传感器和MCPs之间的相似性。这2种传感器蛋白共享胞内感觉结构域PAS(PER、ARNT、SIM)[16-19]、GAF(c-GMPspecific and-stimulated phosphodiesterases,Anabaena adenylate cyclases andEscherichia coliFhlA)[20,21]、HAMP(for histidine kinases,adenylyl cyclases,methyl-accepting proteins,and other prokaryotic signaling proteins)[22,23],以 及 胞 外 感 觉 结 构 域Cache、4HB(four-helix bundle,4HB)、CHASE(cyclase/histidine kinase-associated sensory extracellular)、NIT(Nitrate-and nitrite-sensing)。
在双组分系统和化学传感系统中的信号结构域高度保守[24],但其LBDs在一级序列和结构方面多样[25],因此胞外感觉域蛋白几乎没有同一性[26]。本研究根据胞外感觉域的结构特性主要介绍了Cache结构域、CHASE结构域、NIT结构域以及4HB结构域这4类胞外感觉结构域的结构特性以及结构与功能之间的关系。
1 Cache结构域
1.1 Cache结构域特征
Cache结构域是原核生物中最常见的1种胞外感觉结构域(图1A),存在双Cache结构域(dCache)和单一Cache结构域(sCache)2种形式,通常存在于双组分组氨酸激酶和MCPs中。Cache结构域由1个长的N末端螺旋和1个或2个球状模块组成。Cache结构域最初作为细菌化学受体和动物钙离子通道共有的配体结合域,同时也是抗神经病变药物的靶点。Cache结构域能够结合一些小的配体分子,比如:糖、有机酸和氨基酸等[27-29]。Cache家族中包含一些与PAS结构域相似的PDC结构域(PhoQ、DcuS、CitA),因此有研究者提出Cache结构域和PAS结构域具有同源性,并提出可能是PAS祖先早期作为胞外感觉域逐渐演化为现在的Cache结构域[30]。
PhoQ传感结构域是类似于PAS的结构域,二价阳离子可以抑制PhoQ的活性,抗菌肽可以激活PhoQ的活性。一般PAS结构域有1个可以与小分子配体结合的凹槽,但PhoQ结构域没有。PhoQ结构域是1个螺旋-转角-螺旋(helix-turn-helix)的结构,这种结构特点形成了1个高负电荷的平面,带负电荷的一面对着带负电荷的磷脂双层,一般需要钙离子维持平衡。目前,已经提出的信号转导机制是当钙离子消耗尽的时候,2个带负电荷的面互斥激活激酶,引起下游反应[31-33]。DcuS和CitA传感器由胞外类PAS结构域(PDC)、2个跨膜螺旋、细胞质PAS结构域和激酶结构域组成。DcuS和CitA能够结合不常见的C4—二羧酸盐(左旋酒石酸盐和右旋苹果酸盐)。
PDC结构域的主要特征是在其中心位置存在5个反平行的β-片层支架,两侧各有1个α-螺旋。PDC的β-片层结构与PAS的β-片层结构相同,其他部分的结构不同。双PDC结构域的形成是由膜远端的PDC结构域插在膜近端PDC结构域的第一个螺旋和第二个螺旋之间[34](图1B)。

图1 Cache结构域在不同传感器中的位置及Cache结构域的三维结构
单核细胞趋化蛋白-N是1个保守的N末端结构域,存在于几种单核细胞趋化蛋白和含缓冲液的蛋白中。HAMP,发现于组氨酸激酶、腺苷酸环化酶、甲基结合蛋白和磷酸酶的1个结构域。树突状细胞结构域的主要特征是在其中心位置有4个反平行的β-折叠支架,每侧有1个α-螺旋。DcuS感觉域的关键残基是Arg107、His110和Arg147。
1.2 d Cache结构域的功能
dCache结构域是由2个串联PAS样亚结构域组成,分为膜近端结构域和膜远端结构域,具有dCache LBD的化学受体对配体的喜好不同。根据已有的研究表明,具有dCache LBD的化学受体识别氨基酸、有机酸、多胺、半乳糖和组胺等[35]。
dCache结构域通过直接或间接的识别方式与小分子结合,通过直接识别的小分子通常与dCache的膜远端亚结构域结合,也有部分与膜近端结构域结合;间接识别配体的方式通常是由底物结合蛋白介导的。
dCache型受体大部分通过膜远端亚结构域与配体结合的方式识别配体,在识别不同氨基酸时以类似于结合异亮氨酸的方式结合到膜远端亚结构域上。有研究表明,荧光假单胞菌CtaA LBD的配体结合口袋可以识别结构和理化性质上不同的氨基酸,配体结合口袋可以根据配体侧链的大小膨胀或收缩[36]。CtaA LBD的蛋白质侧链(R126、W128、Y144、D146、D173)能够识别配体氨基酸上不变的氨基和羧基部分。这5个残基在dCache型化学受体中是保守的,能特异性识别氨基酸。空肠弯曲杆菌CjTlp3 LBD与异亮氨酸相互作用时,配体完全被末端磷腺苷酸结构域吞噬,在蛋白质与配体的侧链和主链部分之间形成广泛的相互作用。对CjTlp3 LBD中与CtaA LBD对应的5个保守残基进行丙氨酸取代(图2A),通过等温滴定量热法(Isothermal titration calorimetry,ITC)试验验证突变后的CjTlp3 LBD显著降低了异亮氨酸结合的亲和力[37]。同样,对铜绿假单胞菌PctA LBD中与CtaA LBD对应的5个保守残基进行丙氨酸取代,通过ITC试验验证PctA LBD突变后显著减少或消除了其与氨基酸的相互作用[38]。这些突变研究为这5个保守残基在识别氨基酸中具有重要作用提供了证据。识别组胺的dCache型受体具有结构相似性。在TlpQ受体中识别组胺的4个关键 残基E170、Y208、D210和D239(图2B),除D210外,其他3个残基同样存在于McpA受体中,这些残基形成与TlpQ相似的配体口袋。在McpA受体中D210被Y174取代在组胺的咪唑环中引起空间位阻[39]。
现有文献中,仅有少量结果证明配体与dCache结构域膜近端亚结构域的结合[40]。幽门螺杆菌TlpC LBD结合乳酸盐是证明dCache结构域通过膜近端结合配体的第一个例子,乳酸与TlpC的配体口袋(由 残 基F202、L210、N213、I218、L223、Y249、L252、S253和Y285)结合(图2C),乳酸盐的羧基和羟基,N213、Y249和Y285的侧链以及L252和S253的主链酰胺形成氢键,将N213、I218、Y285突变为丙氨酸,Y249突变为苯丙氨酸,通过圆二色谱试验显示氨基酸的突变没有引起二级结构的改变,并且ITC试验表明这些氨基酸突变后与乳酸盐的结合能力消失[40]。铜绿假单胞菌McpP受体的sCache结构域以相似的亲和力结合乳酸盐。

图2 化学受体传感器的d Cache结构域
1.3 sCache结构域的功能
化学受体中含有大量的dCache结构域和sCache结构域,虽然这2种结构域都可以结合有机酸,但是它们的配体分布不同。丁香假单胞菌的化学受体PscD含有sCache结构域,能够识别特定的C2和C3羧酸配体。丙酸酯通过羧基氧原子与sCache结构域的4个残基(Y90、H103、Y143和K156)以氢键的方式与受体结合。通过对一系列sCache结构域序列进行比对,Y90、H103和K156 3个残基是高度保守的[41]。KT2440细菌的化学受体McpP含有sCache结构域,可以结合乙酸盐、丙酮酸盐和丙酸盐,McpP基因的缺失导致这些配体的趋化性显著降低[42]。铜绿假单胞菌受体PA2652的sCache结构域能够结合几种C2取代的C4-二羧酸,并且通过ITC试验表明PA2652只结合苹果酸、柠檬酸、甲基琥珀酸的左旋异构体,而不结合右旋异构体[43]。
目前只鉴定了少数的Cache结构域,其中大多数对单羧酸具有高度特异性。虽然Cache结构域与PAS结构域同源,但Cache结构域的功能多样性没有得到充分研究。观察以上几种蛋白dCache中的关键残基的组成可以发现,这些关键残基集中分布在β-片层区域并且大多为极性氨基酸,因此猜测这些极性氨基酸的侧链可能在结合配体中发挥重要作用。dCache结构域通过几种不同的直接或间接的机制结合配体,这些配体结合dCache结构域的膜末端结构域或膜近端结构域或者二者兼有,由于这种多样性,导致对不同的dCache结构域是否共享同一种跨膜信号转导机制仍不清楚。因此,还需对不同dCache结构域的结构与功能进行研究与分析。
2 CHASE结构域
2.1 CHASE结构域的结构特性
CHASE结构域是由200~230个氨基酸残基组成的胞外LBD,存在于细菌、低等真核生物和植物的传感器蛋白的N端或细胞外区域。在CHASE结构域之后会连接PAS、GAF或受体结构域等非酶结构域,以及组氨酸激酶、腺苷酸环化酶、GGDEF和EAL结构域[44]等酶信号结构域。根据数据分析,CHASE的结构与PAS、GAE以及Cache结构域具有相似性,并且CHASE的结构总是在2个跨膜区之间。目前,已经鉴定了从CHASE2到CHASE8 7种CHASE结构域。
CHASE2结构域存在于多种细菌信号传导途径的传感蛋白中,如组氨酸激酶、腺苷酸环化酶、二苷酸环化酶和丝氨酸/苏氨酸激酶。通过SMART分析CHASE2结构域(以Spirulinasubsalsa PCC 9445为例)可能连接非酶结构域以及酶信号结构域(图3A)[45]。CHASE3结构域(Spirulina platensis)一般存在于组氨酸激酶、甲基接受趋化蛋白、腺苷酸环化酶和二胍酸环化酶中,通常与PAS、HAMP和GAF这些非酶结构域相结合(图3B)。CHASE4结构域只存在于信号转导蛋白中,如传感器组氨酸激酶和二鸟苷酸环化酶/磷酸二酯酶(Archaeoglobus fulgidis)(图3C),部分CHASE4的蛋白质含有HAMP[46]和PAS结构域。
根据预测CHASE4结构域可以结合多种低分子配体,如细胞分裂素样腺嘌呤衍生物或肽,并通过各自的受体介导信号转导。另外,CHASE5、CHASE6、CHASE7以及CHASE8都存在于组氨酸激酶中,到目前还没有对CHASE4结构域的完整解析,因此利用Robetta server对CHASE4进行结构预测(图3D),从而可以根据预测的结构特征对CHASE4的功能进行合理预测。
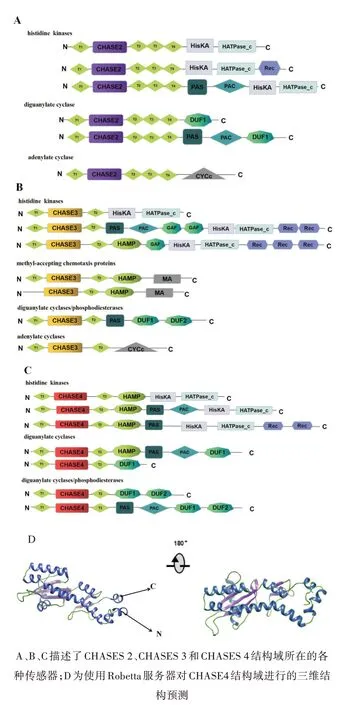
图3 CHASE结构域在不同传感器中的位置及对CHASE4的结构预测
2.2 CHASE结构域的功能
CHASE结构域可以识别环境中的许多信号,例如有机酸、氨基酸和根分泌物中的其他化学化合物[47,48]。植 物 传 感 器AHK4的CHASE结 构 域 是AHK4识别各种化学上不同细胞分裂素的重要结构域,AHK4的配体结合口袋具有疏水残基和极性残基,已发现它们分别接触脂肪族或芳香族尾基和极性腺嘌呤基团[49]。目前在AHK4结构方面的研究有一些进展,但是AHK4识别细胞分裂素的分子机制还不清楚[50]。植物病原体黄单胞菌PcrK的CHASE结构域(图4A)与AHK4的结构(图4B)相似,结合细胞分裂素,以二聚体形式存在。PcrK的CHASE结构域由2个PAS样结构域组成,与AHK4的不同在于PcrK的配体结合口袋大小受细胞分裂素限制。PcrK的配体结合口袋具有高度的疏水性,在14个氨基 酸(I114、P164、L167、V69、R175、T191、V194、L196、S197、Y199、L208、L210、W233和Y235)中有9个是疏水的,其余5个是极性或带电荷的氨基酸[51]。PcrK二聚体结合来自植物的异戊烯基腺嘌呤(iP),L196突变导致PcrK的CHASE结构域无法结合配体,Y191突变破坏识别配体所需构象。同时通过ITC试验证明单独的PcrK无法与iP结合,可能需要1个尚未鉴定的分子帮助PcrK与iP结合[51]。
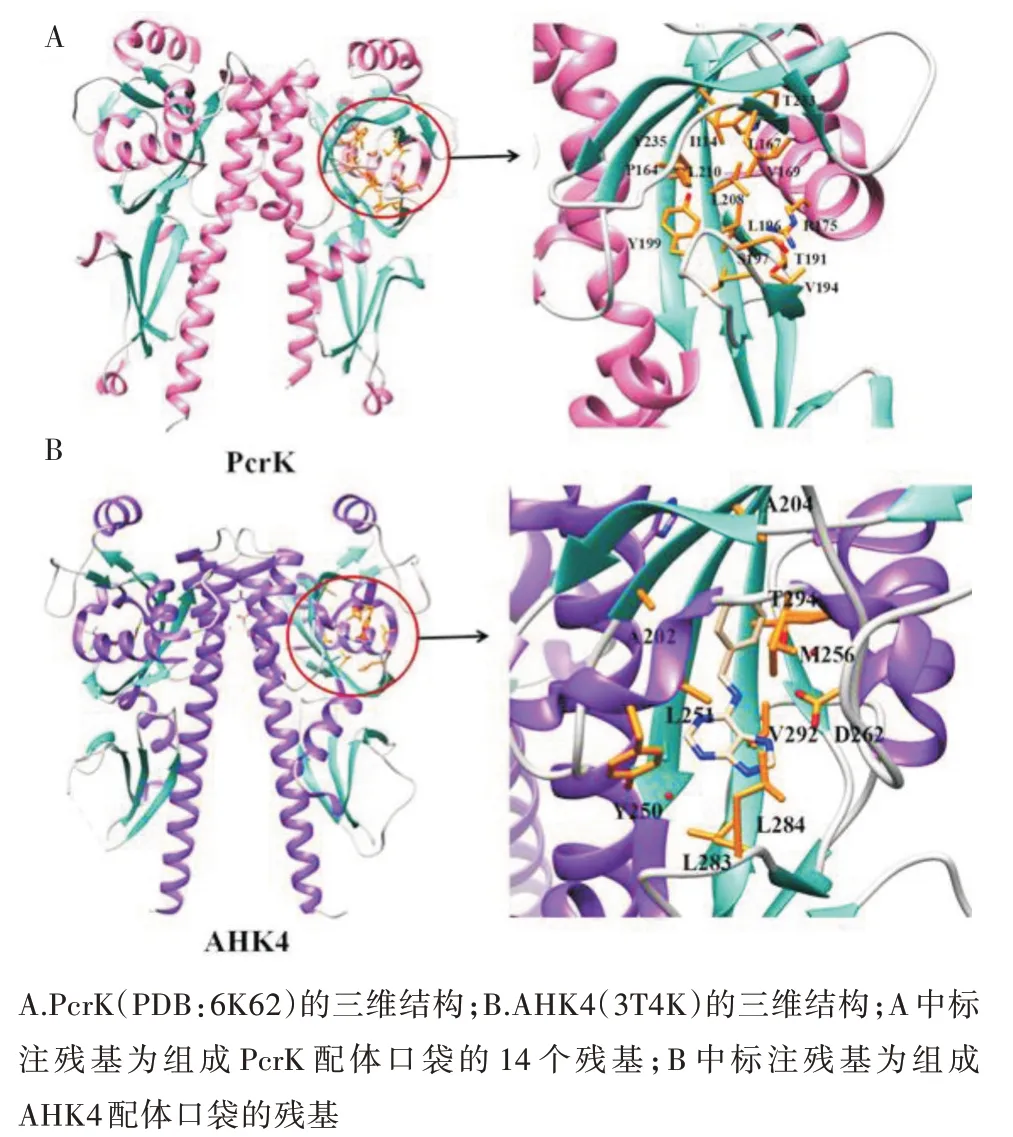
图4 Pcr K和AHK 4的三维结构
目前的研究表明[26],CHASE结构域一般以二聚体的形式存在,但研究者发现CHASE结构域单体和二聚体同时存在,单体如何转变成二聚体,是否与配体结合有关,尚不清楚。
3 NIT结构域
3.1 NIT的结构特性
NIT(Nitrate-and nitrite-sensing)结构域是特异性识别硝酸盐或亚硝酸盐的1种结构域。许多细菌都是通过将硝酸盐还原成亚硝酸盐,亚硝酸盐进一步还原成铵来吸收硝酸盐,也有一部分细菌将硝酸盐当成无氧呼吸时最终的氧化剂,因此NIT结构域在细菌利用硝酸盐的过程中发挥重要作用,同时还可以控制包括基因表达的调节、细胞运动性以及酶活性等多种生物活性。
NIT结构域是在NasR蛋白中发现的,其长度约为200个氨基酸残基。在许多的细菌中都能发现NIT结构域,它与许多的调节输出结构域相关,比如,ANTAR(AmiR和NasR转录抗终止调节因子)、组氨酸激酶、甲基受体趋化蛋白、GGDEF和EAL等(图5A)。NIT结构域(图5B)不同于其他的感觉域,例如PAS和GAF是单纯的胞内感觉结构域,CHASE和Cache是单纯的胞外感觉结构域,但是NIT既可以作为胞内感觉结构域也可以作为胞外感觉结构域[52]。
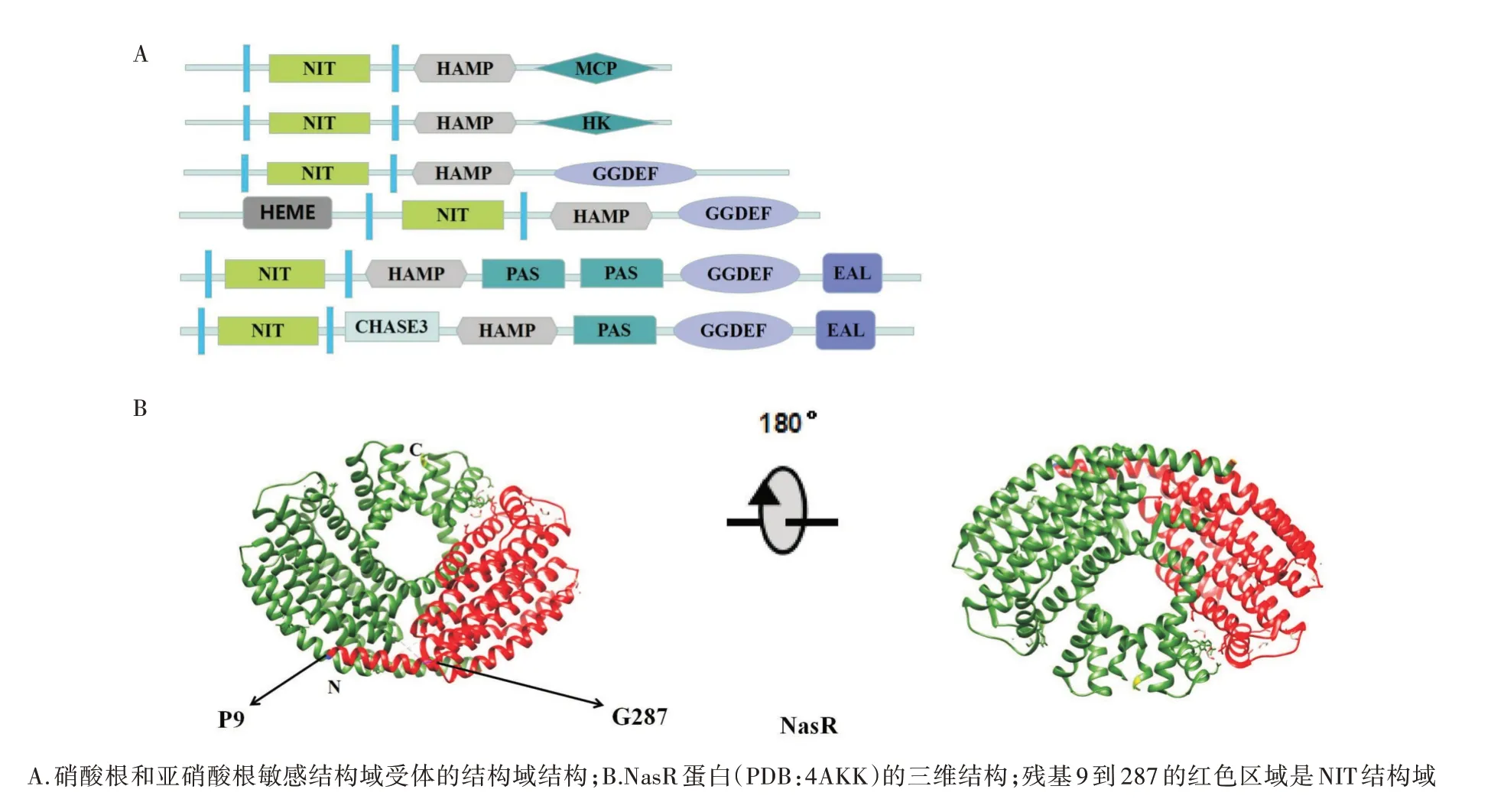
图5 NIT结构域在不同传感器中的位置及NIT结构域的三维结构
3.2 NIT结构域的功能
NasR蛋白是1种RNA结合蛋白,包含1个大的N端NIT结构域和C端的RNA结合ANTAR结构域,NIT结构域将硝酸盐和亚硝酸盐的感知与多种转录和行为反应相结合。之前已对硝酸盐和亚硝酸盐结合蛋白NarX进行研究,NarX输入域是1个四螺旋束的二聚体,通过每个单体中保守的Arg残基的氢键部分结合硝酸盐。NasR蛋白的NIT结构域与NarX输入域的结构和功能具有高的相似性。二聚的NIT结构域的每个单体包含1个四螺旋束,在单体中的1对Arg残基几乎与NarX中的Arg残基完全对应[53]。NasR蛋白通过NIT结构域接受硝酸盐信号,ANTAR结构域结合到RNA上激活nasF操纵子,引起硝酸盐的同化作用。ANTAR的一些残基与NIT结构域中的残基(Q204-N373、D201-R366、R193-E359、E191-R340和Q194-W362)通过形成氨基酸配对相互作用,形成自动抑制机制。通过突变破坏这些相互作用,可以将NIT结构域与ANTAR结构域分离[54],由此可以猜测极性氨基酸在结合配体中发挥重要作用。
目前在很多信号转导途径并且能够调节细胞功能的受体中检测到NIT结构域,在2个螺旋束的界面上关键的谷氨酰胺和精氨酸都是保守的,这是否意味着NIT结构域在这些受体蛋白中同样发挥识别硝酸盐的功能或者具有识别其他配体的功能,还需进一步研究。
4 四螺旋束结构域
4.1 四螺旋束的结构特性
在组氨酸激酶传感器的胞质外发现的另一类常见的全α-螺旋感觉结构域也被称为四螺旋束结构域(four-helix bundle 4HB)[55,56]。在第二个跨膜螺旋上并位于细胞质末端的1个或多个芳香残基可能参与脂质-水界面相互作用,并调节跨膜信号[11]。含有4HB结构域的化学受体一般是同型二聚体,它们有1个很大的周质结构域,由2个相同的反平行的四螺旋束组成。受体的跨膜区是由每个亚单位的2个跨膜α螺旋配对形成的单个反平行四螺旋束[57]。
在组氨酸激酶传感器、MCPs、二鸟苷酸环化酶以及腺苷酸环化酶中都存在4HB结构域。4HB位于2个跨膜螺旋之间,表明4HB结构域只检测细胞外的信号。最初是通过对细菌趋化性天冬氨酸受体的半胱氨酸和二硫键研究发现,4HB结构与HAMP结构域有非常密切的联系,同二聚体HAMP的每个亚单位都有1个螺旋-连接体-螺旋结构,该特点也成为HAMP结构域的标志[58]。位于膜远端的4HB所感受到的外界信号,通过膜近端的平行4HB传递跨膜,然后与HAMP结构域偶联。现有的推测认为,信号传输是通过跨膜螺旋2相对于跨膜螺旋1的类似活塞的垂直位移发生的,信号传递的过程基本可分为3步:①膜远端的4HB作为胞外感觉域结合配体;②将信号通过膜近端螺旋传递给胞质HAMP结构域;③再通过HAMP将信号转换成界面信号传递给组氨酸激酶、腺苷酸环化酶等,将信号传递到下游作出相应反应[59,60]。
4.2 四螺旋束结构域的功能
4HB结构域是在原核生物中分布最广泛的感觉结构域,Tar和Tsr是研究4HB结构域的主要模型,它们的4HB结构域能够识别天冬氨酸和丝氨酸[61,62]。在Tar和Tsr的二聚体界面上有2个配体结合位点,它们具有负协同性[63],配体与其产生相互作用,稳定二聚体的状态。通过X射线衍射解析了Tar与配体复合物的结构,发现结合结构域中与天冬氨酸相互作用的关键残基,在Tar-LBD的2个单体界面上各有1个天冬氨酸结合位点,其中1个结合位点 的 残 基 由B链 的 残 基R64、S68、Y149、F150、Q152、T154和Q155以及来自A链的残基R69和R73形成,而在另1个位点处只发现了与水分子的结合[64]。在Tsr-LBD中的R64和T156的突变明显地影响受体对丝氨酸的感知[65],Tar或Tsr中R64的突变大大降低或消除了配体结合和趋化性。最近有研究发现新的具有4HB结构域的化学受体PcaY_PP,PcaY_PP-LBD二聚体的2个配体结合位点全部结合高亲和力的原儿茶酸盐和奎宁酸盐,低亲和力的配体苯甲酸盐和水杨酸盐只能结合1个位点。PcaY_PP的LBD分别与大肠杆菌Tar和Tsr的LBD仅具有16%和10%的蛋白质序列同一性。在PcaY_PP-LBD中的R71识别配体的羧基,同时配体口袋中有大量极性不带电荷的残基,即N75、S73、S78、Y135、Q142、N158和Q169(图6),它们与结合的配体建立了许多氢键。R71的丙氨酸取代导致所有配体无法结合,N75的丙氨酸取代导致PcaY_PPLBD无法与原儿茶酸盐和奎宁酸盐结合,同时对其他配体的亲和力降低[66]。根据对Tar和Tsr的LBD以及PcaY_PP LBD的配体口袋氨基酸的分析发现大部分的氨基酸由极性氨基酸组成,极性氨基酸的突变直接影响与配体的结合,猜测极性氨基酸在4HB结合口袋里发挥重要的作用。
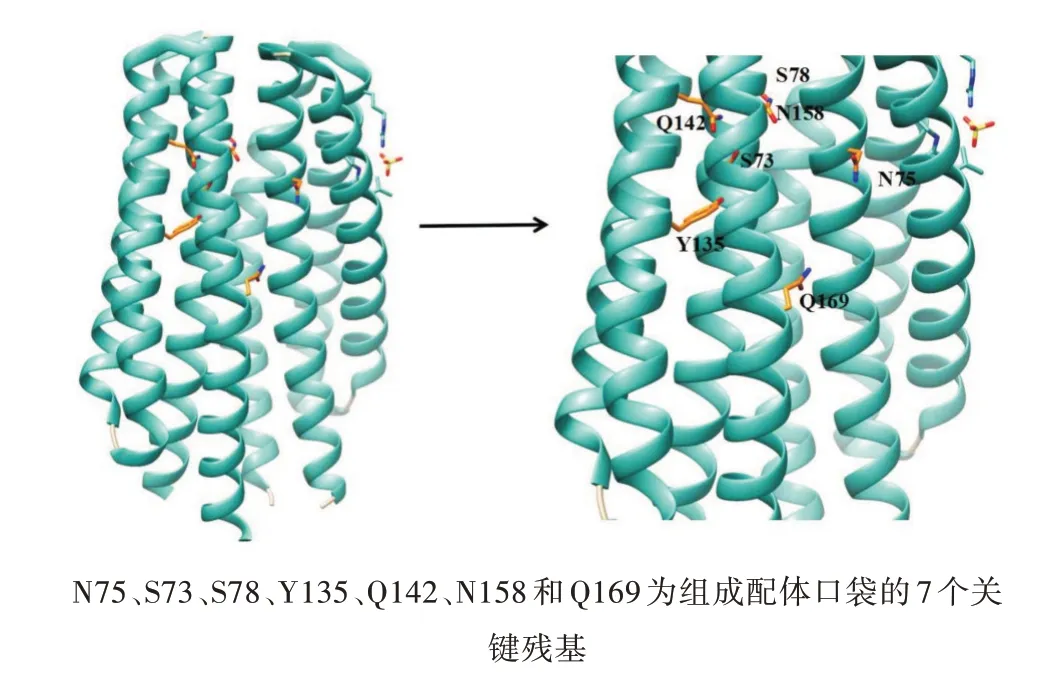
图6 PcaY_PP(PDB:6S1A)的三维结构
尽管4HB是细菌信号转导系统中分布最广泛的细胞外感觉域,但是对4HB的所有了解几乎都来自对Tar和Tsr的研究,那么具有4HB的其他受体中对应Tar的R71是否同样是结合配体的关键残基,是否以相同的传导机制发挥与Tar和Tsr相似的功能,还需要深入研究。
5 小结与展望
双组分调节系统和化学传感系统是细菌感知外界系统的重要组成部分,二者共享Cache结构域、CHASE结构域、NIT结构域以及四螺旋束结构域4种感觉结构域。对Cache结构域、CHASE结构域、NIT结构域以及四螺旋束结构域4种感觉结构域进行分析发现,Cache结构域和CHASE结构域的序列同源性最高。在CHASE结构域中存在类似Cache结构域的2个PAS样结构,根据这些相似性猜测Cache结构域和CHASE结构域可能具有相同的信号转导机制。目前发表的文献中CHASE结构域多以二聚体形式结合小分子[25,26],而天津大学生命科学学院结构生物学实验室通过对CHASE4结构域的研究,发现与已经发表的CHASE结构域不完全一致,其研究的CHASE4结构域存在单体和二聚体2种状态,并针对这种现象提出了2点猜测:一是CHASE4结构域是在单体和二聚体共存的状态下发挥作用,二是CHASE4结构域在原核系统表达时受某种因素影响从部分二聚体体裂解成单体。针对以上2种猜测还需后续从功能以及结构方向的研究进行验证。NIT结构域和四螺旋束结构域都是由螺旋构成,二者具有很高的相似性,这是否意味着二者会有相同的传感机制仍需要深入研究。Cache结构域、CHASE结构域、NIT结构域以及四螺旋束结构域4种感觉结构域结合配体的关键残基大多为极性氨基酸或疏水氨基酸并且在各感觉域中是高度保守的,猜测这些关键残基的特性可能影响配体的种类。
本研究虽然对Cache结构域、CHASE结构域、NIT结构域以及四螺旋束结构域这4种感觉结构域有一定的认识,但仍然存在一些问题没有解决。对于Cache结构域、CHASE结构域、NIT结构域的功能多样化没有进行深入的研究。目前,已经了解双组分传感器和化学传感器的工作模式,但对感觉结构域捕捉到信号后的结构变化以及整个受体蛋白是如何通过结构变化将信号进行传递有待研究,未来基因组学的研究将会揭示更多信号与信号之间的关系,并进一步加深研究者对信号转导的理解。

