脓毒性脑病的神经化学机制研究进展
金 晔,赵博伦,韩晓菲,刘庆平,王 欢*
(1.大连大学生命科学与技术学院辽宁省糖脂代谢重点实验室,中国辽宁大连116622;2.大连大学护理学院,中国辽宁大连106011)
神经化学的研究阐明了神经化学物质在神经系统中的作用机制。这些研究包括对神经元及神经胶质细胞等构成的神经网络中神经递质及神经调质的识别及测定。基于神经机制的神经递质已经被不断发展的神经化学技术所证明。目前,神经化学研究中所运用的技术包括:免疫组织化学、使用种属特异抗体的免疫印迹以及放射性物质的标记等[1~2]。这些包括电生理学在内的技术方法将是研究脓毒性脑病的病理生理学机制的有力工具。同时,神经化学技术可应用于正常大脑中的突触传导、突触的可塑性及神经再生等生理功能检测。另一方面,这些技术还可用于发现脑疾病的发病机制。本文将重点放在重症监护室中常遇到的脓毒性脑病的病理学研究上。
通常情况下,血脑屏障(blood-brain barrier,BBB)是保护机体大脑免于有害物质及外来损伤的防线。然而,脓毒症可致血脑屏障受损(血脑屏障的通透性增强)并使神经递质的释放失衡。此外,在脓毒症过程中细胞凋亡信号通路被激活[3~4],从而使化学分子通过血脑屏障进入大脑,导致神经元细胞坏死并伴随有大脑的局部缺血[5]及水肿[6]。这些病理改变最终导致大脑代谢失衡。现就脓毒性脑病过程中神经递质紊乱等神经化学改变的病理机制、神经调节的治疗作用及量子点纳米技术的应用进行简要总结与讨论,旨在进一步聚焦脓毒性脑病发病环节的研究,不断提高其认识水平,为最终战胜这一病症提供新思路。
1 脓毒性脑病与神经递质
脓毒性脑病是一种破坏性的综合征,为脓毒症所引起的全身性炎症反应,在多器官功能障碍综合征患者中出现。脓毒性脑病患者的症状表现为长期的认知障碍,包括记忆力、注意力以及意识的改变。
目前,许多研究小组针对脓毒性脑病的发病机理进行了较为系统的研究,试图找出有效的靶点[7~13]。Tracey 等[7~8,13]在 2013 年重新将脓毒症定义为由感染引起并伴随器官功能障碍的全身性反应,并在后续研究中证明PINK1-PARK2介导的神经免疫学通路受损可导致脓毒症性死亡,而神经内分泌系统及免疫代谢紊乱可致细胞功能受损,提示这些相关发病机制可能是未来治疗策略的关键[13]。Immura 等[9~10]证明组蛋白乙酰化可以调控 NR2B(N-methyl-D-aspartate 2B subunit)及白介素1受体(interleukin-1 receptor,IL-1R)的表达,并减轻炎症引起的感觉神经元功能障碍。另外,Immura团队将高荧光量子点对小鼠尾静脉进行注射,并通过近红外荧光成像技术观察到了脓毒症小鼠脑静脉血栓的形成,此项技术可实时有效检测小鼠脑血管的病理状态。姚咏明等[12]发现在脓毒症发病过程中,细胞因子和乙酰胆碱(acetylcholine,ACh)之间的相互作用可导致神经元丢失及胆碱能信号异常,因此在脓毒症治疗中应特别重视免疫系统与外周器官的相互作用;同时,他强调进一步了解脓毒性脑病的病因,将有助于今后制定新的治疗方案。Nau等[11]讨论了诊断脓毒症性相关脑病的技术检查与生物标志物的选择,以及当前所用实验方法及临床的治疗方案,提出了可用于今后诊断的新成像技术:1)正电子放射计算机扫描技术,该技术可观察中枢神经系统免疫细胞的活化;2)氧化铁纳米颗粒结合磁共振,该技术可追踪入脑的免疫细胞;3)T2弛豫法和Annexin V法,前者可测脑内铁含量,后者可评估细胞凋亡。这些研究工作都将为今后脓毒症的基础研究与临床工作指明方向并提供新思路。脓毒性脑病的典型特征是:全身的化学物质可通过失去保护能力的血脑屏障进入大脑的神经元中。实际上,研究者们在患脓毒性脑病的小鼠大脑中发现,血脑屏障的基本结构紧密连接(tight junction,TJ)显著减少[14~15]。这可能导致脓毒性脑病患者出现水肿的症状[16~17]。
另外,有研究报告提出在脓毒性脑病中可能存在神经递质的失衡[1,5]。脓毒性脑病状态下的γ-氨基丁酸(gamma-aminobutyric acid,GABA)、多巴胺及乙酰胆碱等神经递质异常的原因可能是脓毒性脑病患者血浆中氨基酸浓度的异常增高[18]。有研究显示,这种血浆中氨基酸浓度的异常与脓毒性脑病的发病密切相关[19]。例如:谷氨酸、天冬氨酸和色氨酸等氨基酸是神经递质或是合成神经递质的原料,而在脓毒性脑病患者中人们发现这些氨基酸水平存在异常[18]。此外,通过研究脓毒性脑病的动物模型,证实这些氨基酸代谢紊乱影响了大脑中的神经递质。在大鼠盲肠结扎和穿刺的脓毒症模型中人们发现,脑中大多数所需的氨基酸水平增高,大脑色氨酸水平的升高可能导致血清素代谢增强,而注射富含支链氨基酸药物可恢复大脑氨基酸水平及正常神经递质特征,提示这些脑神经递质代谢的异常可能与脓毒性脑病的发生有关[20]。此外,在脓毒性脑病大鼠模型中,人们发现单胺神经递质异常与谷氨酸传导功能障碍导致突触可塑性受到干扰[21]。综合上述分析,引起脓毒性脑病的重要原因可能是神经递质失衡引起兴奋性毒性,从而使突触后神经元过度兴奋并死亡,最终导致脑功能障碍。
2 脓毒症中大脑的突触传递机制
2.1 大脑中突触传递的一般机制
神经元细胞是神经系统最基本的构成单位,当来自体内外的信号刺激神经元兴奋,产生神经冲动,神经递质就会从神经元突触前膜释放出来,突触后膜接受神经递质受体与神经递质结合后,使突触后细胞兴奋,此后这些信息在大脑中进行传递(化学突触传递)。谷氨酸、乙酰胆碱及多巴胺等主要神经递质对于维持突触传递和突触可塑性的正常功能是必需的,而这些神经递质的异常将会阻碍突触功能。
2.2 脓毒症对突触受体及其调节机制的影响
脓毒症患者中的突触传递似乎受到影响[7,22]。虽然到目前为止,人们还没有找到脓毒症是导致突触传递异常的直接证据,但是脓毒症诱导的炎症细胞因子改变了突触功能。例如:白细胞介素-1β (interleukin-1β,IL-1β)在脓毒症后浓度升高,从而阻碍神经递质受体的表达,包括天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体[10,21]和 α-氨基-3-羟基-5-甲基-4-异恶唑-丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionate,AMPA)受体[23]。相反,IL-1β可增强抑制性神经递质受体的表达,如GABA受体[24]。此外,一氧化氮合酶(nitric oxide synthase,NOS)的浓度在脓毒症发生后也会升高[25]。可见,这些神经化学物质及其受体对突触传递和可塑性是至关重要的。脓毒症病理过程中的下游物质,如IL-1等细胞因子,可能与突触传递及其可塑性的失衡相关。有研究报道,加入IL-1受体阻断剂来抑制IL-1β可使脓毒症的小鼠有效地恢复长时程增强(long-term potentiation,LTP)诱导并改善脑功能[14]。此外,研究人员发现,通过IL-1受体拮抗剂(IL-1RI antagonist,IL-1ra)可以抑制IL-1诱导GABA激活内向电流(GABA-elicited inward chloride currents,IGABA)的增强延迟。这些结果显示在脓毒性脑病发病过程中IL-1可能改变中枢GABA氨基丁酸能的突触强度,从而导致认知功能障碍[24]。
Imamura等[14]使用脓毒症小鼠模型来验证IL-1与突触功能障碍的关系。研究通过“盲肠结扎和穿刺法(cecal ligation and puncture,CLP)”与假手术组对照来确定差异。结果发现盲肠结扎和穿刺操作所引起的脓毒症导致血脑屏障被破坏,海马区小胶质细胞上的IL-1β表达增高,同时神经元中的IL-1β受体表达也相应增高;但是,长时程增强(LTP)不能在患有脓毒症的小鼠中被诱导;而在使用IL-1β受体拮抗剂进行预处理后,在脓毒症的小鼠中可以成功诱导出LTP。上述研究表明,脓毒症发生后脑内IL-1增加并导致突触的可塑性受损。
虽然目前有关脓毒症过程中突触传递及炎症因子上升的研究已经取得了一定成果,但还有一些关键问题没有解决,主要体现在以下几点:1)对于突触功能而言,类似于IL-1β的其他细胞因子如高迁移率族蛋白B1(high mobility group box-1,HMGB1)[26]和肿瘤坏死因子(tumor necrosis factor,TNF)[27~28]等在大脑中表达丰富且起着调节因子的作用,其中HMGB1在斑马鱼的正常脑发育过程中发挥重要作用,TNF在脓毒性脑病及帕金森综合征等神经系统疾病中过度表达,能否通过改善这些因子的过度分泌或加以消除达到治疗脓毒性脑病的目的尚且不知;2)Imamura等[14]发现CLP诱导脓毒症后IL-1β水平上升且海马区功能受损,但在其他脑区IL-1β的表达及作用尚不清楚。此外,陆续有脂多糖(lipopolysaccharide,LPS)及CLP模型大脑皮层以及脓毒症患者血清及脑脊液中相关因子变化的报道[15,29~30],然而其他脑区的相关数据却少之又少。目前,除海马区及大脑皮层外,在脓毒症模型中其他脑区病理变化及相关机制尚不清楚。脓毒症对海马以外的其他脑区的影响如何尚不清楚。
3 神经调节在脓毒症治疗中的作用及机制
研究者发现在注射LPS大鼠的模型中,交感神经及迷走神经失衡,而刺激迷走神经对脓毒症后交感神经和迷走神经的再平衡和抗炎发挥积极作用[31]。此外,研究结果显示刺激迷走神经或给与乙酰胆碱受体激动剂可抑制感染及促炎因子产生,从而使脓毒症症状得到缓解[32~34]。迷走神经将副交感神经元给出的信号投射到除肾上腺以外的所有器官,并控制乙酰胆碱能的突触传递。Wang等[35]证明了乙酰胆碱能受体对于通过刺激迷走神经抑制巨噬细胞TNF的合成,并减弱全身炎症反应至关重要。迷走神经兴奋可抑制脓毒症引起的肺[36]、肠[37]、脾[34]等器官的损伤。此外,迷走神经兴奋也可抑制巨噬细胞中HMGB1的过度释放[38]。当内毒素诱导脓毒症时,感染部位通过核因子κB(nuclear factor-kappa B,NF-κB)的活化来促进细胞因子的释放。该信号传导途径通过细胞因子风暴加速细胞因子的产生,从而加速细胞死亡[39]。当脑干迷走神经受到刺激时,可通过激活乙酰胆碱受体从而激活胆碱能抗炎通路,并抑制脾脏中的先天免疫反应。乙酰胆碱受体通过激活Janus激酶2(Janus kinase 2,JAK2)-信号转导和转录激活子3(signal transducer and activator of transcription 3,STAT3)途径促使细胞因子释放,从而抑制NF-κB的活化。另外,相关研究用高频电压脉冲对迷走神经进行点刺激,发现脓毒症大鼠模型中的生理参数及脑组织的炎症反应发生改变,进一步证实迷走神经—胆碱能抗炎通路可能通过下调炎性介质表达,对大脑损害的相关机制起保护作用,延缓病情发展,从而改善脑功能[40]。脓毒症导致的胆碱能神经功能障碍可能参与了脓毒性脑病的发病过程,但乙酰胆碱的合成及其受体的变化尚不明确。因此,刺激迷走神经对于脓毒性脑病及其相关炎症的临床治疗可能具有很高的潜力(图1)。
4 神经递质研究方法的展望
已有研究表明,功能性核磁共振成像(functional magnetic resonance imaging,fMRI)等无创性方法可以被用于检测活体组织(啮齿动物及人类等)的脑功能障碍。在脓毒症的小鼠模型中,人们使用高分辨率的fMRI可观察到海马区及大脑皮层等受损区域发生的血管源性水肿[41]。然而,当fMRI检测到血流发生改变时,会将这一现象视为脑功能的改变,这在脑神经科学研究中是存在一定局限性的。为了加强这些薄弱的环节,出现了一种新的纳米技术——单分子量子点成像,该技术可为脑病的研究提供更精确的、特异性更强的临床诊断及病理组织标本检测。
量子点(quantum dots,QDs)是一种纳米尺寸的溶液半导体纳米晶体(直径2~10 nm)。半导体量子点是一种荧光量子点,是在收到光激发或加上电压后产生强荧光发射的纳米材料。使用QDs的免疫组织化学具有宽激发光谱、窄发射荧光光谱、高强度、长寿命和抗光漂白等特点[42]。虽然正常的QDs是亲水性的,但可以将其亲水性特质进行改变以适用于活体研究。Jin等[43]研究出了由谷胱甘肽包被的水溶性的QDs,并且成功在小鼠淋巴结中检测到QDs的信号。此外,QDs还可用于追踪大脑中信号分子的表达,相关研究在脑中检测到经腹腔注射的QDs[44~45]。因此,QDs是一种有潜力的、可以用来跟踪与脓毒症相关的分子的纳米材料。
近红外光是介于可见区和中红外区之间的电磁波,其波长为800~2 500 nm。由于近红外范围内的光线可以穿过颅骨到达大脑表面,并与脑电图记录的人快速事件相关反应相吻合[46],因此,近红外光谱成像技术(near-infrared spectroscopy,NIRS)已被用于追踪脑血流动力学[47]及人脑活动[48]的研究。目前,QDs生物荧光探针已经成功用来标记生物体系的不同成分,如组织、细胞、生物大分子以及动物活体成像等[49~50]。此外,QDs还可应用于分子病理水平的神经外科手术[51]和脑瘤手术[52]。应用QD1100结合近红外荧光成像技术可检测出脓毒症小鼠脑血管中血栓的形成[9]。因此,如果用QDs标记的脑组织成功发射出近红外区域的光,则可以在未来的研究中更加高效地追踪脓毒性脑病相关的分子。另外,可利用QDs标记脓毒症大脑中的神经递质,研究神经递质介导的信息传递机制及调节神经信号的传导过程。但是随着研究的不断深入与扩展,QDs的毒性问题逐渐显露出来,将来能否用于人体研究仍然是一直争论的问题。尽管如此,量子点知识的积累对以后低毒性、无镉量子点的新材料合成及其应用的发展可能会提供很多思路[53~57]。
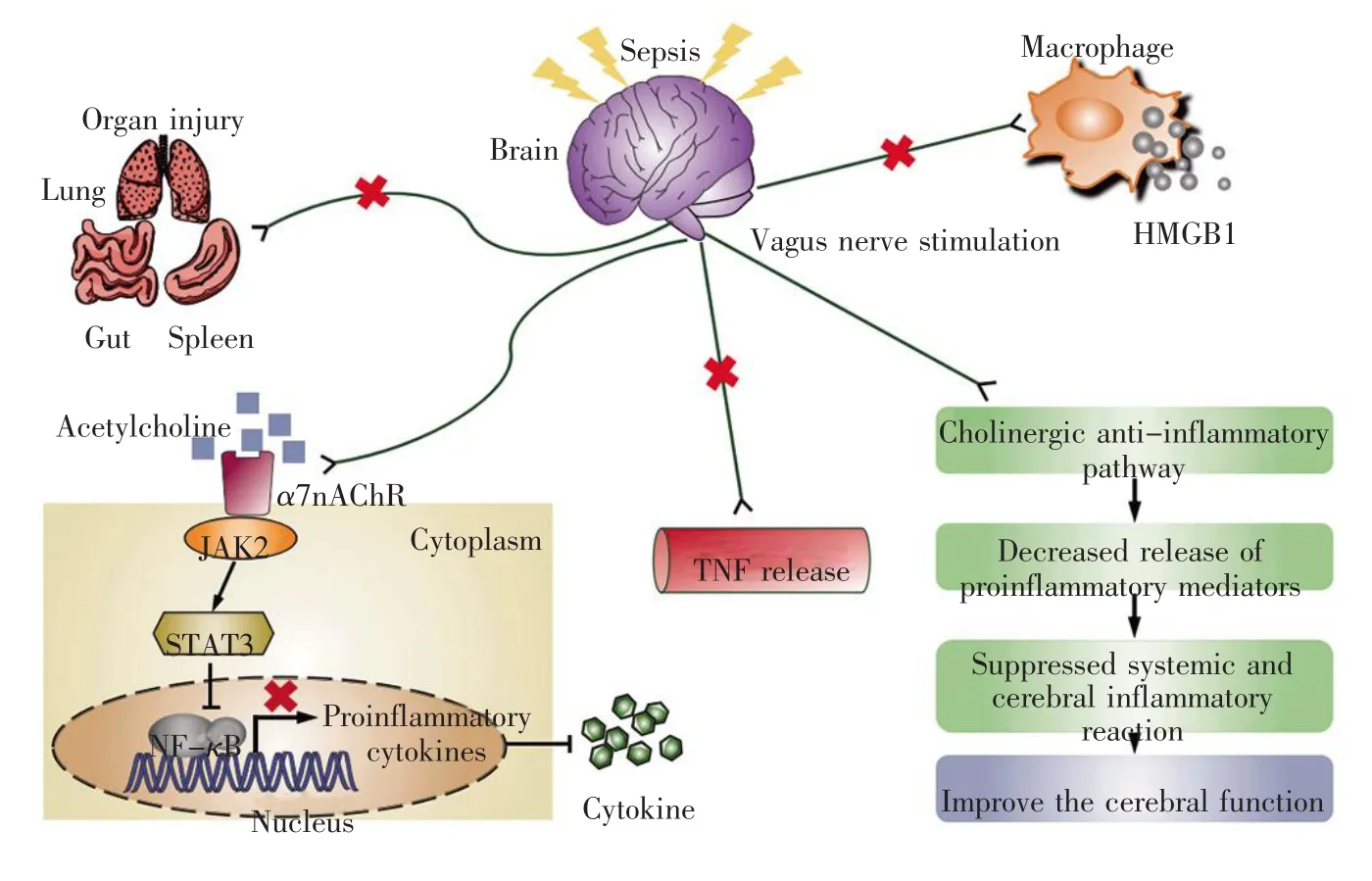
图1 迷走神经刺激胆碱能抗炎通路在脓毒症中的抗炎症损伤作用及其机制Fig.1 The effect and mechanism of vagus nerve stimulation prevents sepsis-induced inflammation and injury via cholinergic anti-inflammatory pathway
5 小结
脓毒性脑病与多种炎症因子受体、白介素家族、Toll样受体、肿瘤坏死因子及高迁移率族蛋白等化学物质有关。由于这些炎症因子可在全身引起炎症反应,并在破坏血脑屏障后影响脑的功能,因此会引起血管源性水肿、突触传递及突触可塑性异常等神经系统相关的病症。虽然脓毒症的分子机制已经渐渐被人们了解,但临床上的脓毒性脑病患者的治疗还仅局限于对症治疗。这可能是由于目前还不能在空间和时间上精确反映脓毒症发病过程中各器官功能分子水平。综上所述,在未来的脓毒性脑病治疗中,可能出现以下两种可能:第一,提供一种具有无毒、高稳定性的既可作为磁共振成像的造影剂又可用于荧光标记检测的量子点材料。比如:采用结合有优良的近红外荧光和磁共振成像技术的超小型QDs,对细胞及分子进行高分辨率双模式有效标记,可实现高灵敏性的活体实时成像,从而追踪到脓毒症动物模型体内相关细胞及分子的动态行为[9,58];第二,为了缓解症状,可采用无创的方法刺激迷走神经。由于刺激迷走神经可以激活乙酰胆碱受体,从而降低炎症因子的过量释放,因此可以此来抑制脓毒症引起的细胞凋亡及组织坏死。总的来讲,运用神经化学机制来研究脓毒性脑病的病理生理,有助于从本质上掌握其病理机制。

