1例中断治疗6年的21-羟化酶缺乏型先天性肾上腺皮质增生症并文献复习
兰 天,姚 辉
(1.江汉大学 医学院,湖北 武汉 430056;2.武汉儿童医院 内分泌遗传代谢科,湖北 武汉 430015)
先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)是由皮质醇合成所需的某种酶缺陷引起的遗传性的代谢性疾病。超过90%的CAH 是由21-羟化酶缺乏(21- hydroxylase deficiency,21-OHD)引起的,发病率为1∶10 000 ~ 1∶15 000[1]。21-OHD 因皮质醇合成所必需的酶缺陷导致17-羟孕酮、雄烯二酮、孕酮等性激素水平升高。女性患者还可伴有生殖器畸形、多囊卵巢综合征、心理发育问题,包括性别障碍、成年后性生活减少,这些都会对女性生育能力造成影响[2]。本文回顾性分析2017年1 例中断治疗6年后来武汉儿童医院就诊的病例,现报道如下。
1 患者资料
患儿徐某,年龄12 岁7 个月,于2017年11月武汉儿童医院内分泌遗传代谢科就诊,并收集患儿的病例资料。
该患儿出生后生殖器模糊不清,无呕吐、腹泻、脱水和低血压,未作特殊处理,于4 岁10 个月,2009年9月7日因两性畸形(Prader 3)行“阴茎切除术,阴蒂成形术”。龟头形成阴蒂后血运良好,术后未经药物治疗。于6 岁2 个月,2011年6月7日因“两性畸形术后,生长过快2年”就诊,患儿身高133.2 cm(> 97 th,相当于8.5岁50 ~ 75 th),体重29 kg(> 97 th,相当于8.5岁50 ~ 75 th),辅助检查结果:睾酮2.06 ng/mL(正常值0 ~0.5 ng/mL),骨龄13 岁;肾上腺CT 示双肾上腺增粗;彩超示子宫探及,双侧卵巢呈青春期改变。诊断为先天性肾上腺皮质增生症。出院后间断口服氢化可的松治疗,早5 mg,中5 mg,晚5 mg,13.5 mg/m2。6 岁2 个月,间断用药约6 个月后,患儿入读寄宿学校,年龄小,父母离异,缺少家庭监督,2011年11月间断外阴出血(具体部位不详)、胸部胀痛,住宿地点偏远,家庭困难,医疗条件欠佳,患儿暂停接受氢化可的松口服替代治疗,于2012年2月自行停药。
停药6年后,我们再次与病人取得联系。患儿12 岁3 个月,于2017年7月来武汉儿童医院门诊复诊,患儿身高144.5 cm(10 ~ 25 th),体重45.5 kg(50~75 th)。辅助检查:17-羟孕酮60 ng/mL(正常值0.07~1.7 ng/mL),雄烯二酮 > 36 ng/mL(正常值0.6~3.1 ng/mL),睾酮19.37 ng/mL(正常值0~0.5 ng/mL);骨龄18 岁,子宫彩超未见明显异常,双侧卵巢显示欠清,开始服用氢化可的松片,早10 mg,中10 mg,晚5 mg,18.4 mg/m2。2017年11月15日为求进一步诊治来该院住院检查。查体:血压101/64 mmHg,身高144.0 cm(3 rd~10 th),体重50.0 kg(75~90 th)。Wt/Ht=30% ~ 50%、体质量指数24.1 kg/m2,腹围82.5 cm,腹型肥胖,特殊面容,小下颌,后发际线低,通贯掌,男性化程度较重。四肢及背部毛发较多,四肢肌肉增多,声音明显男性化,但阴蒂未见明显增大,大小阴唇发育不良,阴毛延伸至脐部,呈菱形(Tanner5)。双乳发育不良。FH = 170 cm、MH = 154 cm、TH =(156 ± 4)cm。染色体46XX。皮质醇测定(早8 点)87.65 nmol/L(正常值118.6 ~ 618 nmol/L),促肾上腺皮质激素703.0 pg/mL(正常值0~46.0 pg/mL)。睾酮1.17 ng/mL(正常值0~0.5 ng/mL),促黄体生成素 3.37 mIU/mL(正常值0.5~9 mIU/mL),孕酮1.81 ng/mL(正常值<0.5 ng/mL)。肾上腺CT 示:双侧肾上腺皮质增生症多考虑,最宽径约13.8 mm(图1)。子宫及双侧卵巢彩超:子宫呈青春期初期改变,形态正常;双侧卵巢呈青春期初期改变,左侧大小2.1 cm×0.7 cm,右侧大小2.9 cm × 1.0 cm(图2)。双乳彩超示:双乳稍大,其内未见明显局限性异常回声。雄烯二酮>10.0 ng/mL。电解质维持在正常水平。经心理咨询后发现患者具有与男性性别角色相关的人格特征,比正常的男孩更具有攻击性。
治疗采用氢化可的松替代治疗,17.2 mg/m2/d。随访1年后17-羟孕酮由>60 ng/mL 降至>20 ng/mL,最近一次复查17-羟孕酮降至19.52 ng/mL。雄烯二酮由>35 ng/mL降至>10 ng/mL。睾酮由19.37 ng/mL降至3.73 ng/mL。子宫从幼稚子宫到青春期初期改变,双侧卵巢从显影欠佳到呈现青春期初期改变。患儿性格较前温和,面部痤疮基本消失,颈背部及四肢毛发减少,皮肤较前细腻。
最终的诊断通过全外显子测序检测得到证实,通过采用芯片捕获高通量测序技术,在检测样本中检出2 个已知致病突变。第一个突变发生在基因CYP21A2;参考序列NM_000500.7;核苷酸变化c.293-13C>G,为IVS2 内含子区纯合突变,该位点父亲无突变,母亲为杂合突变,已有该位点致病的相关报道,该位点在正常人群中发生的概率极低。第二个突变发生在基因CYP21A2,参考序列NM_000500.7;外显子3杂合大片段缺失,该位点父亲为杂合缺失,母亲正常。CYP21A2 基因相关的21-羟化酶缺乏性先天性肾上腺皮质增生症为常染色体隐性遗传,等位基因上存在两个有害突变可导致疾病发生。通过全基因组测序检测染色体,未发现染色体非整倍体变异及已知明确致病的100 kb 以上的微缺失微重复变异。对患儿及父母的c.293-13C>G 采用Sanger 验证,外显子3 位点采用QPCR 验证,结果如图3 所示。
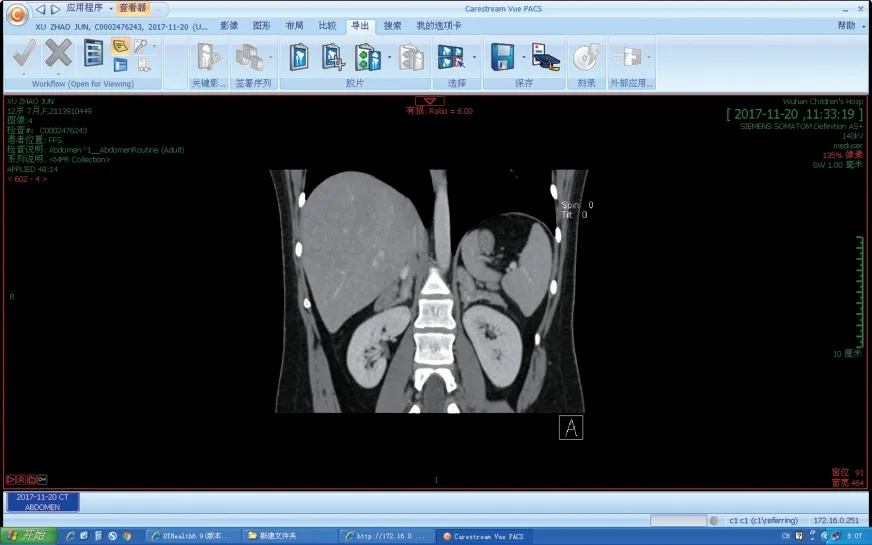
图1 肾上腺CTFig.1 Adrenal CT

图2 子宫卵巢彩超Fig.2 Color Doppler ultrasound for uterus and bilateral ovaries
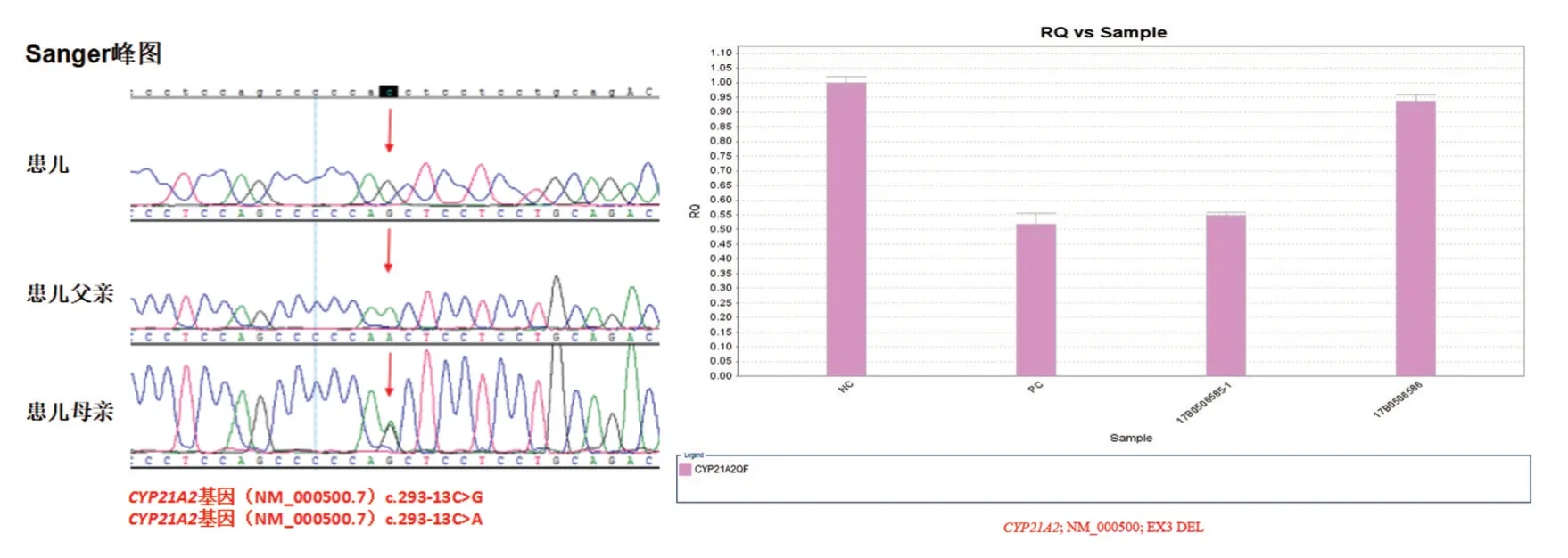
图3 Sanger 及 QPCR 验证Fig.3 Sanger and QPCR verification
2 讨论
CAH 中21-OHD 为最常见的类型,该病临床表现复杂多样。各种肾上腺激素的敏感性和特异性存在不足,但分子诊断学的发展为该患儿提供了明确的诊断依据,随着对该病认识的深入,新发的突变位点已增至200 余种[3]。但仍有部分医生对该病的随访及治疗认识存在不足。21-OHD 导致肾上腺受促肾上腺皮质激素的过度刺激,导致雄性激素分泌增加。基因型对外生殖器男性化的严重程度有影响。携带突变的女性的外生殖表型差异较大。由于21-羟化酶活性的不同,导致该病呈现出一系列临床表现,如产前女性外生殖器男性化,伴或不伴失盐危象(经典型),或迟发性高雄激素症状。21-OHD是46XX,患者外生殖器模糊最常见的原因由肾上腺分泌的19 碳类固醇转化的双氢睾酮堆积导致[4-5]。突变基因CYP21A2 具有较强的基因型与表型对应关系,能引起酶活性完全或几乎完全抑制。这种基因型-表型相关性可扩展到激素水平,该患者携带的突变程度较轻,仍保留部分酶的活性,因此患儿没有呕吐及腹泻等失盐的相关表现,但血清17-羟孕酮、睾酮、雄烯二酮、硫酸脱氢表雄酮的水平均有上升[6]。
有文献报道,21-OHD 中基因型与外生殖器男性化程度相关性存在分歧[7]。最近两个多中心的研究表明,21-OHD 基因突变的严重程度只能解释9%的病例男性化程度。一项印尼的21-OHD 女性患者研究,出生后男性激素水平与阴蒂增大呈正相关。在之前的多中心队列研究中,基因型的严重程度与生后睾丸激素或雄烯二酮水平呈正相关,但这些激素水平与Prader 分期无相关性[8]。产前还有其他因素影响雄性激素活性。21-OHD 中女性轻度男性化时,应注意手术时间的把握,婴儿期阴道尿道较短、可塑性差,存在阴道狭窄需定期扩张的风险,不需要急于手术;手术太迟会影响儿童的心理,建议在3岁以内,内分泌治疗3~6 个月后进行。近年来,女性化手术技术已经发生了变化,过去使用的阴蒂截除术已不再使用,最常用的阴蒂成形术是在解剖神经血管束后取下勃起组织,保留敏感组织。手术的复杂程度与女性外生殖器男性化程度呈正相关。本病例该患儿手术记录阴蒂成形术,但在患儿停药数年激素水平控制欠佳,但体格检查未见明显增大的阴蒂样组织。最近有与21-OHD 术后阴蒂敏感性研究表明,约14%的患者术后阴蒂敏感性降低[9],null 基因型敏感性更低,其他类型突变组之间术后阴蒂敏感性无差异[10]。
该患儿激素控制不理想导致孕激素水平升高、排卵减少,导致子宫和卵巢一过性萎缩。若出现药物难以控制的高雄性激素可导致患者不孕,必要时需切除肾上腺,以实现妊娠所需的低孕激素水平(卵泡期小于2 nmol/L)[11]。经过适当的治疗,大多数患者可怀孕。患者的性别定位与疾病的严重程度及控制的效果相关。雄性激素过高的女性患儿可有男性化性格转变。人类对染色体之外的性别决定因素知之甚少,出生前后雄性激素的暴露对性别认同没有明确的相关性,尽管21-OHD 女性较正常人群更易出现性别焦虑,但很少出现对自身女性身份不认同的现象。性别认同评估与患者的基因型和出生时Prader 评分相关。高雄性激素对生殖器和行为的影响存在差异。有必要在青春期对患儿进行身体和心理发育评估。
21-OHD 患者需要个性化的指导,需要心理、内分泌、妇科和外科多中心联合治疗。该患儿现重新引入治疗后,青春期症状逐渐出现,卵巢从显示欠清到恢复正常的青春期女性卵巢。患儿的症状逐渐好转。尽管一些以前未经治疗的儿童病例,在开始使用糖皮质激素替代疗法后,部分出现真正的性早熟[12]。但替代治疗时用药不规律、17-羟孕酮值长期处于基线之上、父母不了解停止治疗对患儿的远期危害,会使患儿男性化程度进一步加重,从外观和心理社会取向来看,长期未经治疗的患儿会对女性性别失去兴趣。
总的来说,该病的认识不足导致治疗延误的例子并不罕见,需要对于先天性肾上腺皮质增生症的病人进行长期的随访检测,3 岁以内实施阴蒂成形手术,满足患儿日后对生殖器正常外观和性生活的需求,早期进行自我性别鉴定,使更多的患者达到满意的成年终身高,保持正确的社会性别取向和积极的社会心理,拥有正常的生殖能力,并尽可能地减少肾上腺危象对生命的威胁。

