大田软海绵酸类毒素的毒理学研究进展
胡杨杨,陈 思,张小军,严忠雍
(1.浙江海洋大学食品与医药学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江舟山 316021)
大田软海绵酸(Okadaic acid,OA)及其衍生物鳍藻毒素(Dinophysistoxins,DTXs)(结构式如图 1 所示) 是一类亲脂性聚醚类化合物,主要由有毒赤潮藻类鳍藻属和原甲藻属的部分藻类产生[1]。因其底栖性和非选择性滤食特性,贝类极易累积OA和DTXs毒素,导致贝类食用者中毒,出现腹泻(92%)、恶心(80%)、呕吐(79%)、腹痛(53%)、发冷(10%)等症状[2-5]。OA 和DTXs毒素是腹泻性贝毒(Diarrhetic shellfish poisons,DSP)中分布最广、危害最大的一类组分。除能引起腹泻外,OA和DTXs毒素还能损伤肠黏膜,是肿瘤促进因子,具有遗传毒性[6-8]。欧盟对贝类组织中腹泻性贝毒的安全限量为160 μg OA eq/kg,我国出入境检验检疫行业标准则规定任何腹泻性贝毒含量不得大于160 μg OA eq/kg 样品[9]。
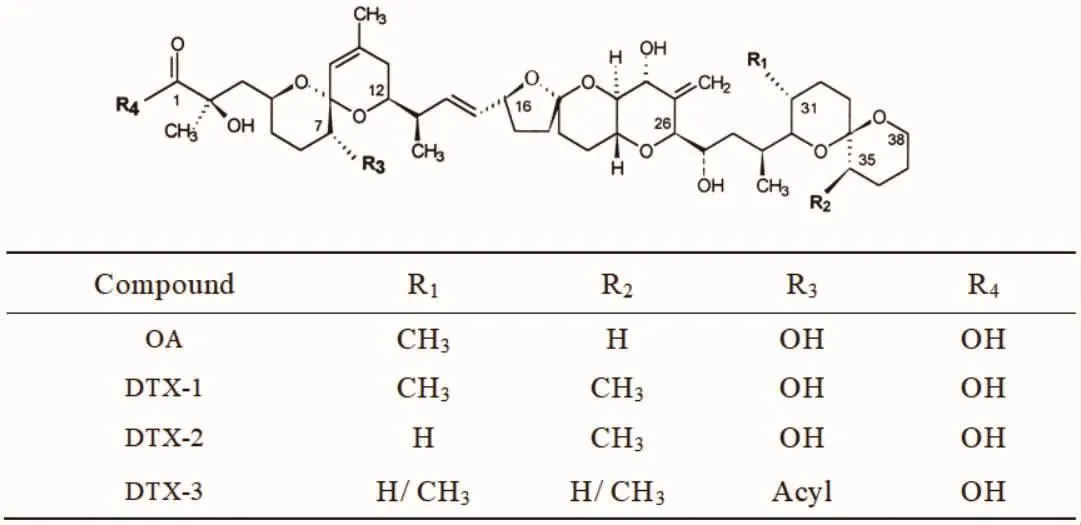
图1 大田软海绵酸、鳍藻毒素结构式Fig.1 Structures of OA and DTXs
OA类毒素除具有腹泻、呕吐等急性毒性,许多研究[32,36-38,50]已证实该毒素还具有潜在的慢性毒性,包括损伤DNA、破坏细胞结构、损害神经及免疫功能、影响胚胎发育等。结合近年来OA类毒素的毒理学研究,本文总结了其在致毒机制、体内实验、细胞毒性、遗传毒性、神经毒性、免疫毒性等方面的进展,以期全面概括此类毒素的毒性作用,同时对未来OA类毒素的毒理研究进行了展望。
1 致毒机理
蛋白质磷酸化是调节和控制蛋白质活力和功能的最基本的生理机制,该过程主要通过丝氨酸/苏氨酸蛋白磷酸酶(serine/threonine protein phosphatases,ser/thrPPs;如 PP1、2a、3、4、5)、酪氨酸蛋白磷酸酶(protein tyrosine phosphatases,PTPs;如 PTP MEG1、MEG2、1B 等)及双功能蛋白磷酸酶(TMDP、VHR、DUSP22等)调控完成[10-12]。研究显示,OA类毒素可作为PP1、PP2A和PP5的烈性抑制剂导致蛋白质过磷酸化,从而对生物的多种生理功能造成影响[13]。从结构上看,OA及DTXs通过其羧酸端C3-C12和尾部C30-C38的螺缩酮与PPs结合产生抑制作用,其中羧基端C3-C12为主要活性位点,通过改变该类毒素C1和C2的结构,可有效降低其对PPs的抑制力[14-15]。
蛋白磷酸酶抑制试验显示,OA和DTXs对PP2a、PP5、PP1的作用趋势相同,对三种磷酸酶的抑制力均依序递减。此外,TWINER et al[16]比较了该类毒素对PP2a和PP5的抑制作用,发现其活性差异均表现为:天然DTX1>天然OA>天然DTX2≈合成DTX2合成2-epi-DTX2,各分析物对PP2a的半数抑制量浓度(IC50)分别为 0.31、0.47、0.99、1.35、137 nM;对 PP5 的 IC50 分别为 1.3、2.3、5.2、4.0、541 nM。而对 PP1 的抑制作用表现为:天然OA>天然DTX1>天然DTX2≈合成DTX2>合成2-epi-DTX2,各分析物对PP1的IC50分别为25.2、34.8、76.4、82.6、3 110 nM。NMR分析显示,DTX2的C35位甲基为纵向结构,不利于与PPs活性位点的结合,导致其抑制力的减弱[17]。可见,OA类毒素非活性位点的结构差异仍然会影响磷酸酶活性,从而产生不同的毒性作用。
2 体内实验研究
目前关于OA类毒素的动物体内实验研究较少,报道中多采用小鼠为研究对象,实验中OA类毒素的暴露方式主要有口服、腹腔注射、灌胃等,以上途径对动物的肝脏、小肠、胃等造成不同程度的损害[18-20]。OA类毒素的急性损伤作用不仅与剂量成线性相关性,还取决于暴露方式和动物种类。经腹腔注射后的小鼠,仅15 min就可观察到其肠上皮细胞的变化,而等剂量静脉注射后该细胞虽然变化类似,但程度不明显[21]。假如口服染毒,则需延长暴露时间或加大剂量才可对动物内脏造成相同的损失或致死率[22]。动物灌胃OA类毒素后,可观察到一定的肝损伤,并引起肠损伤、腹泻、甚至死亡;而静脉注射则对其肠功能几乎不造成任何影响,但导致肝胆管肌动蛋白鞘迅速溶解、肝脏充血、血压过低,高剂量下死亡[23]。
比较不同暴露方式的急性毒性发现,口服产生同等症状的所需剂量是腹腔注射的2~10倍。腹腔注射暴露方式下,据AUNE,et al[24]报道OA和DTX2对小鼠的半致死剂量(LD50)分别为204和352 μg·kg-1,YASUMOTO[25]报道 DTX1 和 DTX3 的 LD50分别为 160 和 200~500 μg·kg-1,TUBARO,et al报道 OA 对小鼠的LD50为225 μg·kg-1[26]。口服暴露方式下,ITO和LE HEGARAT,et al报道OA对小鼠的LD50分别为400和600 μg·kg-1[27],而据TUBARO[26]报道OA对小鼠的LD50则在1 000~2 000 μg·kg-1(1 000 μg·kg-1剂量下,0/5 死亡;2 000 μg·kg-1剂量下,4/5 死亡)。
3 慢性毒性作用
3.1 细胞毒性
OA类毒素能对多种人体细胞(肠道细胞、神经细胞、肝细胞等)的生长产生抑制作用[28-29],此外还能诱变特定基因的表达、天冬半胱氨酸水解酶类的激活、线粒体膜电位的降低、细胞色素c向胞质的释放、细胞骨架的破坏等[30-33],以上多种机制共同作用往往可导致细胞的凋亡[34]。OA类毒素对细胞的毒性作用首先体现在对不同细胞骨架的破坏,如细胞变圆、胞间连接的疏松、微管分解等[35-36]。AO,et al[37]采用微阵列技术和荧光染色技术分析了OA(7.8 ng·mL-1)作用下的小鼠胚成纤维细胞Balb/c 3T3,发现该细胞负责调控细胞增殖、分裂的基因在毒性作用的早期或中期就已显著下调。FIEBER,et al[38]报道人肝脏瘤细胞Caco-2暴露在低浓度(51 nM)的OA导致细胞形态学变化,而高浓度OA(200 nM)作用则导致细胞的凋亡。陈洋等[39]发现10~100 nM浓度的OA就足以对人肝细胞HL-7702和肝癌细胞Bel-7402的增殖产生抑制作用,而这种抑制作用与OA的浓度线性相关。SOLINO,et al[40]系统研究了OA和DTXs对小鼠脑神经瘤细胞Neuro-2a、神经瘤细胞融合细胞NG 108-15、人乳腺癌细胞MCF-17的毒性作用,发现10 nM的毒素水平就可对Neuro-2a和NG 108-15的生长产生抑制,而80~90 nM的毒素水平才可抑制MCF-17的生长。DTX1、DTX2和OA对Neuro-2a的IC50分别为5.46、21.44和11.2 nM,该趋势与OA类毒素对PPs的抑制作用强弱趋势相一致。
3.2 遗传毒性
OA类毒素是一种遗传毒性因子,生物体中毒过程中DNA会发生以下损伤:染色体畸变形成微核、DNA链断裂或氧化、姐妹染色单体的错配、形成8-羟基脱氧鸟嘌呤、小卫星DNA突变等[41-43]。目前对OA类毒素的遗传毒性机制仍然存在争议,一些学者认为该类毒素本身可直接导致DNA的突变。CARVALHO和LE HEGARAT[44-45]利用胞质阻断微核试验和荧光原位杂交技术研究了OA对人克隆结肠腺癌细胞Caco-2、上皮贴壁型细胞 CHO-K1、成纤维细胞、角质形成细胞、白细胞和淋巴母细胞等的毒性作用,发现OA可引起了细胞整个染色体的丢失,证明该毒素的致染色体畸变而非致染色体断裂作用。OA不仅能对遗传物质造成直接损伤,还会影响已被其他基因毒性物质损伤的DNA的修复过程。DNA修复是遗传物质维持自身功能完整性的最重要的一个过程,基因毒性物质的摄入会明显改变DNA修复,从而导致DNA畸形和其他临床症状的出现[46]。VALDIGLESIAS,et al[47-48]运用活细胞染色法和荧光标记法比较OA对人肝细胞、神经元细胞、和T淋巴细胞的影响,观察发现OA均能降低三种细胞的DNA自修复能力,其中人肝细胞又最为敏感。
3.3 神经毒性
尽管OA类毒素不属于神经毒素,但越来越多的研究显示该毒素对神经元和神经系统的毒性作用。OA类毒素对神经元的毒害作用主要表现为诱导神经元细胞的凋亡、蛋白过磷酸化表达、形态学变化等,神经元细胞骨架形态及其功能在细胞完成特定信号传导和生理功能方面发挥着重要作用,多项研究显示神经元骨架与突触传导、递质释放的密切关系[49-51]。OA能改变神经元的结构和功能,并导致与细胞骨架编码、神经递质释放有关的基因的改变。KAMAT,et al[52]利用甲酚紫染色法观察到了OA对大鼠海马体和大脑皮层神经元的致死作用,200 ng OA就能明显降低海马体和大脑皮层细胞对乙酰胆碱的分泌能力,从而干扰正常的神经传导活动。ARIAS,et al[53]在大鼠海马体注射300 ng OA后观察到了明显神经元功能性退化,且这一功能性损伤与OA的量呈现剂量-效应关系。
Tau蛋白与微管的稳定性、长期学习和记忆能力的保持有关,该蛋白质的过磷酸化表达是诱发阿尔茨海默病(老年性痴呆)的病理机制之一[54]。研究发现,OA作用可导致小鼠神经细胞、人神经母细胞瘤细胞、大鼠皮层神经元细胞中Tau蛋白的磷酸化表达[55]。因此,目前已有研究利用OA进行潜在药物的筛选,来预防和治疗阿尔茨海默病及其他痴呆病[56]。
3.4 免疫毒性
免疫系统在动物机体内具有重要的防护作用,是机体不能缺少的屏障,它是OA类毒素的重要靶标之一[57]。体外实验表明,血液中5nM的OA足以致使小鼠T淋巴细胞及其受体的功能下调,进而导致小鼠免疫功能的降低[58]。FRANCHINIA,et al[59]观察了小鼠口服不同浓度OA后免疫器官的变化,发现17.8 ug·kg-1浓度的OA可以引起显著的免疫毒性,包括胸腺形态功能的改变和萎缩、淋巴系统的衰竭等。KAMAT,et al在观察OA对小鼠的神经毒性作用时同时发现经侧脑室注射OA后大鼠会出现记忆缺失,其海马和皮质区内的促炎细胞因子肿瘤坏死因子α(TNF-α)和白介素-1β(IL-1β)含量增高,证明神经炎症的发生。目前关于OA类毒素的免疫毒性及其作用机理还有待进一步研究,以明确其对人体免疫系统的潜在影响。
4 研究存在的问题和展望
OA类毒素是一种常见的海洋生物毒素,摄食受其污染的海产品极易引起急性中毒症状如腹泻、恶心、呕吐等。该毒素能选择性抑制蛋白磷酸酶的活性,已有学者利用这一特性开展细胞通路的相关研究。近年来关于OA类毒素毒理学的研究日趋成熟和完善,通过深入研究该类毒素的细胞毒性、遗传毒性、神经毒性和免疫毒性,已证明其不仅是急性腹泻因子,其在细胞、分子和基因水平上也危害极大。
目前欧盟和一些地区对该类毒素的安全限量仅着眼于减少因误食含毒贝类而造成的胃肠道不适症状,这意味着消费者可能长期摄入含低浓度腹泻性贝毒的贝壳产品,必须对该类毒素的安全限量标准重新评估以提供更好的摄食指南。此外,尚未出现关于人体对OA类毒素的吸收、代谢或排泄的毒理学数据,或该类毒素对人体的慢性或亚慢性作用的报道,但体内和体外研究已揭示了该类毒素的慢性暴露与生物体消化系统癌症之间的相关性。

