细辛多糖的提取工艺优化及细胞衰老保护作用
任 婷,宋天一,牟莹莹,许梦然,满枋霖,孙 新,*
(1.北华大学药学院,吉林吉林 132013;2.吉林省分子医学老年重点实验室,北华大学医学院,吉林吉林 132013)
血管疾病如脑梗塞、心肌梗塞、冠状动脉钙化的发病率及死亡率逐年攀升并趋于年轻化[1]。血管衰老是促进心血管疾病发生发展的重要危险因素[2-3],与平滑肌细胞的健康密切相关[4-5]。血管平滑肌细胞是构成血管壁组织结构及维持血管张力的主要细胞成分[6],其血管和功能的改变是导致高血压、动脉粥样硬化、血管成形术后再狭窄等多种心血管病的细胞病理学基础[7-8]。研究血管平滑肌细胞的衰老作用对心脑血管疾病的诊断及治疗具有重大意义。依托泊苷(Etoposide,Eto)是一种阻碍DNA修复的细胞周期特异性抗肿瘤药物[9],使细胞周期阻滞于G1期发挥作用[10-11],通过DNA损伤诱导细胞衰老。
细辛为马兜铃科多年生草本植物北细辛(AsarumheterotropoidesFr. Schmidt var. mandshuricum(Maxim.)Kitag.)、汉城细辛(AsarumsieboldiiMiq. var.seoulense Nakai)或华细辛(AsarumsieboldiiMiq.)的干燥根和根茎[12-13],《神农本草经》中被列为上品[14],有“小毒”[15],细辛主要活性成分有:多糖、甲基丁香酚、黄樟醚、马兜铃酸、生物碱以及一些微量元素[16-22]。细辛生物碱和醇提液对心血管系统具有强心、降压、扩张血管、松弛平滑肌、增强脂质代谢等作用[23-25]。
本课题组长期从事多糖抗衰老活性组分筛选工作,衰老标记物β-半乳糖苷酶检测模型发现细辛多糖(Asarumpolysaccharides,ASP-1)具有抗衰老活性。现有文献中,细辛多糖的提取为简易的热水提取法[26-27],未见响应面法优化细辛多糖提取工艺及细辛多糖对血管平滑肌细胞衰老保护作用的报道。因此,本文采用响应面法优化细辛多糖提取工艺,采用Eto作为衰老诱导物,探讨ASP-1对其诱导的大鼠主动脉平滑肌细胞(Rat aortic smooth muscle cells,A10)衰老的保护作用,旨在为细辛的进一步开发利用提供参考。
1 材料与方法
1.1 材料与仪器
细辛根部 长白山特色植物种植基地,按照中华人民共和国药典标准鉴定;大鼠主动脉平滑肌细胞(A10) 北京中原合聚经贸有限公司;DEAE-纤维素 英国Whatman公司;Sepharose CL-6B 美国GE公司;单糖 标准品,中国食品药品检定研究院;DMSO 美国Sigma公司;BCA蛋白浓度测定试剂盒、细胞衰老β-半乳糖苷酶染色试剂盒 上海碧云天生物科技有限公司;DMEM、胎牛血清 美国Gibco公司;MTT 美国Amresco公司;其它试剂 均为分析纯。
1.2 实验方法
1.2.1 细辛多糖提取的工艺流程 将干燥的细辛根粉碎称重,80%乙醇回流脱脂24 h。选择适当的提取温度、提取时间和液料比,将残渣热水浸提,得到的粗提液滤过后在30~70 ℃、真空度-0.03~-0.09 MPa下减压浓缩至一定体积。连续剧烈搅拌下缓慢加入4倍体积无水乙醇,4 ℃静置过夜,3500 r/min离心沉淀多糖,依次用无水乙醇、乙醚洗脱干燥得粗多糖。将粗多糖溶于蒸馏水配制成5%的糖溶液,-80 ℃冰箱反复冻融离心去蛋白质,接着向糖溶液中加入适当体积的链霉菌蛋白酶消化4~24 h,按体积比4∶1加入Sevag试剂(氯仿∶正丁醇=4∶1)剧烈振荡1 h,3500 r/min离心取上清,重复至无变性蛋白质出现。截留分子量3500 Da透析除去小分子物质,冷冻干燥得到细辛多糖。根据下式计算细辛多糖得率:
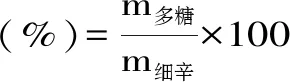
式中:m多糖为提取出的细辛多糖的质量,m细辛为多糖对应的细辛原材料的质量。
1.2.2 单因素实验 按照1.2.1多糖提取工艺流程,研究提取温度、液料比、提取时间 3个因素对细辛多糖得率的影响。
1.2.2.1 提取温度对细辛多糖得率的影响 在提取时间为2 h、液料比为30∶1 mL/g的条件下,提取温度分别设定为60、70、80、90、100 ℃,考察不同提取温度对细辛多糖得率的影响。
1.2.2.2 提取时间对细辛多糖得率的影响 在提取温度为90 ℃、液料比为30∶1 mL/g的条件下,提取时间分别设定为1、1.5、2、2.5、3 h,考察不同提取时间对细辛多糖得率的影响。
1.2.2.3 液料比对细辛多糖得率的影响 在提取温度为90 ℃、提取时间为2 h的条件下,液料比分别设定为10∶1、20∶1、30∶1、40∶1、50∶1 mL/g,考察不同液料比对细辛多糖得率的影响。
1.2.3 Box-Behnken响应面法(BBD-RSM)优化多糖提取工艺 BBD-RSM评估基于单因素实验的提取参数组合效应[28-30],参数变量包括提取温度,提取时间和液料比,以多糖得率(%)作为响应值。该设计由17个具有五个中心点的组合组成,以计算该方法的可重复性,方差分析中F值和p值用于检验回归系数的显著性,通过对各项回归系数进行回归拟合,得到二次多项式回归方程,并验证多项式模型的准确性,实验因素水平设置见表1。

表1 实验因素水平及编码
1.2.4 ASP-1的分级纯化及抗氧化活性筛选 根据BBD-RSM获得的最佳提取条件提取细辛多糖,将细辛多糖配制成5%的糖溶液,0.45 μm滤过后使用KTA explorer 100 层析系统分级纯化多糖。DEAE-纤维素(3 cm×30 cm)用0→1 mol/L NaCl梯度洗脱,收集洗脱液,苯酚-硫酸法测定多糖含量,得到两个主要多糖组分,分别为中性多糖ASP-1和酸性多糖ASP-2,透析后分别用Sepharose CL-6B(2.6 cm×100 cm)柱层析进一步纯化,0.15 mol/L NaCl洗脱,得到分子量均一的细辛多糖组分,仍命名为ASP-1和ASP-2,透析后冻干[31-32]。苯酚-硫酸法测定多糖含量。BCA蛋白浓度测定试剂盒检测蛋白质含量。DPPH自由基(对1,1-二苯基-2-苦苯肼自由基)清除实验测定体外抗氧化活性,以维生素E(VE)作为阳性对照,步骤如下:分别取25、50、100、200、400、800 μg/mL的多糖溶液和维生素E 100 μL加入96孔板中,再加入2×10-4mol·L-1的DPPH溶液(无水乙醇配制)100 μL,混匀,避光室温静置30 min,在517 nm波长处测定吸光度,根据下式计算清除率:

式中:A3为不同浓度多糖加DPPH测得的吸光度,A2为不同浓度多糖加水测得的吸光度,A1为水加DPPH测得的吸光度值,A0为水测得的吸光度。
1.2.5 MTT细胞活力测定 用含有10%胎牛血清的H-DMEM培养液,将处于对数生长期的A10细胞(4000 cells/孔)接种于96孔板,置37 ℃、5% CO2的培养箱中培养24 h后,将ASP-1分别以25、50、100、200和400 μg/mL的终浓度预处理细胞,设置空白组(只加培养液,不加细胞和ASP-1)、对照组(加细胞和培养液,不加ASP-1)和Eto模型组(加细胞和培养液),每组设置5个复孔。37 ℃、5% CO2培养箱中培养24 h后,在ASP-1预处理组和Eto模型组中加入Eto(终浓度为6 μmol/L)继续培养24 h。随后吸去上清液,每孔加入200 μL的H-DMEM培养液和20 μL的MTT溶液(终浓度为0.5 mg/mL)置培养箱中培养4 h。吸去上清液,每孔加入150 μL DMSO,摇床10 min,在490 nm处测定吸光度。根据下式计算细胞存活率:

式中:A实验组为加药处理组(ASP-1预处理组和Eto模型组)测得的吸光度,A对照组为不加药物组测得的吸光度,A空白组为不加细胞和药物组测得的吸光度。
1.2.6 衰老相关β-半乳糖苷酶(SA-β-gal)染色分析 MTT实验确定200 μg/mL为ASP-1保护Eto诱导的A10细胞衰老的最佳剂量后,用含有10%胎牛血清的H-DMEM培养液,将处于对数生长期的A10细胞(30 000 cells/孔)接种到12孔板,置37 ℃、5%的CO2的培养箱中培养24 h,ASP-1(200 μg/mL)预处理细胞6 h,接着6 μmol/L Eto诱导48 h,正常培养48 h后,根据Beyotime生物技术研究所的说明,使用细胞衰老β-半乳糖苷酶染色试剂盒评估细胞衰老水平,倒置荧光显微镜下拍摄阳性细胞[33]。
1.3 统计分析
Design Expert软件(版本8.0.6)用于响应面分析,GraphPad Prism 5软件用于统计计算,实验设计三个平行,数据表示为平均值±SD,ANOVA单因素方差分析用于组间比较,p<0.05为差异有统计学意义。
2 结果与分析
2.1 单因素实验
2.1.1 提取温度对细辛多糖得率的影响 提取温度对多糖得率有明显影响。如图1,提取温度由60 ℃升高到100 ℃时,多糖得率呈持续升高趋势,从6.57%升高到9.31%。这与理论相符合,一定温度范围内,温度升高使分子移动速率加快,多糖的溶出速率上升[34]。考虑到过高的温度可能会影响多糖的稳定性,将响应面试验中温度变量设定为90~100 ℃。
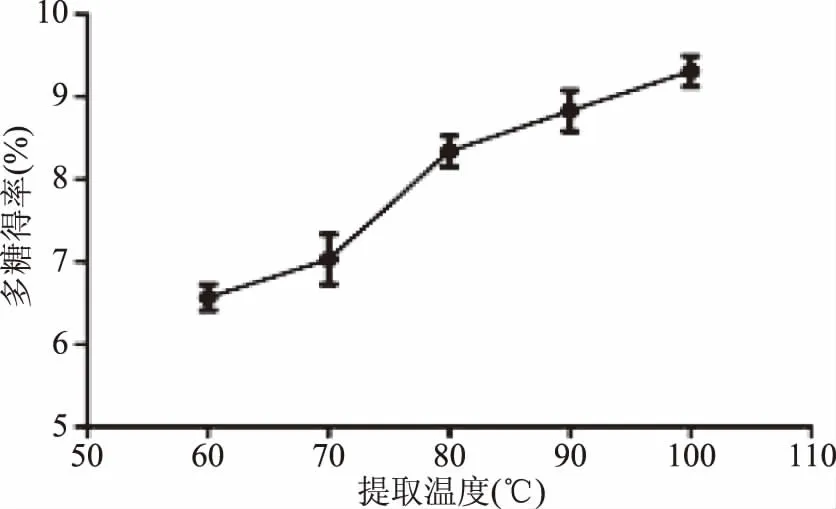
图1 提取温度对多糖得率的影响
2.1.2 提取时间对细辛多糖得率的影响 提取时间对多糖得率有明显影响。如图2,当提取时间从1 h增加到2 h时多糖得率呈升高趋势,提取时间为2 h时,细辛多糖得率达到最大值9.61%,随着提取时间的进一步增加,多糖得率明显降低。这种现象与其它报道一致[35],一定时间范围内,多糖得率随着提取时间的加长而增加,然而,提取时间过长时,多糖得率呈下降趋势,分析可能是多糖结构发生水解导致得率降低,将响应面试验中时间变量设定为1.5~2.5 h。
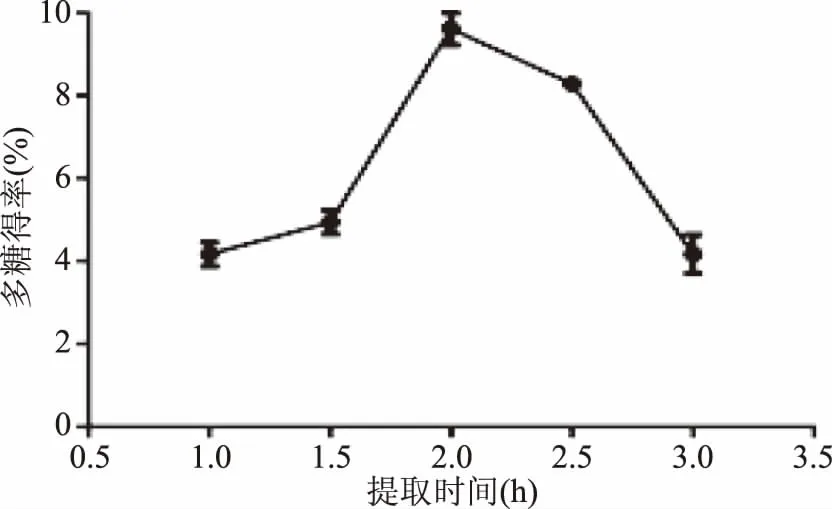
图2 提取时间对多糖得率的影响
2.1.3 液料比对细辛多糖得率的影响 不同溶剂与原料的比例(液料比)对多糖得率有明显影响。如图3,液料比10∶1 mL/g增加到30∶1 mL/g时,得率由5.48%升高到最大值9.33%,随着液料比的进一步增加,多糖得率明显降低。这是由于一定范围内,液料比的增加有利于多糖浸出扩散到溶剂中,而液料比过高时,溶剂的增加会影响浸提体系的传热和传质,不利于多糖的提取[36]。将响应面试验中液料比变量设定为20∶1~40∶1 mL/g。
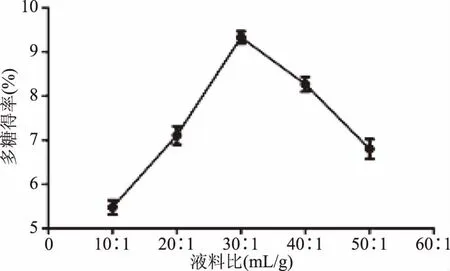
图3 液料比对多糖得率的影响
2.2 BBD-RSM优化细辛多糖提取工艺
细辛多糖提取工艺的响应面试验设计及结果如表2,ANOVA方差分析结果见表3。

表2 响应面优化试验设计及结果

表3 回归模型显著性检验及方差分析
数据经回归拟合后,得到回归方程为:Y多糖得率(%)=8.58+0.58A+0.90B+0.45C-1.21AB-0.27AC+1.19BC+0.41A2-2.29B2。
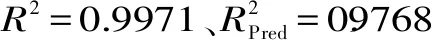
选择范围内,提取温度、提取时间、料液比对多糖得率均有显著性影响(p<0.05)。各因素的F值大小依次为F(B)>F(A)>F(C),提取时间(B)对细辛多糖得率影响最大。各因素间交互作用对多糖得率亦有显著性影响(p<0.05),其交互作用的等高线图4和响应曲面图5,证实了ANOVA方差分析结果。
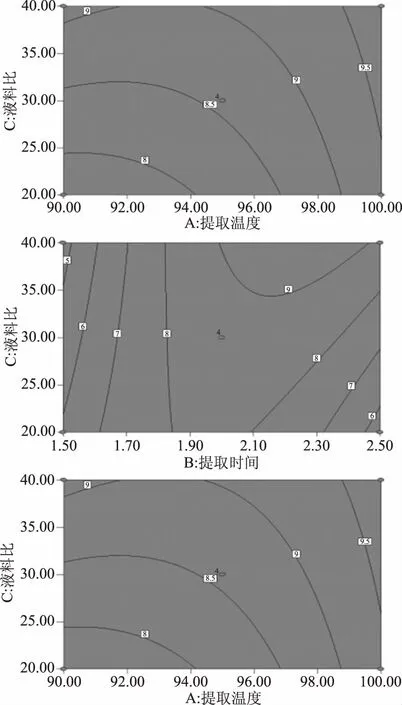
图4 2D等高线图

图5 三维响应曲面图
本文通过绘制残差与预测响应的关系,通过构建独立变量(p<0.0001)的正态概率图研究正态假设。如图6所示,残差正态概率分布图接近一条直线,模型预测值与实际值近乎一条直线,模型预测值与残差差异大,因此,本文得出的多项式模型是有效的,并且存在理想的最佳点。优化试验得到的细辛多糖最佳提取条件为提取温度90 ℃,提取时间2.37 h,液料比40∶1 mL/g,在此条件下,模型预测最大多糖得率为10.32%。为了进一步验证该模型的可靠性,根据模型最佳提取条件进行3次平行验证实验,细辛多糖得率实际值为10.20%±0.22%,与理论预测值10.32%相近,相对误差(1.18%)小于5%。因此,该模型能准确反映细辛多糖提取过程中各因素的交互作用,可用于优化细辛多糖的提取工艺。

图6 残差正态概率图,预测值与实际值和残差与预测值的比较
2.3 ASP-1的分级纯化及活性筛选
如图7A,细辛多糖经DEAE-纤维素阴离子交换柱分离得到两个多糖组分,分别为中性多糖ASP-1和酸性多糖ASP-2,使用Sepharose CL-6B柱层析进一步纯化,得到分子量均一的多糖组分,透析并冻干,仍命名为ASP-1和ASP-2。DPPH自由基清除实验用于评价两种多糖组分的抗氧化能力,结果如图8,组分ASP-1抗氧化活性较强,ASP-1用于后续实验的活性检测。ASP-1理化性质分析见表4。ASP-1的总糖含量为96.9%,葡萄糖含量为58.35%,蛋白质含量为0.11%,糖含量较高。

图7 DEAE-纤维素(A)和琼脂糖CL-6B(B,C)对细辛多糖进行分级纯化

图8 ASP-1和ASP-2对DPPH自由基的清除能力

表4 ASP-1的理化性质
2.4 ASP-1对A10细胞衰老的保护作用
细胞衰老是指细胞生理功能的衰减,包括增殖能力下降,活力减弱。采用MTT法测定不同浓度ASP-1的细胞衰老保护功能,结果表明,ASP-1预处理对Eto诱导的A10细胞损伤具有保护作用,在25~200 μg/mL浓度范围内,ASP-1对Eto诱导的A10细胞损伤有剂量依赖性保护作用,表现强的增殖活性,在浓度为200 μg/mL时,保护作用最强,400 μg/mL时保护作用下降(图9),此现象是由于细辛多糖剂量过大产生毒性。

图9 ASP-1对Eto诱导的A10细胞损伤的作用
衰老细胞形态结构上伴有体积增大,并且SA-β-gal表达水平增加,SA-β-gal是首个用于特异识别衰老细胞的分子标记物[37]。通过观察细胞形态变化以及SA-β-gal染色评价ASP-1对Eto诱导细胞衰老的保护作用,如图10所示,对照组细胞(Con)形状小呈规则纺锤形,边缘清晰。相反,Eto处理后,细胞形态增大变扁平,细胞数量明显减少,符合衰老细胞的特征,相对于Eto模型组,200 μg/mL ASP-1处理组(ASP-1+Eto)细胞变小,衰老状态减轻。衰老细胞数量的减少表明细胞衰老状态的减轻,如图11所示,蓝染的细胞表示衰老细胞,对照组细胞(Con)无衰老阳性细胞,Eto模型组蓝染细胞较多,表达高的SA-β-gal活性水平,200 μg/mLASP-1处理组(ASP-1+Eto)SA-β-gal蓝染细胞明显减少,表达低的SA-β-gal活性水平。SA-β-gal可能来源于溶酶体β-半乳糖苷酶,细胞发生衰老时溶酶体破裂在释放水解酶的同时释放SA-β-gal[38],Eto诱导细胞损伤使溶酶体生物合成增加,细辛多糖通过抑制溶酶体的生物合成起到衰老保护作用。

图10 不同处理组细胞形态学观察

图11 ASP-1对Eto处理的A10细胞中SA-β-gal活性的影响
3 结论
本文通过响应面法优化细辛多糖提取工艺,提取温度、提取时间和液料比三个因素及其交互作用对细辛多糖得率均有不同程度的影响,模型预测得到细辛多糖最佳提取条件为:提取温度90 ℃,提取时间2.37 h,液料比40∶1 mL/g,多糖得率为10.20%。
血管平滑肌细胞的衰老与动脉粥样硬化等血管疾病密切相关[39-40]。衰老细胞一方面表现为细胞增殖阻滞,MTT实验证明Eto诱导A10细胞发生增殖阻滞,ASP-1处理组细胞显示强的增殖活性,具有剂量依赖性保护作用;另一方面,衰老细胞的基因和蛋白表达谱发生改变[41]。衰老细胞通常体积变大,衰老β-半乳糖苷酶活性水平上调,通过形态学观察及SA-β-gal染色结果表明:ASP-1可明显抑制Eto诱导的A10细胞衰老形态变化,降低Eto诱导的SA-β-gal活性水平增加。综上:ASP-1预处理对Eto诱导的大鼠主动脉平滑肌细胞衰老具有保护作用,A10细胞衰老程度的降低有利于其保持正常的细胞功能和维持血管稳态,进而减轻血管疾病的发生发展。
Eto通过DNA损伤效应诱导细胞衰老,DNA损伤累积可能会导致端粒功能障碍,有文献证明端粒重复序列结合因子2(TRF2)是血管平滑肌细胞衰老的主要调节因子[42]。因此,接着将从TRF2及衰老信号通路p53-p21、p16-pRb方向探讨ASP-1发挥衰老保护作用的机制,并解析ASP-1的结构。深入研究细辛多糖对血管细胞衰老的作用机制,发掘中药细辛对血管衰老的确切防治作用,将有利于细辛资源的综合利用。

