曲酸-海藻酸钠复合膜的制备及其对百合鳞茎片褐变的抑制作用
范文广,杜娜娜,牛晓倩,任海伟,连小峰,彭 程,王永刚,曹莹莹
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
百合(Liliumbrowniivar.viridulum Baker)是一种可用于饮食或做药材使用的百合科百合属(Lilium)球根类植物,多种营养成分和活性物质,如维生素、多糖和生物碱等,具有补脾健胃、润肺清火安神等功效[1]。百合脂肪含量低,可在食品行业中作为开发低脂原材料,加以利用,是我国卫生部审批通过的首批药食兼用资源,具有很高的市场价值。鲜切百合鳞茎片新鲜、便利,越来越受到国内外消费者的喜欢,但鲜切改变百合鳞茎片的组织代谢,影响其生理生化变化,如乙烯生成增加和营养流失,因此鲜切后需经一定的处理。百合鳞茎片中含有大量的酚类化合物和多种酶(多酚氧化酶、过氧化物酶、苯丙氨酸解氨酶),鲜切或轻微加工处理打破酚类和酶的区域化,容易引起百合鳞茎片的褐变,同时也会增加细菌和真菌病害,导致商品价值下降[2],所以抑制百合鳞茎片褐变,延长贮藏期显得尤为重要。
果蔬常见的保鲜方法有物理保鲜、化学保鲜、生物保鲜,其中物理方法包括冷藏、热处理、气调、电子辐射、脉冲、紫外以及低温等离子体,并且有些方法已经被广泛应用于百合鳞茎片的贮藏和保鲜[3-4]。虽然物理保鲜技术应用较广,但其设备复杂、投资要求较高,基于此,许多化学方法也应用于百合鳞茎片的贮藏和保鲜[5-6]。虽然化学方法在一定程度上能够减轻百合鳞茎片在贮藏和加工过程中的褐变和质量损失,但是化学物质的残留以及对环境的污染是不容忽视的。在这种情况下,寻求可以替代化学防腐剂的抑菌谱广、安全性高的天然抗菌剂成为一个重要的研究目标。
天然抗菌剂按照来源的不同可分为三类:植物源抗菌剂、动物源抗菌剂及微生物源抗菌剂[7]。其中,微生物防腐剂是用发酵等技术处理自然界中的农产品获得,对人体没有毒害,应用范围广,并且十分稳定,渐渐成为食品防腐保鲜研究的热点之一。已从微生物中得到的天然防腐剂有细菌素类的乳酸菌素和小菌素、放线菌类的纳他霉素、霉菌类的米曲霉发酵产生的曲酸以及某些酵母菌、真菌、食用菌和聚赖氨酸等。其中由米曲霉发酵生产的曲酸,已经广泛应用于食品的保鲜,曲酸具有很好的抑制果蔬褐变和抑菌效果,比如应用在防止苹果汁褐变,鲜切马铃薯、山药、莲藕及荔枝的保鲜[8-11],目前为止还没有发现曲酸应用于百合鳞茎片的保鲜。曲酸难附着在百合鳞茎片的表面,基于此,利用海藻酸钠良好的成膜性,将二者结合起来,制备形成曲酸-海藻酸钠复合膜。本研究以百合鳞茎片为试材,采用正交试验筛选曲酸-海藻酸钠(kojic acid/sodium alginate)复合膜配方,并将其应用于百合鳞茎片保鲜,寻找一种抑制百合鳞茎片在贮藏和加工中褐变的方法,以期为百合贮藏保鲜提供参考。
1 材料与方法
1.1 材料与仪器
兰州百合(Liliumdavidiivar.unicolor) 采挖自兰州市七里河区西果园乡,挑选形状基本一致,无病虫害和明显机械损伤的新鲜百合鳞茎,将百合鳞茎片分为外、中、内三部分,外层即从外向内数1~3层,内层即由内向外数1~3层,其余为中层,本次试验采用中层百合鳞茎片;PVC复合保鲜袋 长×宽=250×210 mm,厚度为0.03 mm;曲酸 阿拉丁试剂有限公司;海藻酸钠 上海麦克林生化科技有限公司;甘油 天津市光复科技发展有限公司。
LF-600R冷冻离心机 上海江东仪器有限公司;UV2600-A型紫外可见分光光度计 北京瑞利分析仪器有限公司;恒温水浴锅 国华电器有限公司;Model CR-300色差计 日本Minolta;Mulitest 2.5-i质构仪 美国Mecmesin Co.,。
1.2 实验方法
1.2.1 曲酸-海藻酸钠复合膜的制备及处理
1.2.1.1 单因素实验 选取海藻酸钠、曲酸、甘油3种单一试剂分别对百合鳞茎片进行实验,其使用浓度见表1。将百合鳞茎片置于不同浓度溶液中浸泡2 min,室温放置,捞出,自然沥干,用蒸馏水浸泡百合鳞茎片作为对照,用聚氯乙烯(PVC)保鲜袋包装后放置在4 ℃、相对湿度(90%)下贮藏15 d,每组处理30片,用颜色综合指数E来评价。
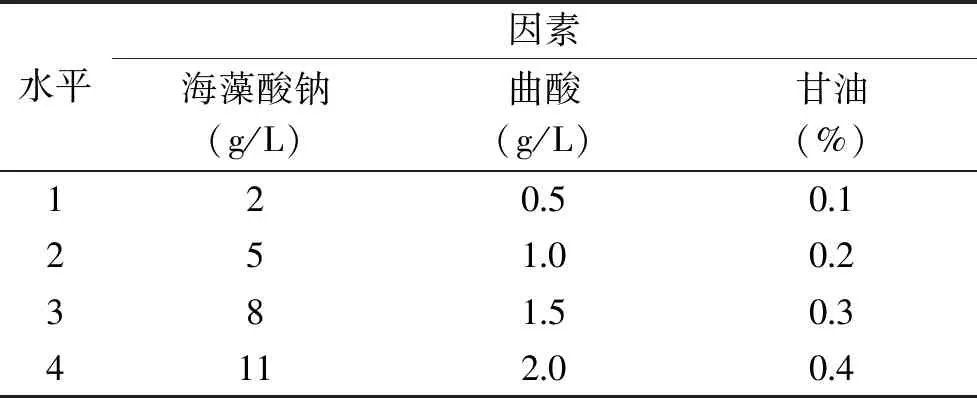
表1 3种保鲜剂及用量
1.2.1.2 复合膜组合筛选 在单因素实验结果基础上,进行3因素3水平L9(34)正交试验,百合鳞茎片涂膜处理后用保鲜袋包装,置于4 ℃冷库贮藏15 d,相对湿度为90%~95%,所有处理均重复3次。用百合鳞茎片表面颜色综合指数E去评价保鲜效果。

表2 正交因素水平表
1.2.1.3 复合膜制备 根据正交试验结果,制备复合膜(见2.2)。制作过程如下:海藻酸钠加水溶解成溶胶状,将曲酸、甘油依次加入到之前混合均匀的海藻酸钠溶液中,将其搅拌均匀后加水补足至相应体积,备用。将搅拌均匀的涂膜复合液进行20 min的超声处理[12]。
1.2.1.4 百合鳞茎处理 实验分为两组,即对照组CK(百合鳞茎片浸泡在蒸馏水浸泡2 min)和处理组B(百合鳞茎片浸泡在最佳曲酸-海藻酸钠复合膜溶液中2 min),处理完成后放于黑布上自然晾干,然后装入聚氯乙烯(PVC)保鲜袋中,在冷库中贮藏(冷库温度为4 ℃,相对湿度为90%~95%),每3 d取一次样,每次取3袋。测定样品相关指标。
1.2.2 指标测定
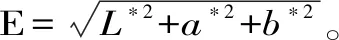
1.2.2.2 硬度测定 使用质构仪测定,探头为TA70,力量感应元500 N,形变量30%,检测速度60 mm/min,探头压缩样品的距离为5 mm,起始力0.5 N,放置样品时间5 s。
1.2.2.3 PPO和POD活性的测定 PPO活性的测定参照Meng等[13]方法并修改。2.0 g样品与10 mL磷酸盐缓冲液(预冷、浓度为0.1 mol/L、pH为6.4、含5%聚乙烯吡咯烷酮(PVPP))混合并充分研磨成浆。将匀浆在4 ℃条件下,15000×g离心30 min,上清液即为粗酶液。PPO反应体系为0.2 mL上清液和3 mL磷酸缓冲液(浓度为0.1 mol/L、pH为6.4、含有0.5 mol/L邻苯二酚)。在398 nm下测量吸光度值,记录第一个25 s的反应。每分钟吸光度变化0.01的酶的量为一个酶活性单位,表示为U·g-1。
POD活性的测定参照Wang等[14]方法进行。将2.0 g样品与10 mL磷酸盐缓冲液(浓度为0.05 mol/L、pH为7.8)放入研钵中研磨。离心条件设置为4 ℃,15000×g离心30 min,匀浆离心后备用。反应体系中含有0.1 mL上清液和2 mL 0.05 mol/L含有0.04 mol/L愈创木酚的磷酸缓冲液(pH7.8)。在加入0.1 mL H2O2(0.02 mol/L)后,在398 nm下测量吸光度值测定该体系的吸光度,记录第一个30 s反应。每分钟吸光度变化0.01的酶的量为一个酶活性单位,表示为U·g-1。
1.2.2.4 PAL活性测定 PAL活性的测定根据Luo等[15]方法并修改。取1.0 g样品置于研钵中,用10 mL硼酸盐缓冲液(浓度为0.01 mol/L,pH为8.8,含有5%聚乙烯吡咯烷酮)充分研磨。匀浆后通过纱布过滤,滤液在4 ℃条件下,14000×g离心15 min,收集上清液用于测定PAL活性。反应体系为:向试管中加入1 mL L-苯丙氨酸(0.02 mol/L),再加入4 mL硼酸盐缓冲液(浓度为0.01 mol/L、pH为8.8),1 mL酶提取液和1 mL蒸馏水,混合均匀后,设置水浴锅温度为30 ℃,保温60 min。保温完成后,通过紫外可见分光光度计测定其在290 nm下的吸光度值。每分钟吸光度变化0.01的酶的量为一个酶活性单位,表示为U·g-1。
1.2.2.5 总酚和醌类含量的测定 总酚和醌类含量的测定参考刘程慧等[16]方法并修改。取样品3 g,加入20 mL甲醇,打浆匀质后,纱布过滤,滤液经15000×g,低温离心15min。取上清液,倒入比色皿中,设置波长为320、437 nm,测定吸光值,分别表示总酚(OD320·g-1)和醌类(OD437·g-1)的含量。
1.2.2.6 丙二醛含量的测定 丙二醛含量的测定参考姜爱丽等[17]方法并修改。称取0.5 g百合,先加入1 mL三氯乙酸溶液(10%)研磨,研磨后再加入4 mL三氯乙酸溶液(10%)充分研磨,离心机转速设置为4000 r/min,离心10 min。取2 mL上清液,加入2 mL硫代硫酸钠溶液(0.67%),将装有混合溶液的玻璃容器放入沸水中,处理15 min。迅速使其冷却后,在4000 r/min条件下离心10 min,在450、532、600 nm下取上清液分别测定其吸光值。MDA含量用μmol·g-1来表示。
1.2.2.7 微生物的测定 微生物的测定参考高翔等[18]方法并修改。微生物用可培养的菌落总数来评价。25 g百合鳞茎片分别切成小块用225 mL氯化钠缓冲溶液(0.85%)稀释。匀浆2 min后,连续进行稀释,稀释梯度分别为10-1~10-9。每个梯度处理都被倒在平板上进行培养,在37 ℃培养48 h后,选取菌落数在50~100之间的平板作为测定标准,结果用lg CFU·g-1来表示。
1.3 数据处理
每个指标每次重复测定3次,取其平均值。采用SPSS 20.0对数据进行分析。采用Prism 6.0进行绘图。均值间比较采用Duncan’s多重比较,数据表示为Mean±SD。在0.05水平上进行显著性检,*表示p<0.05。
2 结果与分析
2.1 单因素结果
由表3可以看出,保鲜剂处理组的颜色综合指数E*优于蒸馏水对照处理,海藻酸钠处理组效果最好。海藻酸钠浓度较高时,更利于保持百合鳞茎片的颜色,曲酸浓度对百合鳞茎片的颜色影响不大,甘油随着浓度的增大,E增大,而甘油浓度达到0.4%时,E降低。综合考虑选择海藻酸钠5、8、11 g/L,曲酸0.5、1.0、1.5 g/L,甘油0.1%、0.2%、0.3%进行正交试验,研究复合膜保鲜效果。
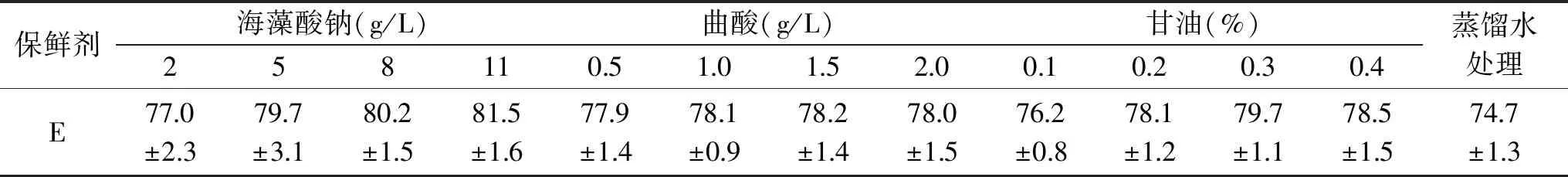
表3 单一试剂对百合鳞茎片表面颜色综合指数的影响
2.2 正交试验结果
如表4所示,百合鳞茎片在4 ℃条件下贮藏15 d后,由R值可知,影响E*值的因素主次顺序为A>C>B,最佳的组合为A2B2C3,是T5处理组,E值为83.95,海藻酸钠、曲酸及甘油的浓度分别为8 g/L、1.0 g/L及0.3%为最佳复合膜配方。
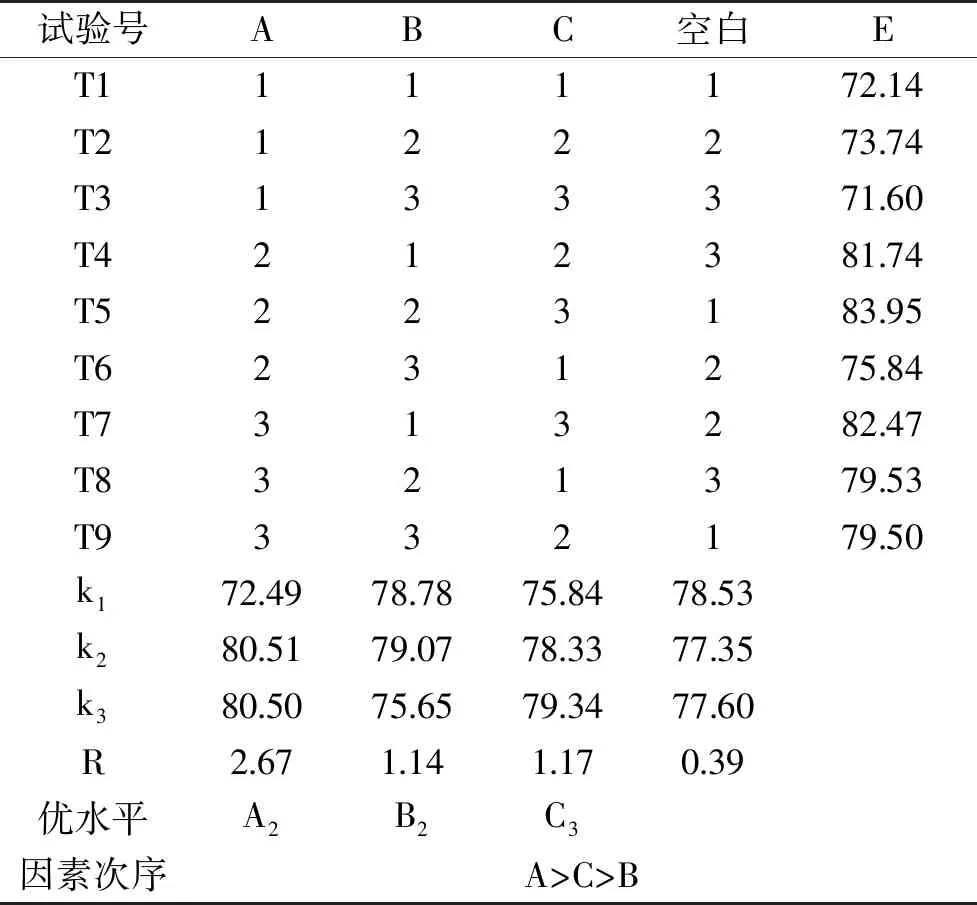
表4 正交试验设计及结果
2.3 复合膜保鲜效果的方差分析
如表5所示,海藻酸钠对E*值有显著影响(p<0.05),而曲酸、甘油对E*值无显著影响(p>0.05)。综上,海藻酸钠对百合鳞茎片的贮藏具有一定的保鲜效果,海藻酸钠浓度升高可以在一定程度上提升E*值。
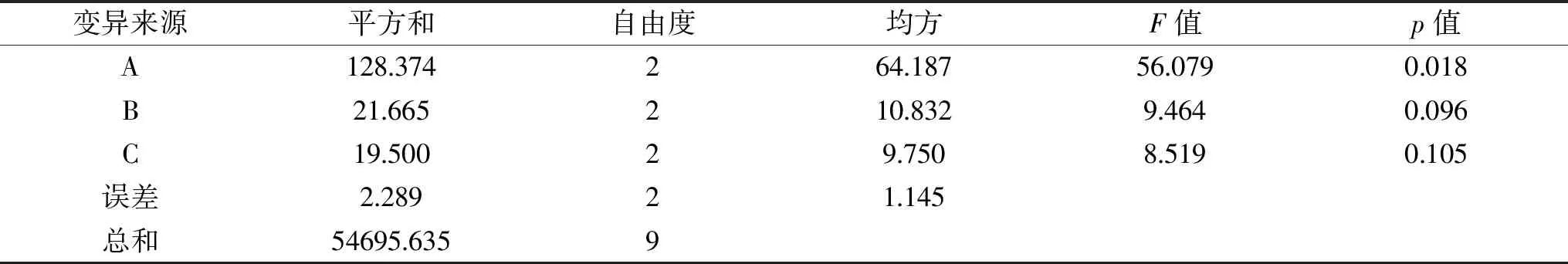
表5 方差分析表
2.4 硬度的变化
从图1可以看出,贮藏过程中对照组与处理组百合鳞茎片的硬度都呈下降趋势,而曲酸-海藻酸钠涂膜液处理组百合鳞茎片的硬度在贮藏第6~15 d显著(p<0.05)高于对照组。在贮藏期结束时(15 d),处理组百合鳞茎片的硬度高于对照组硬度约16.5%。说明曲酸-海藻酸钠复合液涂膜处理可以延缓硬度下降,较好地维持百合鳞茎片硬度。
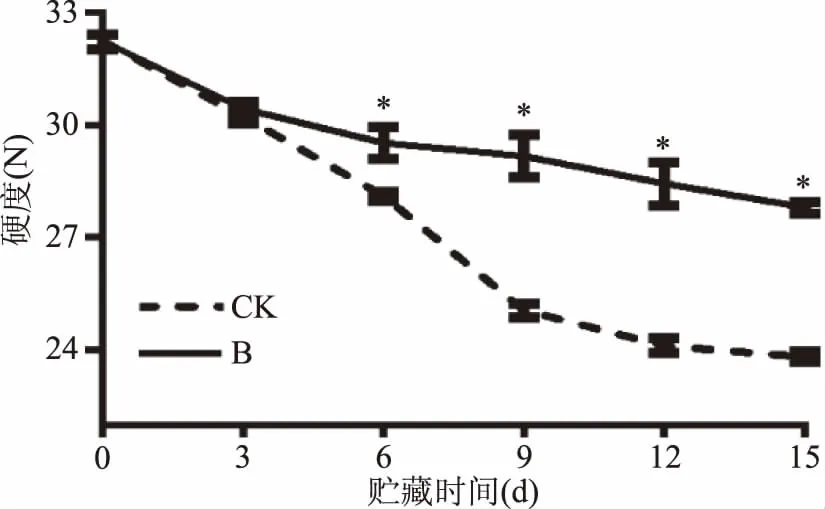
图1 百合鳞茎片贮藏过程中硬度变化
2.5 百合鳞茎片表面颜色变化
由图2可知,L*值变化整体呈下降趋势,第6 d对照组的L*值开始明显下降,而处理组下降缓慢,变化不大;a*值变化整体呈上升趋势,对照组a*值在第3 d上升趋势已经显著高于处理组(p<0.05),而处理组a*值增加不大。对照组b*值整体呈上升趋势,处理组b*值呈下降趋势;E*值整体呈现出下降趋势,与L*值变化趋势相似,第6 d对照组E*值明显下降,而处理组下降缓慢。由图2可以看出,随贮藏时间的延长,百合鳞茎片色泽变暗、颜色加深,但处理组百合鳞茎片相较于对照组百合鳞茎片而言,变化程度较小。曲酸-海藻酸钠涂膜处理可以延缓百合鳞茎片褐变反应,保持百合鳞茎片色泽。
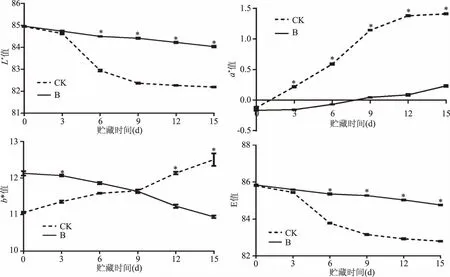
图2 曲酸-海藻酸钠涂膜对百合鳞茎片贮藏过程中L*值、a*值、b*值、E值影响
图3所示,第15 d时,对照组百合鳞茎片表面出现褐变、红变,而处理组百合鳞茎片表面几乎未出现褐变,表面颜色大部分保留了亮白色。曲酸-海藻酸钠复合液涂膜处理很好地抑制了百合鳞茎片褐变。
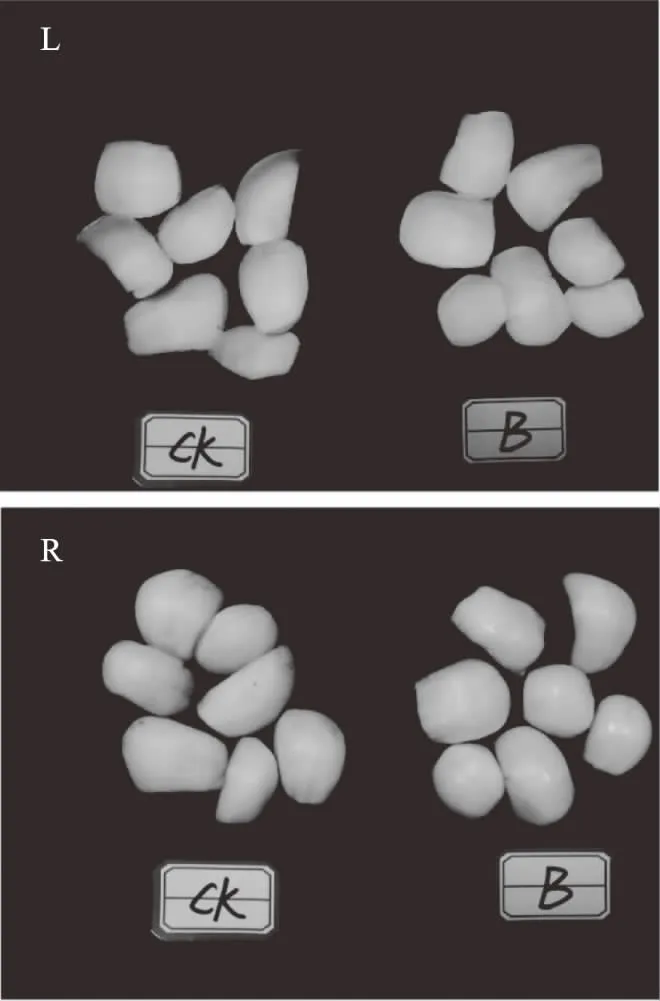
图3 曲酸-海藻酸钠涂膜处理百合鳞茎片15 d时表面颜色
2.6 PPO、POD和PAL活性变化
两组PPO活性在贮藏期间均有所提高,呈上升趋势(图4),这与鲜切茭白和洋蓟贮藏过程中PPO活性变化一致[19-20],处理组百合鳞茎片的PPO活性一直低于对照组。在贮藏期结束时(15 d),处理组百合鳞茎片的PPO活性低于对照组大约23.5%。两组POD活性趋势呈先上升后下降的倒“V”字型趋势(图4),对照组PPO活性在第9 d达到最高峰,然后下降,而处理组PPO活性在12 d达到最高峰,表明曲酸-海藻酸钠涂膜处理延迟了POD活性高峰出现时间。有许多相关研究POD活性变化出现先上升后下降趋势,例如鲜切苹果和蘑菇[21-22],但是POD活性高峰出现的时间有所不同,可能是因为实验材料和处理方法不同引起。在贮藏时间内,处理组百合鳞茎片POD活性始终低于对照组。在贮藏期结束时(15 d),处理组POD活性比对照组低约17%。PAL活性整体呈先上升后下降的趋势,在第9 d时PAL活性迅速增加,在第12 d到达顶峰后,然后下降,在鲜切富士苹果[23]和胡萝卜[24]研究中,PAL活性变化也呈现相同趋势。曲酸-海藻酸钠复合液涂膜处理百合鳞茎片PAL活性始终低于对照组。在贮藏期结束时(15 d),对照组百合鳞茎片PAL活性高于对照组23.6%。
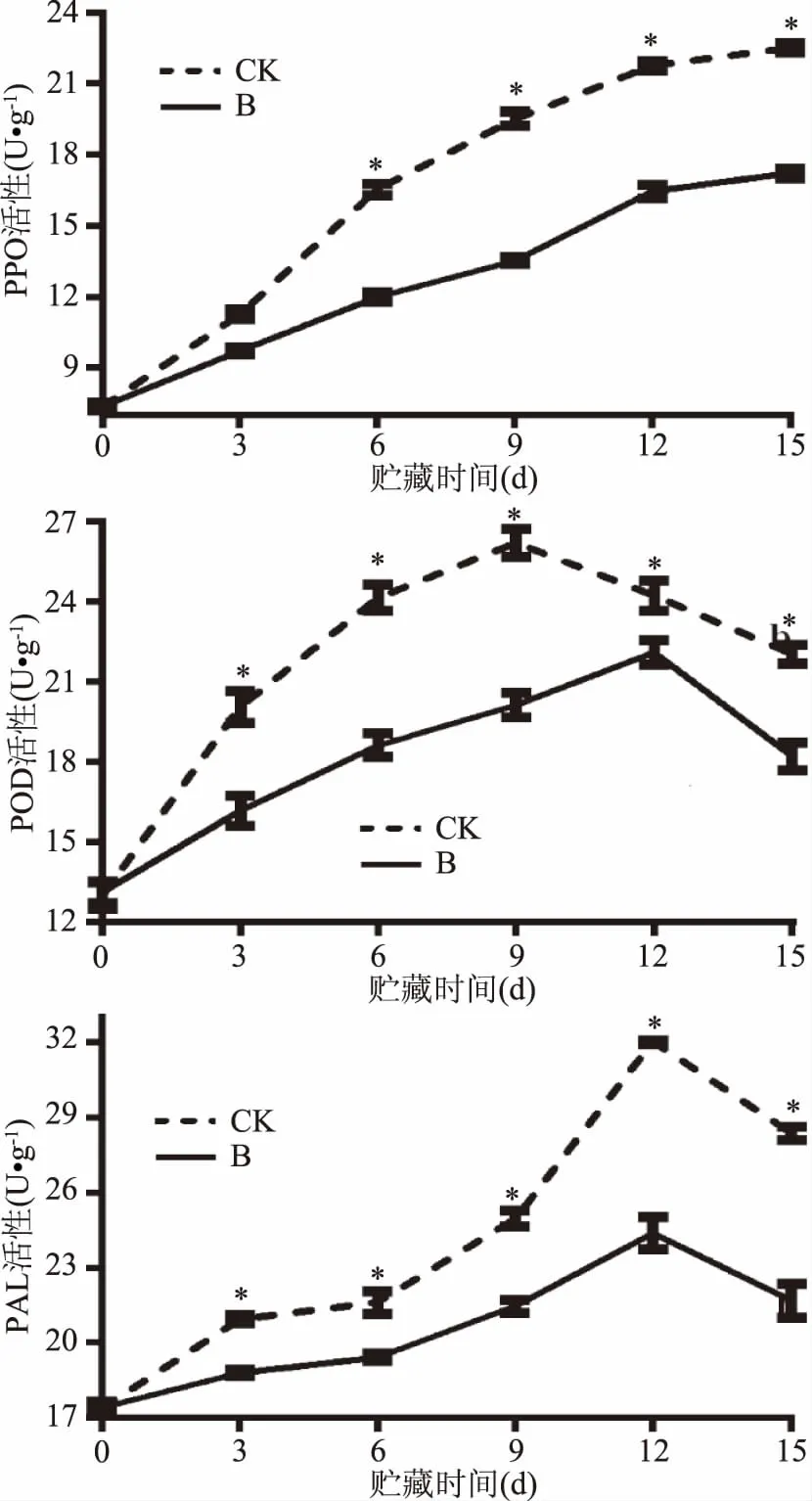
图4 曲酸-海藻酸钠涂膜对百合鳞茎片贮藏过程中PPO、POD和PAL活性变化影响
2.7 酚类和醌类含量变化
在贮藏过程中,两处理组百合鳞茎片总酚含量呈上升趋势,曲酸-海藻酸钠复合液处理抑制酚类化合物的积累,处理组总酚含量始终在对照组之下。贮藏期间,醌类含量呈整体上升趋势,在第9 d时,对照组醌类含量迅速上升,处理组醌类上升速率较对照组小(p<0.05)。
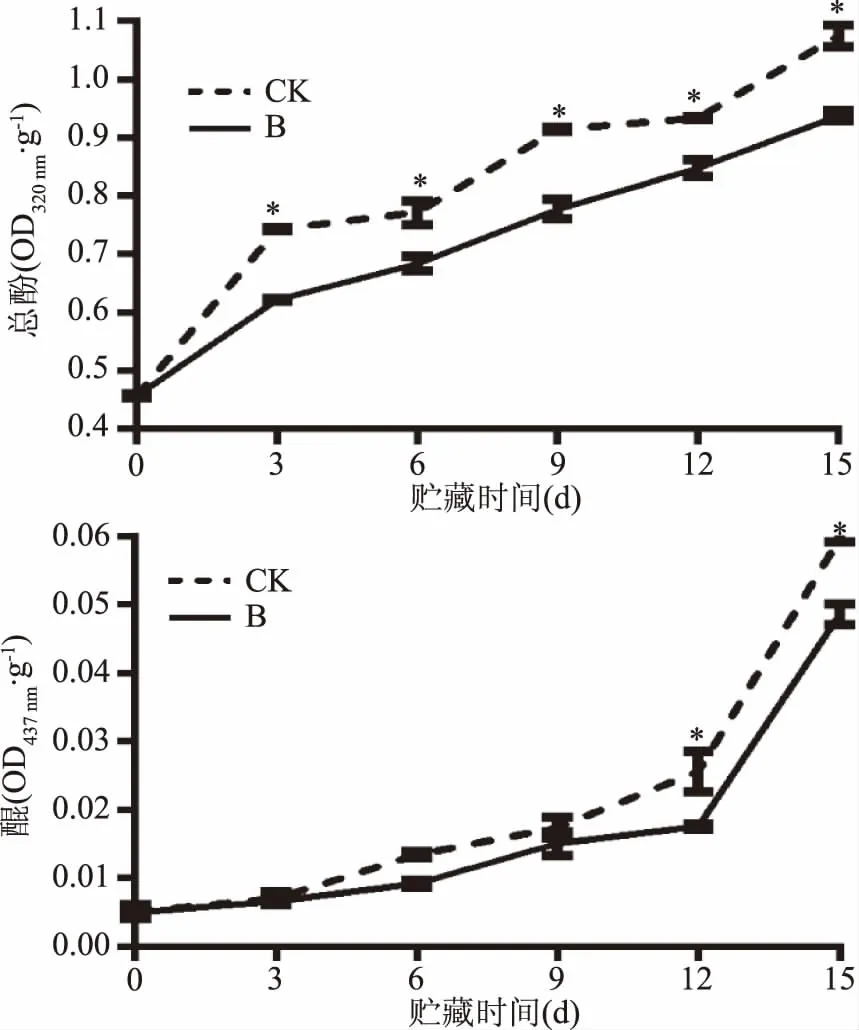
图5 曲酸-海藻酸钠涂膜对百合鳞茎片贮藏过程中总酚、醌类含量变化的影响
2.8 MDA含量的变化
对照组与处理组的MDA含量随着贮藏时间延长而增加(图6)。在贮藏期内(0~15 d),对照组百合鳞茎片MDA含量增加了163.3%。曲酸-海藻酸钠涂膜处理抑制并延迟了MDA的积累,处理组百合鳞茎片MDA含量在第15 d时比对照组低22.7%。
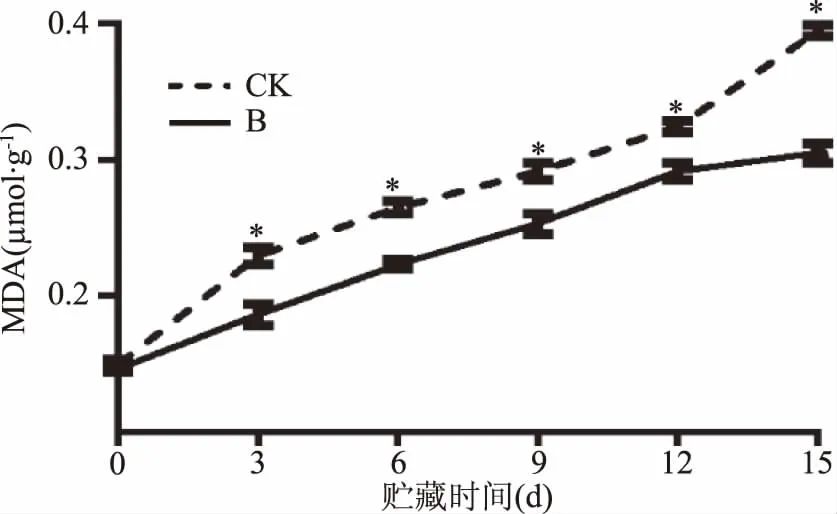
图6 曲酸-海藻酸钠涂膜对百合鳞茎片贮藏过程中丙二醛含量变化影响
2.9 微生物分析
两组百合鳞茎片表面可培养微生物数量在贮藏过程中呈连续上升趋势(图7)。机械伤可能会引起微生物的生长,对照组和处理组百合鳞茎片微生物数量从最初的3.22lg CFU·g-1到分别到贮藏结束时7.36lg和5.43lg CFU·g-1。处理组菌落总数一直低于对照组,从第6 d开始,处理组微生物数量远低于对照组(p<0.05)。结果表明曲酸-海藻酸钠涂膜处理能有效抑制微生物生长。
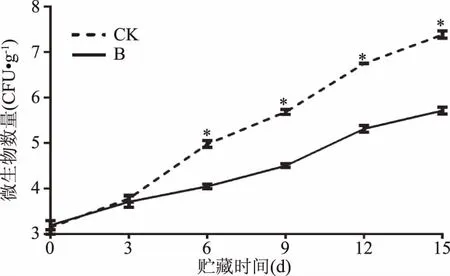
图7 曲酸-海藻酸钠涂膜对百合鳞茎片贮藏过程中可培养微生物变化影响
3 讨论
百合鳞茎片表面褐变是限制其品质和保质期的主要原因。本研究结果表明,曲酸-海藻酸钠复合液涂膜处理对维持百合鳞茎片表面颜色有明显效果,这些结果与巩慧玲等利用纳他霉素壳聚糖复合涂膜对兰州百合鳞茎片保鲜效果相似[25],均能抑制百合鳞茎片的褐变。
机械伤(切割、鲜切、预处理)导致果蔬PPO和POD活性普遍升高,进一步引起褐变[26]。在此次研究中,涂膜处理组PPO和POD活性均低于对照组,因为曲酸-海藻酸钠复合膜具有一定的气体选择性,在百合鳞茎片表面形成一个低氧环境[27],维持环境较低pH,同时复合膜中的曲酸与酚类底物具有相似结构,降低PPO和POD与酚类物质发生反应程度,防止生成黑色素,减缓百合鳞茎片褐变[28]。切割会导致 PAL 活性增加,进而使酶促褐变底物酚类物质的合成累积,加速褐变[29]。加工处理会激活果蔬苯丙烷代谢,进而导致 PAL活性增加,随之会产生较多木质素等次生物质来减少果蔬自身受到的伤害,合成物质增多后,这些物质又会反过来抑制 PAL 活性,减少营养物质消耗[30]。
此次研究中,百合鳞茎片总酚含量呈上升趋势,处理组百合鳞茎片总酚含量始终低于对照组。酚类化合物合成与PAL酶有关,涂膜处理抑制了PAL酶活性,减缓了总酚含量的上升。涂膜处理的百合鳞茎片醌类含量在第9 d后明显低于对照组,涂膜能减缓醌类物质的生成,抑制其进一步聚合生成黑色素,减轻百合鳞茎片褐变程度。两组百合鳞茎片MDA含量呈增长趋势,是因为鲜切或轻微加工百合鳞茎片引起细胞结构破坏,造成膜脂过氧化反应,导致MDA含量上升[31],而处理组的MDA含量明显低于对照组,是因为曲酸-海藻酸钠复合液涂膜处理将保持细胞结构的完整性,有助于减轻脂质过氧化反应[32-33],延缓百合鳞茎片的褐变。涂膜处理能够抑制微生物正常生长[34-35],这与曲酸-壳聚糖作为抑制剂抑菌效果一致,同时涂膜处理使得百合鳞茎片与外界环境细菌、真菌得以隔离,减少了微生物对百合鳞茎片的污染[36],有效防止了百合鳞茎片腐败变质。
4 结论
本研究探讨了曲酸-海藻酸钠复合液涂膜处理对百合鳞茎片褐变抑制和品质保持效果,研究表明,曲酸-海藻酸钠复合膜最佳配方为:海藻酸钠、甘油及曲酸浓度分别为8 g/L、0.3%和1.0 g/L。最佳的复合液涂膜处理可以有效抑制百合鳞茎片褐变,能显著(p<0.05)保持色度、硬度,抑制丙二醛含量的升高,减缓PAL、PPO、POD、总酚和醌类的升高,从而保持了百合鳞茎片片贮藏期间的品质。因此,曲酸-海藻酸钠复合液涂膜可能是保存百合鳞茎片安全有效的方法之一。
权威·核心·领先·实用·全面

