甘草提取物的功效及其作用机制研究
陈健敏
(莆田学院药学与医学技术学院,药物分析与检验医学福建省高校重点实验室,福建 莆田 351100)
黄玮玥,叶雅玲, 黄子尧
(莆田学院药学与医学技术学院,福建 莆田 351100)
阮志鹏
(莆田学院药学与医学技术学院,药物分析与检验医学福建省高校重点实验室,福建 莆田 351100)
甘草是我国最常用的十大宗药材之一,始载于《神农本草经》,甘草又称国老、灵通、甜草根等,属多年生草本植物,是豆科蝶形花亚科。据文献报道,全球范围内甘草属的多年生草本植物共29种,而我国范围内该属植物共有18种[1],具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效[2]。甘草提取物具有抗肿瘤、抗病毒、抗炎、抗免疫、抗溃疡及保肝作用[3],其中主要的化学成分为甘草酸、甘草次酸、甘草素等,所具有的功效各有不同[4],广泛应用于医药、食品[5]、化妆品等各个领域。近年来,研究发现甘草提取物具有抗氧化[6]及酪氨酸酶活性抑制作用[7~9]。然而,甘草提取物作为一种混合物,不同产地、不同品种的提取物中的成分含量差异较大[10],单纯研究甘草提取物的酪氨酸酶活性抑制及抗氧化作用,可能出现作用效果不一致的情况,不利于对甘草资源的开发利用。如能探明甘草提取物的功效与主要成分的对应关系,探清其功效的作用机制,阐明主要成分的构效关系,再将这些主要成分分离提纯,将大大提高甘草提取物的药用价值,有利于开发我国丰富的甘草资源。为此,笔者以甘草提取物中的主要成分槲皮素、光甘草定、异甘草素、刺芒柄花素、甘草酸和甘草次酸为研究对象,为了相互验证这些成分的抗氧化能力大小,采用ABTS自由基清除法、DPPH自由基清除法以及FRAP(铁离子还原能力)法等3种方法测定这6种成分的抗氧化能力,探究甘草提取物中表现出抗氧化作用和酪氨酸酶活性抑制作用的主要成分,探清其功效的内在作用机制,并尝试阐明其中的构效关系。
1 材料与设备
1.1 材料
酪氨酸酶(比活力为2500 U/mL,Worthington)。L-多巴、L-酪氨酸、碳酸氢二钠自由基十二水(分析纯,99%)、碳酸二氢钠·二水(分析纯)、乙醇(ACS,≥99.5%)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、2,4,6-三吡啶基三嗪(TPTZ)和奎诺二甲基丙烯酸酯(Trolox)均购自上海晶纯生化科技股份有限公司。光甘草定(98%以上)、甘草酸(93%)、甘草次酸(98%以上)、异甘草素(98%以上)、刺芒柄花素(98%以上)和槲皮素(97%)购于合肥博美生物科技有限公司。试验中的其他试剂均为分析纯。
1.2 主要设备与仪器
UV2550 紫外可见分光光度计,日本岛津;Milli-Q-Plus超纯水发生器, 德国赛多利斯;BSM 分析天平,上海卓精科技有限公司;HH-4 数显恒温水浴锅,常州智博瑞仪器制造有限公司。
2 试验方法
2.1 ABTS自由基清除能力的测定
ABTS经活性氧氧化后生成稳定的蓝绿色阳离子ABTS自由基,向其中加入被测物质,如果该物质中存在抗氧化成分,则该物质会与ABTS自由基发生反应而使反应体系褪色[11],被广泛用于测试物质的抗氧化能力。采用ABTS自由基清除法测定甘草提取物中的6种主要成分,参考文献[12] 的方法并作修改。测定方法如下:分别取20μL不同浓度梯度的样品溶液加到 2mL ABTS溶液中(初始吸光度在734nm处为0.70±0.02,记为A0min),反应3min后在 734nm处测定吸光度(记为A3min),每个浓度样品进行3次平行试验。根据以下公式计算每个样品的ABTS自由基清除率(%):
然后以样品的浓度为横坐标,以ABTS自由基清除率为纵坐标,绘制曲线。
2.2 DPPH自由基清除能力的测定
DPPH自由基在乙醇溶液中是一种稳定的自由基,对波长517nm处的光有强吸收。当反应体系中加入自由基清除剂时,DPPH自由基的单电子被配对,在最大吸收波长处(517nm)处吸光度变小,加入的自由基清除剂抗氧化能力越强,吸光度下降越大[13],也常用于物质抗氧化能力的测定。采用DPPH自由基清除法测定甘草提取物中的6种主要成分,参考文献[14] 的方法并略作修改。测定方法如下:分别取100 μL不同浓度梯度的样品溶液及 2mL DPPH 溶液加入到同一试管混匀,室温下暗处静置 30min后测定其517nm处的吸光度(记为Asample);将100 μL溶剂(无水乙醇或者相应的缓冲溶液)与2mL DPPH溶液混匀,暗处静置30min后测定其517nm处的吸光度 (记为Acontrol);将100 μL测试样品溶液与2mL无水乙醇混匀,暗处静置 30min后测定其517nm处的吸光度(记为Ablank)。每个待测样品进行3次平行试验,根据以下公式计算每个样品的DPPH自由基清除率(%):
然后以样品的浓度为横坐标,以DPPH自由基清除率为纵坐标,绘制曲线。
2.3 FRAP(铁离子还原能力)抗氧化能力的测定
在酸性条件下,Fe3+-TPTZ可被样品中还原性物质还原为Fe2+-TPTZ形式,并呈现出明显的蓝色,于593nm处具有最大吸光度,在Fe3+-TPTZ过量的情况下,检测蓝色物质的生成量可以反映待测样品的还原能力,即样品的抗氧化能力(FRAP)[15]。采用FRAP法测定甘草提取物中的6种主要成分,参考文献[16] 的方法并略作修改。测定方法如下:取一试管,加入3.3mL的醋酸盐缓冲液(pH值为3.6),加入330 μL的20mmol/L FeCl3溶液,加入330μL的10mmol/L TPTZ溶液,振荡使其混匀,在37℃恒温孵育5 min,形成Fe3+-TPTZ;再在其中加入330μL不同浓度梯度的样品溶液,在37℃恒温反应15min后,在波长593nm处测定其吸光度。每个待测样品进行3次平行试验,以样品浓度为横坐标,吸光度为纵坐标,绘制曲线,根据曲线的斜率及同浓度下吸光度的大小来比较样品的抗氧化能力。
2.4 酪氨酸酶活性抑制试验
酪氨酸酶在机体内能将L-酪氨酸羟化,产生邻位二羟基苯丙氨酸(L-多巴),再将多巴氧化成多巴醌,进而生成一系列引起褐化的色素类物质[17]。酪氨酸酶抑制剂可以抑制酶的活性,在医药、化妆品和食品领域应用广泛[18]。采用酪氨酸酶活性抑制试验测定甘草提取物6种成分的酶抑制能力,参考文献[19] 的方法并做修改。以0.5 mmol/L的多巴为底物,用0.05mol/L的磷酸缓冲液(pH值为6.8)配制。取3支试管a、b、c分别加入2.8mL底物溶液,32℃预热10 min后, b和c加入100μL不同浓度的样品溶液,a加入等体积无水乙醇。混匀后,a,b加入100μL酪氨酸酶溶液(酶浓度为400U/mL),c加入100μL磷酸缓冲溶液,摇匀,反应10min后分别测定波长475nm处的吸光度,平行测定3次。试管a的溶液所测的吸光度记为A1,试管b的溶液所测的吸光度记为A2,试管c的溶液所测的吸光度记为A3。根据公式:

计算出不同样品浓度下的酶抑制率。然后以样品浓度为横坐标,以酶抑制率为纵坐标,绘制曲线,进而比较样品的酶抑制能力。
2.5 分子对接试验
采用AutoDock软件分析甘草提取物与酪氨酸酶之间的相互作用,参考文献[20] 和[21] 的方法稍加修改。首先从https://pubchem.ncbi.nlm.nih.gov/网站上下载蘑菇酪氨酸酶(PDB ID: 2Y9X)及甘草提取物(槲皮素、光甘草定、异甘草素、刺芒柄花素和甘草次酸)的3D结构文件(甘草酸因手性原子数量较多而3D结构难以确认,尚无3D结构图),然后用Chem 3D软件转化成PDB格式。利用AutoDockTools 1.5.4对酪氨酸酶大分子(受体)进行处理(包括去除水,加氢等),并保存为pdbqt文件;甘草提取物的5个主要成分(配体)也使用同样方法保存为pdbqt文件;设置X、Y、Z轴值为4.827、28.489、92.878,使盒子(Grid box)处于分子中心,整个大分子均在盒子之内,盒子大小为88、76、106,一个网格的间距是0.375Å。利用Autogrid计算格点的能量分数,采用拉马克遗传算法(Lamarckian genetic algorithm)进行对接运算,并设定运算次数为100次。一般结合能量最低时的对接结果就是大分子与配体结合最稳定的结构,将对接结果保存为PDB格式,利用PyMoL软件查看最佳构象并制图。
2.6 数据统计分析
所有试验数据均重复3 次(n=3),采用Microsoft Office Excel 2007 数据分析工具进行处理,并用Duncan 多重比较(SSR 法)检验各处理平均数之间的差异显著性(P<0.05)。试验数据以平均值±标准差(Mean±SD)表示,采用Origin Pro 8.5 软件作图。
3 结果与讨论
3.1 甘草提取物主要成分的结构式
为了在一定程度阐明甘草提取物中6种主要成分(槲皮素、光甘草定、异甘草素、刺芒柄花素、甘草酸和甘草次酸)的构效关系,从https://pubchem.ncbi.nlm.nih.gov/上获取了6种主要成分的结构式,如图1所示。
3.2 ABTS自由基清除能力的测定
以样品的浓度为横坐标,以ABTS自由基清除率为纵坐标,绘制曲线如图2所示。由于其余3种成分的ABTS自由基清除能力不明显,检测结果过小,即无抗氧化能力,因此图2只显示槲皮素IC50、光甘草定、异甘草素的ABTS自由基清除率与样品浓度的关系。从图2可看出,ABTS自由基清除能力大小顺序依次为:槲皮素>光甘草定>异甘草素;根据其各自的曲线方程得出槲皮素和光甘草定清除率的IC50(ABTS自由基清除率达到50%时的浓度)分别为(20.82 ± 2.11)和(35.92 ± 1.44)μmol/mL,异甘草素未能检测到其IC50,IC50越小清除能力越强。槲皮素、光甘草定、异甘草素均为甘草黄酮类化合物[22],结构中含酚羟基;酚羟基可以与自由基反应生成稳定结构,使自由基链反应终止[23],酚羟基的数量以及酚羟基的位置决定了甘草提取物是否具有自由基清除能力。槲皮素具有4个酚羟基,分别构成间苯二酚结构和邻苯二酚结构;光甘草定有2个酚羟基构成间苯二酚结构;异甘草素具有3个酚羟基,其中2个构成间苯二酚结构,另一个为对位酚羟基;而刺芒柄花素只有1个酚羟基,甘草酸和甘草次酸没有酚羟基;由此可以推断3种成分的自由基清除能力与酚羟基的数量呈现正相关[24]。因此,槲皮素、光甘草定与异甘草素有较高的自由基清除能力,是甘草提取物表现出抗氧化功效的主要成分。

图1 甘草提取物中6种主要成分的结构式
3.3 DPPH自由基清除能力的测定
以样品的浓度为横坐标,以DPPH自由基清除率为纵坐标,绘制曲线如图3所示。甘草酸、甘草次酸及刺芒柄花素测定结果过小,即自由基清除能力不明显,因此图3只显示槲皮素、光甘草定和异甘草素的DPPH自由基清除率。

图2 3种待测成分的ABTS 自由基清除能力 图3 3种待测成分的DPPH自由基清除能力
从图3可看出,槲皮素DPPH自由基清除能力显著高于光甘草定和异甘草素;根据曲线方程得出槲皮素DPPH自由基清除率IC50(DPPH自由基清除率达到50%时的浓度)为(7.50 ± 0.05)μmol/mL。光甘草定和异甘草素的DPPH自由基清除能力有限,同浓度下光甘草定比异甘草素具有更强的清除能力。研究表明,槲皮素可提供活泼氢使自由基灭活,而本身被氧化形成新的自由基,因其含邻苯二酚结构而具有较高的稳定性[25]。DPPH与ABTS虽反应机制不同,但均是通过消除溶液中生成的自由基而达到抗氧化的作用,因此与ABTS法测定结果一致,自由基清除能力与甘草提取物结构中的酚羟基有密不可分的关系,如上述ABTS法中所分析。
3.4 FRAP(铁离子还原能力)的测定
以样品浓度为横坐标,以吸光度为纵坐标,绘制曲线如图4所示。甘草酸、甘草次酸及刺芒柄花素无明显作用,因此图4只显示槲皮素、光甘草定和异甘草素在FRAP测定中所呈现的吸光度值。比较图4中直线的斜率可知,槲皮素抗氧化能力(还原能力)强于光甘草定和异甘草素,其能力也与酚羟基的数量呈现正比。该试验结果表明在酸性条件下,槲皮素、光甘草定和异甘草素三者具有还原铁离子的能力,还原能力也与其结构中的酚羟基数量有关。
3.5 酪氨酸酶活性抑制试验
以样品浓度为横坐标,以酶抑制率为纵坐标,绘制曲线如图5所示,显示 6种成分对酪氨酸酶活性抑制的影响。槲皮素高浓度时对酪氨酸酶具有抑制作用(可能是其苯环上的间酚结构起作用),前人研究表明槲皮素以竞争性抑制形式抑制酪氨酸酶活性[26],起到抑制作用的可能是其具有邻苯二酚结构,能够作为酪氨酸酶的底物与多巴竞争;槲皮素低浓度表现为激活作用,主要原因可能是槲皮素结构(见图1)中有邻苯二酚结构(类似多巴),可能作为酪氨酸酶底物被氧化,而使溶液475nm处的吸光度增加,从而表观呈现出酶的激活作用。光甘草定的抑制作用较明显,随着浓度的增大,抑制作用逐渐增强,酶抑制IC50(酶抑制率达到50%时的浓度)为(0.90±0.02)μmol/mL,抑制作用主要是其苯环上的间酚结构[27]。异甘草素以及刺芒柄花素表现出一定的激活作用,可能是因为具有酚羟基结构(类似酪氨酸)[28],是一种酪氨酸酶的底物,因此酪氨酸酶将其氧化后,形成的产物在475nm处有吸收,结果表现为激活酪氨酸酶活性。
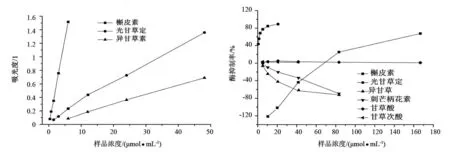
图4 3种待测成分的FRAP抗氧化能力 图5 6种待测成分对酪氨酸酶活性的影响
3.6 分子对接结果

表1 最佳构型的相关参数

图6 酪氨酸酶与光甘草定的分子对接结果
分子对接是将已知3D结构的配体分子逐一放在靶标受体分子的活性位点处,通过不断优化受体化合物的位置、构象、分子内部可旋转键的二面角和受体的氨基酸残基侧链和骨架,寻找受体小分子化合物与靶标大分子作用的最佳构象,并预测其结合模式、亲和力和通过打分函数挑选出接近天然构象的与受体亲和力最佳的配体的一种理论模拟分子间作用的方法[29]。采用Autodock研究甘草提取物5种成分(配体)与酪氨酸酶(受体)的相互作用,得到配体与受体对接后的最佳构象的结合能和氢键数量,见表1。由表1可知,光甘草定结合能最低,氢键数量较多,与酶结合能力最稳定,故抑制能力较好,这与前面的酪氨酸酶抑制试验结果一致,最佳构象下光甘草定作用在酪氨酸酶活性位点附近(见图6);甘草次酸结合能较高,且结构中氢键数量较少,说明甘草次酸与酪氨酸酶结合能力弱,没有酪氨酸酶抑制作用,这也与酪氨酸酶抑制试验结果一致。槲皮素、异甘草素和刺芒柄花素与酪氨酸酶结合能也较低,但在最佳构象下,这几种药物与酪氨酸酶的结合位点偏离活性中心较远,因此对酶的活性影响不明显(在此不予讨论)。
由于光甘草定对酪氨酸酶的抑制能力强,因此用PyMoL软件查看光甘草定与酪氨酸酶的相互作用,从分子水平阐述其抑制作用机制,结果如图6所示。图6(a)中灰色区域代表的是整个酪氨酸酶大分子,含有2个铜原子(Cu)的空腔为酪氨酸酶的活性中心,其中蓝色区域为活性中心的6个组氨酸残基配体(His);红色的棍状结构为光甘草定分子,并没有占据活性中心,而是与部分组氨酸残基和其他氨基酸残基结合。为了更加清楚地看出光甘草定与酪氨酸酶的氢键作用,将活性中心和结合位点用球棍模型显示,如图6(b)所示,黄色虚线代表光甘草定与酪氨酸酶的氢键作用(6个)。这些结果说明,光甘草定主要是通过氢键作用影响酪氨酸酶活性中心及其附近的氨基酸残基,从而影响了活性中心的构型,进而影响了底物与酪氨酸酶的结合,表现出非竞争性的抑制。
4 结论
1)3种抗氧化能力测试方法测定的结果一致,抗氧化能力最强的是槲皮素,其次是光甘草定,然后是异甘草素,抗氧化能力的大小与酚羟基的数量成正相关;甘草酸、甘草次酸和刺芒柄花素的测定结果过小,不能排除仪器等系统误差的干扰,但其自由基清除能力作用不明显。
2)酪氨酸酶活性抑制试验结果表明,光甘草定具有较强的酪氨酸酶抑制作用,槲皮素低浓度时主要表现为酪氨酸酶的底物,而高浓度能够对酪氨酸酶产生抑制作用;异甘草素和刺芒柄花素因具有1个酚羟基,可能是一种酪氨酸酶底物,表现为激活作用;甘草酸和甘草次酸对酪氨酸酶活性没有显著影响。
3)分子对接结果进一步表明光甘草定的结合能最低,与酪氨酸酶的亲和力最强,能够与酶活性中心附近的氨基酸残基结合,从而影响活性中心的构象,起到非竞争性抑制作用。
4)甘草提取物中的6种主要成分起到抗氧化和酪氨酸酶抑制作用的主要成分分别为槲皮素和光甘草定。

