响应面法优化辣木叶总黄酮提取工艺及其抑菌性研究
马金魁,黄晓辰,张佳仪,冯润香
(肇庆学院食品与制药工程学院,广东 肇庆 526061)
辣木(Moringa oleifera)为辣木科辣木属的多年生热带植物,栽种遍及亚洲、非洲和中美洲的热带及亚热带区域,因其根具有辛辣味,故得名“辣木”[1-2]。在印度、越南及非洲一些国家,辣木的叶、种子、树皮、根等均是民间传统药物,可用于保健和医治疾病,故辣木又被誉为“奇迹之树”[3]。现代研究表明,辣木叶中含充足的蛋白质、维生素和钾、钙、铁等矿质元素,以及黄酮、酚类、有机酸等多种活性物质[4-5],具有调节血压、降血糖、抗氧化、抑菌消炎、抗癌及增强免疫等生理功效[6-7]。我国于20 世纪60年代初将其作为一种药用植物从缅甸引种栽培,2012年国家卫生部将其列为一种新资源食品,2014年成立了中国-古巴辣木科技合作中心[3]。作为一种优质的功能性食品原料,随着其营养及药用价值被逐步发现,辣木已成为可持续农业和生物综合利用领域关注的热点,并在我国云南、两广、福建、台湾等地区成功种植并逐步实现了产业化。
黄酮类化合物是辣木叶中重要活性成分之一,现代药理研究表明,黄酮具有调节免疫、抗感染、抗衰老、抗肿瘤、防止骨质疏松等生物活性[8]。目前,有关辣木叶黄酮提取工艺和体外抗氧化[9-10]、降糖活性[11-12]已有初步研究。王远等[12]利用微波辅助提取辣木叶总黄酮的得率为5.53%,且对α-葡萄糖苷酶有较好抑制作用。孙朦等[13]利用乙醇-超声法提取辣木叶总黄酮的提取率为5.21%,所得黄酮提取物具备较好的自由基清除能力。岳秀洁等[14]研究了乙醇超声辅助提取辣木叶总黄酮的最佳工艺及其抗氧化性。然而,这些研究中涉及的提取方法提取率不高,且关于辣木叶黄酮抑菌性的研究未见相关报道。
目前,黄酮的提取方法主要包括传统醇提法、微波辅助萃取法、超声波辅助提取法、超临界萃取法等[15]。超声波辅助提取法可通过超声波的空化作用促进目标组分的溶出,条件温和,提取效率高。因而,本研究采用超声辅助提取辣木叶总黄酮,优化其提取工艺,并考查所得黄酮的抑菌性,为充分利用辣木资源,进一步推广提高其食用、药用及经济价值提供参考。
1 材料与方法
1.1 材料与试剂
辣木叶,产自云南德宏州,新鲜辣木叶经整理、清洗后置于烘箱中,在50 ℃条件下烘干至恒重,粉碎后过80 目筛,干燥样品粉末于-20 ℃冰箱密封保存,备用。
芦丁标准品(批号Y19N7S25244):北京百灵威科技有限公司;琼脂粉、胰蛋白胨、酵母提取粉:国药集团化学试剂有限公司;氢氧化钠、亚硝酸钠、无水乙醇、硝酸铝:均为分析纯,西陇科学股份有限公司。
供试菌株:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、白色假丝酵母(Candida albicans)、枯草芽孢杆菌(Bacillus subtilis),由肇庆学院生命科学学院微生物实验室提供。
1.2 仪器与设备
DHG-9145A 电热鼓风干燥箱:上海一恒科学仪器有限公司;DS-Y500A 高速多功能粉碎机:上海顶帅电器有限公司;BSA124S-CW 电子天平:赛多利斯科学仪器(北京)有限公司;Scientz-IID 超声波细胞破碎机:宁波新芝生物科技股份有限公司;RE-52AA 旋转蒸发器:上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵:巩义市予华仪器有限责任公司;722S 可见分光光度计:上海精科科学仪器有限公司;TDZ5-WS 低速台式离心机:湖南湘仪实验室仪器开发有限公司;YXQ-LS-50A 立式压力蒸汽灭菌锅:广州市深化生物技术有限公司;SW-CJ-10U 洁净工作台:苏净集团苏州安泰空气技术有限公司。
1.3 方法
1.3.1 辣木叶总黄酮的提取工艺
精确称取1.00 g 辣木叶粉末于50 mL 烧杯中,按一定料液比添加一定体积分数的乙醇溶液,设置相应的超声波功率超声辅助提取一定时间。提取液经离心、抽滤,取上清液,旋转蒸发浓缩后测定总黄酮含量。
1.3.2 芦丁标准曲线的绘制
按照吴迪等[9]绘制标准曲线的方法,稍作修改。准确称取10 mg 芦丁标准品,用60%乙醇定容于50 mL容量瓶,摇匀,制成浓度为0.2 mg/mL 的芦丁标准溶液。准确吸取 0、1.0、2.0、3.0、4.0、5.0 mL 芦丁标准溶液于25 mL 容量瓶内,各移入5%亚硝酸钠溶液1.0 mL,摇匀,放置6 min 后移入10%硝酸铝溶液1.0 mL,摇匀,放置6 min 后移入4%氢氧化钠溶液10.0 mL,用60%乙醇定容,摇匀后,静置15 min;在510 nm 处测定吸光度。以芦丁浓度作为横坐标(x),吸光度为纵坐标(y),建立标准曲线的回归方程y=6.684 5x+0.001 5(R2=0.998 6),在 0~0.04 mg/mL 范围内线性关系良好。
1.3.3 辣木叶总黄酮含量测定
精确移取1.0 mL 样品提取液于25 mL 容量瓶中,按1.3.2 中方法测定吸光度,代入线性回归方程进行计算,得出待测液黄酮的浓度。按照以下公式计算总黄酮的提取率:

式中:C 为提取液的浓度,mg/mL;V 为提取液体积,mL;m 为辣木叶样品质量,g。
1.3.4 单因素试验
1.3.4.1 超声功率对辣木叶总黄酮提取率的影响
精确称取1.00 g 辣木叶粉末,固定乙醇体积分数为 60%,液料比 30 ∶1 (mL/g),提取时间 30 min,按1.3.3 中方法考察超声功率为 200、300、400、500、600 W条件下辣木叶总黄酮提取率。
1.3.4.2 液料比对辣木叶总黄酮提取率的影响
精确称取1.00 g 辣木叶粉末,提取功率为300 W,固定乙醇体积分数为60%,提取时间30 min,按1.3.3中方法考察液料比为 10∶1、20∶1、30∶1、40∶1、50∶1(mL/g)的条件下辣木叶总黄酮提取率。
1.3.4.3 超声辅助提取时间对辣木叶总黄酮提取率的影响
精确称取1.00 g 辣木叶粉末,提取功率为300 W,液料比为40 ∶1(mL/g),固定乙醇体积分数为60%,按1.3.3 中方法考察超声辅助提取时间为 20、30、40、50、60 min 条件下辣木叶总黄酮提取率。
1.3.4.4 乙醇体积分数对辣木叶总黄酮提取率的影响
精确称取1.00 g 辣木叶粉末,提取功率为300 W,液料比为40 ∶1(mL/g),超声辅助提取时间为40 min,按1.3.3 中方法考察乙醇体积分数为55 %、60 %、65 %、70%、75%、80%条件下辣木叶总黄酮提取率。
1.3.5 响应面试验
在单因素试验分析的基础上,以超声功率(A)、超声时间(B)、乙醇体积分数(C)、液料比(D)为自变量,辣木叶总黄酮提取率为响应值,采用Design-Expert 8.0.6 依据Box-Behnken 中心组合试验设计原理,设计四因素三水平的响应面试验,优化辣木叶总黄酮的提取工艺,试验设计编码值及因素见表1。
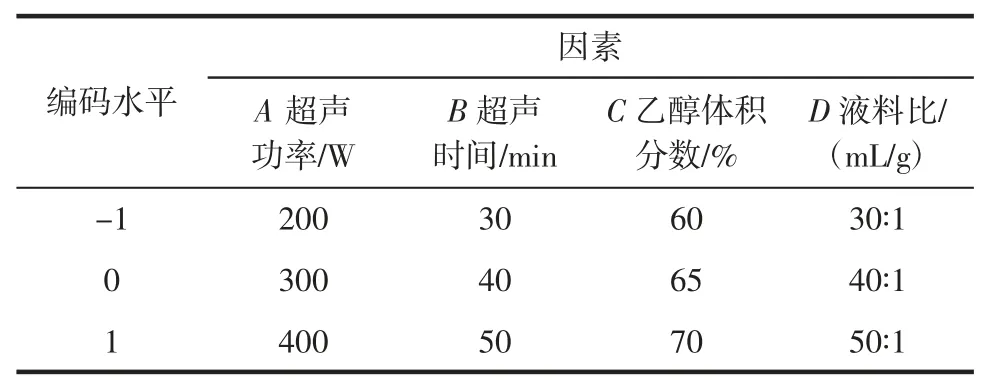
表1 响应面设计编码值与因素Table 1 Coding values and factors of response surface design
1.3.6 辣木叶总黄酮抑菌活性的测定
1.3.6.1 菌悬液的准备
采用曹培杰等[16]的方法,选取白色假丝酵母、金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌为受试菌种,其中细菌的培养利用牛肉膏蛋白胨培养基,酵母的培养利用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。将供试菌种分别进行斜面活化,细菌于37 ℃恒温培养24 h,酵母于28 ℃恒温培养48 h。分别从斜面挑取菌落顶端转接至液体培养基中培养,控制菌悬液浓度近似为106cfu/mL,待用。
1.3.6.2 抑菌圈直径测定
按照蒋雨等[17]采用的琼脂扩散法,稍作修改。待灭菌后的固体培养基冷却至约50 ℃时,每50 mL 培养基加入1 mL 供试菌种的菌悬液,混匀后倒入已放置好无菌干燥牛津杯(每皿4 个)的培养皿中,每皿加入约25 mL 培养基,凝固完全后用无菌镊子夹取出牛津杯,用移液枪每孔准确吸取150 μL 辣木叶黄酮提取液,以无菌水和60%乙醇作阴性对照。于37 ℃培养24 h(细菌),28 ℃培养48 h(酵母)后取出,测量抑菌圈直径,操作重复3 次取平均。
1.3.6.3 最低抑菌浓度MIC 测定
按照吴均等[18]采用的二倍稀释法,稍作修改。将辣木叶提取原液制成系列浓度样品溶液,与供试菌的液体培养基混合均匀,使其中所含辣木叶总黄酮浓度依次为 0、0.26、0.51、1.03、2.05、4.10 mg/mL,培养基于121 ℃高压灭菌20 min。将灭菌后的培养基倒入平板,待充分凝固后,用移液枪分别吸取100 μL 菌悬液,涂布均匀,37 ℃培养 22 h~24 h(细菌),28 ℃培养 40 h~48 h(酵母、霉菌)后取出,观察供试菌的生长情况。肉眼观察未见供试菌生长的辣木叶总黄酮浓度即为该菌的最低抑菌浓度(minimum inhibitory concentration,MIC)。
2 结果与讨论
2.1 单因素试验结果
2.1.1 超声功率对辣木叶总黄酮提取率的影响
超声功率对辣木叶总黄酮提取率的影响见图1。

图1 超声功率对总黄酮提取率的影响Fig.1 Effect of ultrasonic power on extraction efficiency of total flavonoids
如图1所示,当超声功率处于较低水平时,随着功率的增大,辣木叶总黄酮的提取率逐渐提高;当超声功率为300 W 时,总黄酮提取率达到最大值5.03%,随后提取率逐步下降。超声波的机械波动作用和空化效应对细胞壁的破坏作用越大,越有利于黄酮的溶出;而功率过大,则破坏黄酮的结构,从而导致提取率下降[19]。
2.1.2 超声时间对辣木叶总黄酮提取率的影响
超声时间对辣木叶总黄酮提取率的影响见图2。
如图2所示,随着超声时间的延续,辣木叶总黄酮提取率逐渐增大;当超声时间为40 min 时,总黄酮提取率达最大值7.15%;持续延长超声时间,提取率则逐渐呈下降趋势。随着超声时间的增加,辣木叶细胞破碎程度迅速增大,总黄酮的溶出率逐渐增大;随着超声时间的继续延长,胞内其他物质溶出进入提取液,影响黄酮的提取效果[20],且超声时间越长,超声波的空化效应过大,部分黄酮结构可能被破坏,也将降低总黄酮提取率[21]。
2.1.3 乙醇体积分数对辣木叶总黄酮提取率的影响
乙醇体积分数对辣木叶总黄酮提取率的影响见图3。
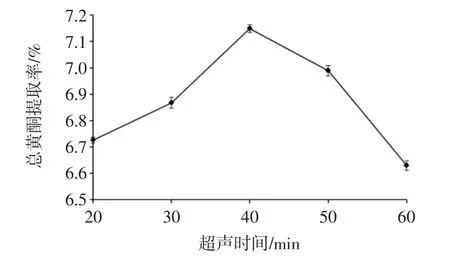
图2 超声时间对总黄酮提取率的影响Fig.2 Effect of ultrasonic time on extraction efficiency of total flavonoids

图3 乙醇体积分数对总黄酮提取率的影响Fig.3 Effect of ethanol concentration on extraction efficiency of total flavonoids
如图3所示,乙醇体积分数对辣木叶总黄酮提取率有显著影响。当乙醇浓度在55%~65%时,随着浓度持续增加提取率也随之增大;当乙醇体积分数为65%时,黄酮提取率达最大值6.77%;之后,随着乙醇体积分数继续增大,黄酮提取率呈下降趋势。可能由于乙醇体积分数较低时,水溶性物质大量溶解,影响黄酮的提取,使黄酮提取率偏低;随着乙醇体积分数的增加,黄酮与乙醇极性接近,溶出增多,提取率增加;当乙醇体积分数过高时,溶剂极性减小,部分黄酮苷不能溶解,同时造成脂溶性杂质的溶出[22],导致总黄酮的提取率降低。
2.1.4 液料比对辣木叶总黄酮提取率的影响
液料比对辣木叶总黄酮提取率的影响见图4。
如图4所示,当液料比在 10∶1(mL/g)~40∶1(mL/g)范围变化时,随着液料比的增大,辣木叶总黄酮的提取率逐步上升;之后,随着液料比继续增大,总黄酮提取率呈现下降趋势。当提取溶剂过少时,导致提取液浓度过高,不利于黄酮的充分溶出,使总黄酮提取率总体偏低;逐步提高溶剂用量,在超声波的作用下,总黄酮得到更大程度的溶解;溶剂过多时,黄酮的溶出已达极限,而其他物质溶解增多,影响了黄酮的提取效果,导致其提取得率下降[23],且溶剂过多会造成资源浪费并不利于后续的浓缩。综合考虑,辣木叶总黄酮提取的较适液料比为 40 ∶1(mL/g)。

图4 液料比对总黄酮提取率的影响Fig.4 Effect of solid-liquid ratio on extraction efficiency of total flavonoids
2.2 响应面试验结果
响应面试验结果见表2。

表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
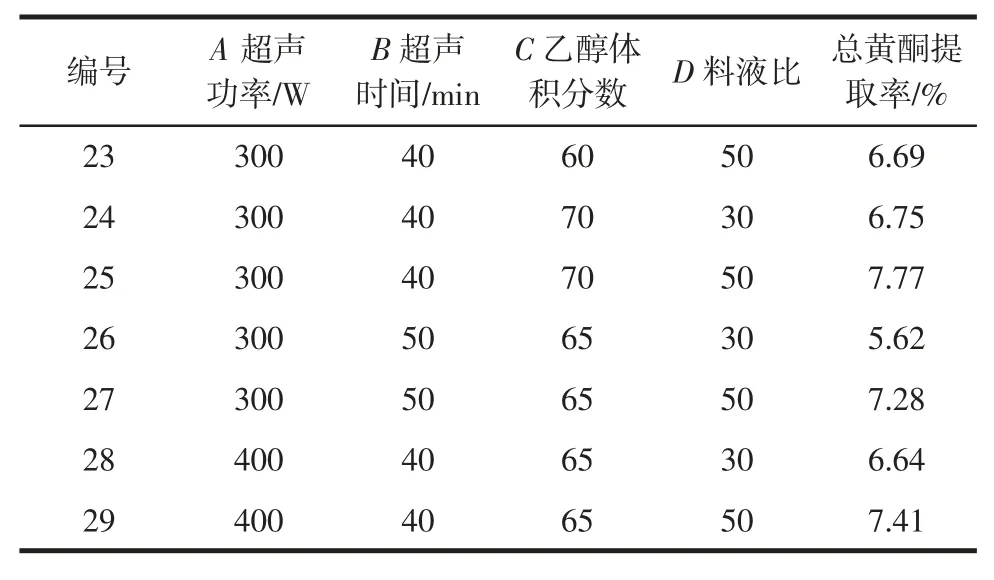
表2 响应面试验设计及结果Table 2 Experimental design and results for response surface analysis
2.2.1 回归方程方差分析
采用Design-Expert 8.0.6 软件对响应面试验数据进行多元回归拟合,建立辣木叶总黄酮提取率(Y)与超声辅助提取各因素变量间的回归方程:Y=-83.213+0.061A+0.119B+2.455C-0.090D-2.025×10-4AB-4.5×10-4AC+1.4×10-4AD+1.25×10-3BC+5.675×10-3BD+4.8×10-3CD-4.808×10-5A2-5.083×10-3B2-0.019C2-5.808×10-3D2。
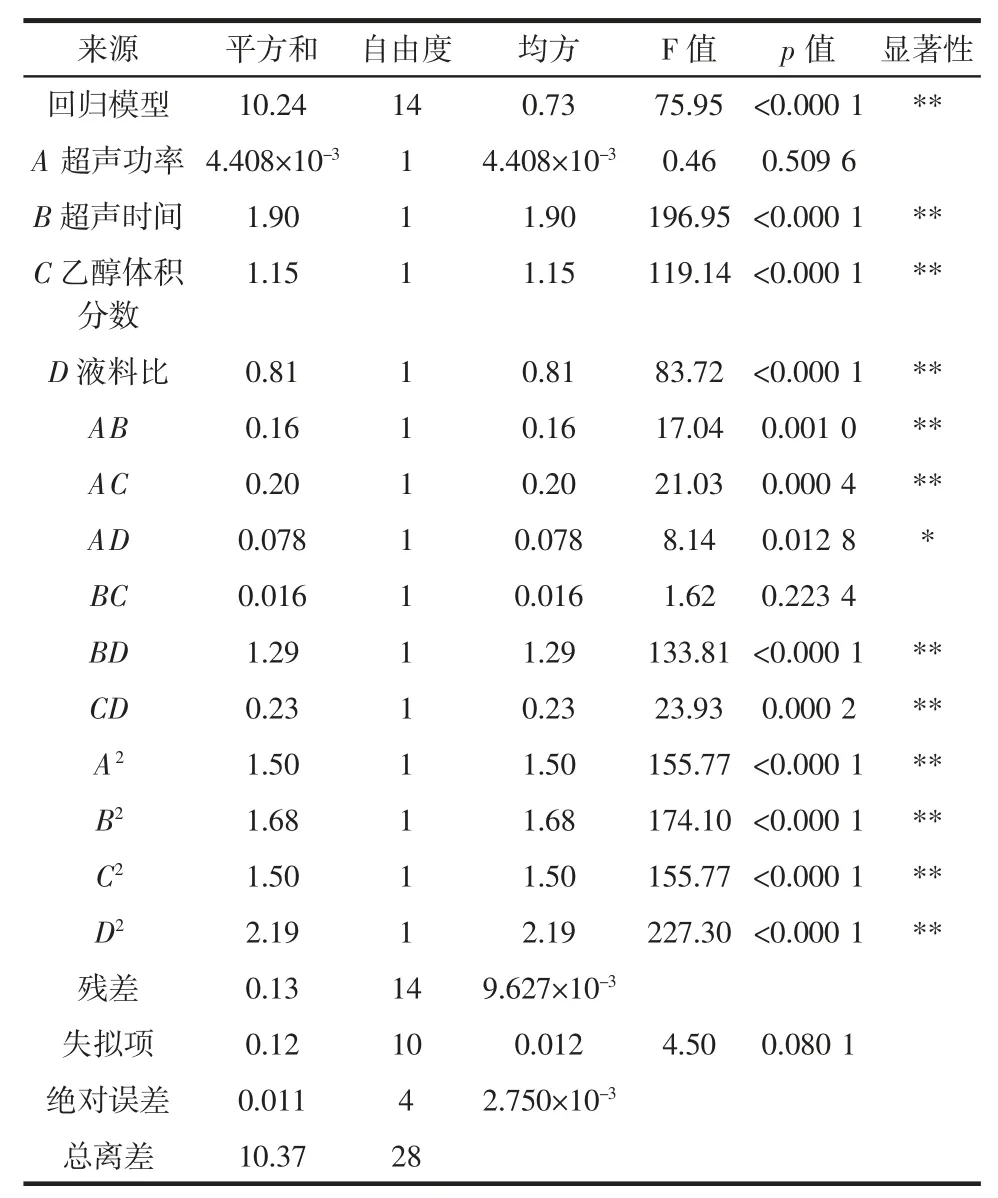
表3 响应面试验方差分析表Table 3 Analysis of the variance of the extraction efficiency of total flavonoids
由方差分析可知,模型p<0.000 1(极显著),失拟项 p=0.0801>0.05(不显著),相关系数 R2为 0.95,决定系数RAdj.2为0.90,表明响应面模型拟合度好,可信度高,可用于计算和预测辣木叶总黄酮的提取率。由各变量显著性水平可看出,各考查因素对辣木叶总黄酮提取率的影响效应次序为:B(超声时间)>C(乙醇体积分数)>D(液料比)>A(超声功率)。其中,一次项 A 和交互项BC 对回归模型影响不显著,交互项AD 影响显著,其余各项对回归模型影响极显著。
2.2.2 响应面交互作用分析
响应面图的陡峭程度和等高线图的形状可直观反映各因素交互作用状况。
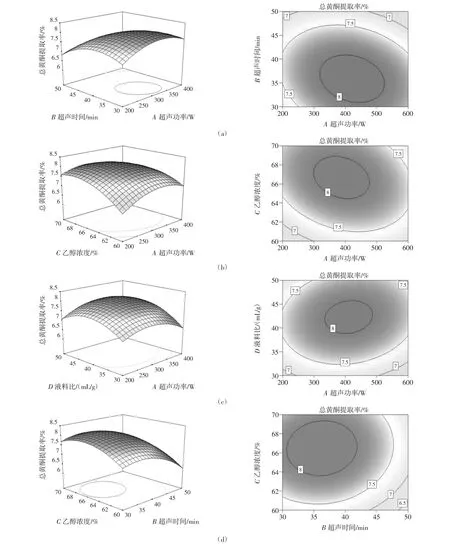

图5 交互作用对总黄酮率提取率的影响Fig.5 Effects of interaction on extraction efficiency of total flavonoids
从图5可知,超声功率和超声时间、超声功率和乙醇体积分数、超声功率和液料比、超声时间和液料比、乙醇体积分数和液料比交互作用曲面图形状陡峭,且等高线趋于椭圆形,说明两两因素间交互作用显著[24]。超声时间和乙醇浓度的交互作用响应面图形状相对平缓,且等高线形状趋于圆形,表明该两因素交互作用不显著。该观察结果与模型方差分析结论一致。
2.2.3 验证试验
经过Design-Expert 软件确定超声辅助提取辣木叶总黄酮的最佳提取工艺条件:超声功率400 W、超声时间34.73 min、乙醇体积分数65.4 %、料液比41.03∶1(mL/g),辣木叶总黄酮提取率预测值可达7.76%。为方便实际操作,以超声功率400 W、超声时间35 min、乙醇体积分数65%、料液比41 ∶1(mL/g)进行试验,测得辣木叶总黄酮提取率为7.64%,与理论预测值接近,表明该模型优化的提取工艺可信度高,可为辣木叶总黄酮的放大生产提供理论依据。
2.3 辣木叶总黄酮的抑菌活性分析
2.3.1 抑菌性分析
辣木叶黄酮提取液对4 种供试菌均有抑制作用,但抑菌效果在4 种供试菌间有显著差异。其中,辣木叶总黄酮提取液具对白假丝酵母的抑制作用最强,其次为大肠杆菌、金黄色葡萄球菌,对枯草芽孢杆菌的抑制作用较弱。该结果表明辣木叶总黄酮对供试细菌和酵母均具有显著的抑菌效果。

表4 辣木叶总黄酮提取液的抑菌圈直径Table 4 Diameter of inhibition zone of total flavonoids extracted from Moringa oleifera leaves
2.3.2 最低抑菌浓度的测定
为进一步考查辣木叶总黄酮提取液的抑菌活性,采用二倍梯度稀释,将辣木叶总黄酮提取物稀释成浓度范围为0.26 mg/mL~4.10 mg/mL 的梯度稀释液,测定辣木叶总黄酮的MIC 值。结果如表5所示,辣木叶总黄酮提取液对白色假丝酵母、大肠杆菌、金黄色葡萄球菌的抑制效果较好,其MIC 均为2.05 mg/mL,对枯草芽孢杆菌的抑制作用最弱,其MIC 为4.10 mg/mL。

图6 辣木叶总黄酮抑菌性分析Fig.6 Antibacterial effect of total flavonoids extracted from Moringa oleifera leaves
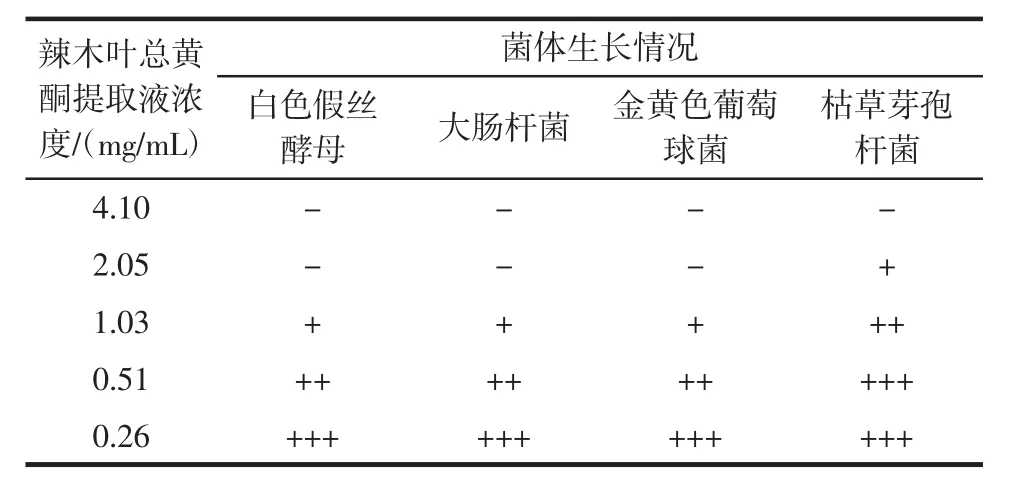
表5 辣木叶总黄酮的最低抑菌浓度Table 5 The minimum inhibitory concentration of total flavonoids in Moringa oleifera leaves
3 结论
利用超声波辅助提取辣木叶总黄酮,结合单因素试验和响应面分析优化确定辣木叶总黄酮最佳提取工艺为超声功率400 W、超声时间35 min、乙醇体积分数65%、液料比41 ∶1(mL/g),所得辣木叶总黄酮提取率为7.64%,显著高于文献报道的采用乙醇提取[9](总黄酮得率4.88%)、乙醇超声波提取[13](总黄酮得率5.17%)、微波辅助提取[12](总黄酮得率5.53%),表明本研究优化所得工艺条件可对辣木叶总黄酮进行有效提取,具有较好的实际应用价值。
抑菌研究结果表明,优化所得工艺条件下提取的辣木叶总黄酮对白色假丝酵母、金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌具有不同程度的抑菌作用,其中对白色假丝酵母、大肠杆菌、金黄色葡萄球菌的抑制效果较好,MIC 为2.05 mg/mL,对枯草芽孢杆菌的抑制作用最弱,MIC 为4.10 mg/mL。该研究弥补了辣木叶总黄酮抑菌性研究的空白,且结果表明辣木叶总黄酮对金黄色葡萄球菌抑菌效果优于文献报道的辣木叶蛋白酶解产物。
本研究应用响应面法优化超声辅助提取辣木叶总黄酮的提取工艺,并考察辣木叶总黄酮的抑菌性,为辣木资源的充分利用及食药功能的进一步研究提供参考。

