感赤星病烟叶的真菌群落结构分析
刘 畅, 汪汉成, 谢红炼, 陈乾丽, 余知和, 孙光军
(1.长江大学 生命科学学院, 湖北 荆州 434025; 2.贵州省烟草科学研究院, 贵州 贵阳 550081; 3.长江大学 农学院, 湖北 荆州 434025; 4.贵州大学 农学院, 贵州 贵阳 550025; 5.贵州省烟草专卖局, 贵州 贵阳 550003)
烟草是我国重要的经济作物,但其病原菌较多,如由烟草白粉病菌(ErysiphecichoracearumDC.)引起的烟草白粉病[1]、由链格孢病菌(Alternaraiaalternata)引起的烟草赤星病[2]、由茎点霉病菌(Phomasp.)引起的茎点霉叶斑病[3]、由灰葡萄孢病菌(BotrytiscinereaPer. et Fries)引起的烟草灰霉病[4]、由多主棒孢霉病菌(Corynesporacassiicola)引起的棒孢霉叶斑病[5]、由烟草野火病菌(Pseudomonastabaci)引起的烟草野火病[6]等。在烟草进入成熟采烤期后,烟草叶片通常较易感病,且条件适宜时多种病害常混合发生,未采取药剂防治的情况下,病害造成的损失可达50%以上[7]。病害的准确诊断是病害科学防治的关键,传统的诊断方法通常基于病害的危害症状。然而,烟草叶片成熟后期,多种病害常混合发生,引起的病症通常难以辨认;且叶片被侵染后,环境中的腐生菌也易在叶片上定植与危害,进而形成复杂的危害症状。此外,局部特殊的气候环境也会引起复杂的危害症状。
近年来,贵州烤烟主产区铜仁市和黔东南烟区,烟草赤星病严重发生,且造成严重的经济损失。在烟草染感赤星病的过程中,有哪些病原菌及腐生病菌会共同侵染,以及在共同侵染过程中的菌群组成情况鲜有报道。扩增子测序的分析技术可以准确了解环境样品的群落结构,已被用于土壤及叶际微生物多样性的分析[8-10]。然而,将其用于烟草赤星病的叶际微生物多样性分析还未见报道。为此,以贵州黔东南感赤星病的烟叶为研究对象,分析该地区田间感赤星病烟叶的叶际真菌群落结构,为指导该地区烟草赤星病的防治提供科学依据。
1 材料与方法
1.1 样品采集
2018年8月29日,在贵州省黔东南州烟区烟草赤星病发生严重的烟田进行样品采集。在田间随机选取3株严重感赤星病的烟叶,编号分别为YBBqdL1、YBBqdL2、YBBqdL3,剪刀经酒精消毒后剪取发病叶片,置于无菌取样袋并分别编号。将样品放入低温保藏箱,并迅速带回实验室,置于―80℃的冰箱保存、备用。
1.2 试剂盒及测序系统
GeneJET 胶回收试剂盒和Ion Plus Fragment Library Kit 48 rxns 建库试剂盒,均购自Thermo fisher公司。IonS5XL测序系统由北京诺禾致源科技股份有限公司提供。
1.3 样品DNA提取、扩增及测序
采用CTAB法对烟叶样品进行DNA提取,具体方法参照李渊等[11]的研究。吸取1000 μL CTAB裂解液至2.0 mL EP管里,加入溶菌酶,将适量的样品加入裂解液中,65℃水浴,期间颠倒混匀数次使样品充分裂解。样品总DNA提取完毕后,浓度和纯度使用NanoDrop测定,纯度A260/A280值要求在1.8~2.0。
1.4 ITS文库构建及高通量测序
以样品DNA为模板,采用引物ITS5-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC-3′)对样品的ITS区进行PCR扩增。PCR扩增体系为30 μL:2×Phusion High-Fidelity PCR Master Mix with GC Buffer 15 μL,引物(2 μmol/L)3 μL,gDNA(1 ng/μL)2 μL,最后用灭菌的ddH2O将反应体系补至30 μL。PCR反应程序参数:98℃预变性1 min;98℃变性10 s,50℃退火30 s,72℃延伸30 s,30个循环;最后72℃延伸5 min。PCR扩增产物用2%的琼脂糖凝胶进行电泳检测其扩增质量,使用GeneJET胶回收试剂盒纯化产物。将合格的纯化样品送至北京诺禾致源科技股份有限公司,使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermofisher的IonS5XL进行测序。
1.5 测序数据处理与统计分析
将IonS5XL下机数据导出fastq文件,即为测序得到的原始数据(Raw Reads)。根据barcode序列区分各个样本的数据,barcode允许的错配数为0,最大引物错配数为2。质控使用Cutadapt软件(V1.9.1,http://cutadapt.readthedocs.io/en/stable/)进行。使用UCHIME(UCHIME Algorithm,http://www.drive5.com/usearch/manual/uchime_algo.html)进行嵌合体过滤,得到用于后续分析的有效数据。使用Uparse(version v7.0.1001)对所有样本的Effective Tags以97%的一致性(Identity)进行OTUs(Operational Taxonomic Units)聚类,用Mothur方法与SILVA(http://www.arb-silva.de)的SSUrRNA数据库对OTUs的代表序列进行物种注释分析(设定阈值为0.8~1),研究各样本的物种组成,得到每个样品的OTUs和分类谱系的基本分析结果。再使用Qiime软件(Version 1.9.1)对OTUs进行丰度、Alpha多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。最后在以上分析的基础上,进行一系列的基于OTUs、物种组成的聚类分析等统计比较分析。以上分析均在北京诺禾致源科技股份有限公司完成。
2 结果与分析
2.1 ITS序列测序深度及数据质控
稀释曲线(Rarefaction curve)展示了不同样品间多样性的差异。样本曲线的延伸终点的横坐标位置为该样本的测序数量。从图1看出,3个样品的稀释曲线在测序深度为20 000 reads时趋于平缓,表明测序已趋于饱和,增加测序数据无法再找到更多的OTU,因此,测序深度已经覆盖到样品中所有的物种,测序数据量足以反映样品中的物种多样性。
感赤星病的3烟株叶部样品(YBBqdL1、YBBqdL2、YBBqdL3)原始序列经优化处理后,共得到240 311条高质量序列片段,56 761 121个碱基,单一样本序列数在80 054~80 161条,序列平均长度为236 bp,共检测到172个OTUs。
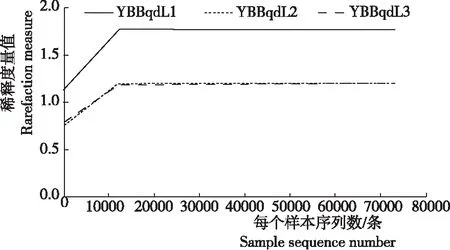
图1样品测序稀释曲线(OTU水平shannon指数)
Fig.1 Rarefaction curve for sequencing samples(Shannon index of OTU level)
2.2 OTU聚类
从表1看出,在97%的相似度水平对样品序列进行OTU聚类,3个不同叶片样品共鉴定得出真菌5个门,13个纲,23个目,32个科,37个属,28个种,172个OTU。
从图2看出,在OTU水平下,3个样本之间真菌种类较为接近,共有的OTU种类远高于单个样本中独有的种类。
2.3 微生物多样性指数
从表2看出,YBBqdL1样本检测到的真菌OTU数量略高于YBBqdL2与YBBqdL3。3个样品的覆盖度指数均到达到1,表明测序结果合理。丰富度指数Chao1、Ace均为YBBqdL3样本真菌群落丰富度高于YBBqdL1与YBBqdL2。多样性指数Shannon、Simpson中,YBBqdL1样本多样性均高于YBBqdL2与YBBqdL3。谱系多样性指数中,YBBqdL3样本高于YBBqdL1与YBBqdL2。
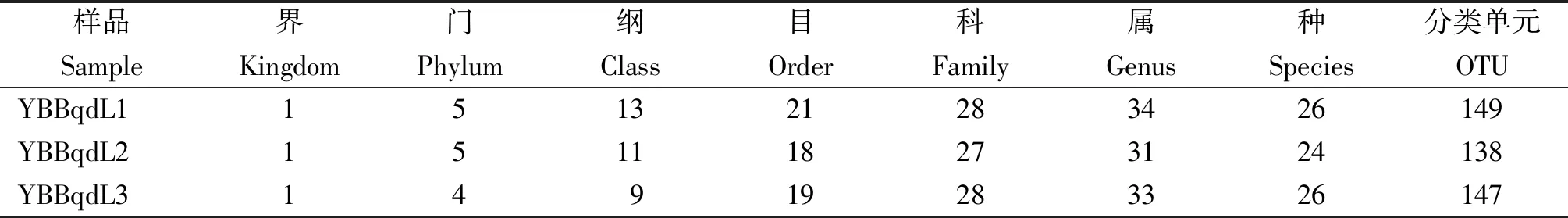
表1 感赤星病烟株叶片真菌群落不同分类水平总量

图2赤星病真菌群落Venn图分析结果
Fig.2 Venn diagram illustrating with brown spot disease of mycoflora
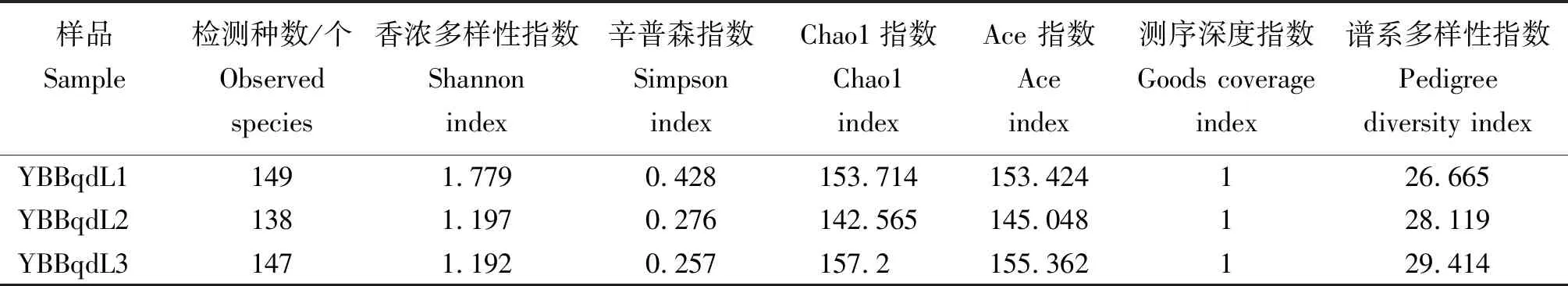
表2 不同样本真菌群落Alpha多样性指数
注:Ace和Chao指数用于表示样品中细菌群落丰富度;Shannon和Simpson指数用于表示样品中细菌群落多样性;Goods coverage指数用于表示样品测序的覆盖度,指数值越大,其相应的群落丰富度、均匀度和多样性越高〔Simpson指数采用Simpson's Index of Diversity(1-D),其计算结果和反映的趋势与Shannon指数同步〕;谱系多样性指数反应样品中物种对进化历史保存的差异,指数值越大说明物种对进化历史保存的差异越大。
2.4 真菌群落组成和结构
从图3看出,门水平上,YBBqdL1的优势菌为子囊菌门(Ascomycota 79.46%)、担子菌门(Basidiomycota 1.57%)、壶菌门(Chytridiomycota 0.01%);YBBqdL2的优势菌为子囊菌门(Ascomycota 86.93%)、担子菌门(Basidiomycota 0.20%)、壶菌门(Chytridiomycota 0.01%);YBBqdL3的优势菌为子囊菌门(Ascomycota 93.08%)、担子菌门(Basidiomycota 0.07%)。属水平上,YBBqdL1的优势菌为链格孢属(Alternaria76.04%)、茎点霉属(Phoma1.88%)、镰刀霉属(Fusarium0.43%)、Symmetrospora1.21%)、赤霉菌属(Gibberella0.29%)、Hannaell0.30%)、粉红螺旋聚孢霉(Clonostachys0.03%)、枝孢霉属(Cladosporium0.15%)、Stagonosporopsis0.05%);YBBqdL2的优势菌为链格孢属(Alternaria85.73%)、茎点霉属(Phoma0.08%)、镰刀霉属(Fusarium0.14%)、Symmetrospora0.13%)、赤霉菌属(Gibberella0.30%、Hannaell0.01%)、粉红螺旋聚孢霉(Clonostachys0.01%)、枝孢霉属(Cladosporium0.19%);YBBqdL3的优势菌为链格孢属(Alternaria87.23%)、茎点霉属(Phoma2.34%)、镰刀霉属(Fusarium1.81% 、Symmetrospora0.02%)、赤霉菌属(Gibberella0.40%)、粉红螺旋聚孢霉(Clonostachys0.24%、Plectosphaerella0.20%)、枝孢霉属(Cladosporium) 0.12% 、Stagonosporopsis0.17%)。
属水平下的相对丰度热图通过颜色的变化直观显示出各样品丰度前30属的含量情况(图4)。使用UPGMA(Unweighted PairGroup Method with Arithmetic mean)算术平均的非加权配对群聚类方法,输入Bray Curtis距离矩阵,将样品聚类结果与 各样品在门水平上的物种相对丰度一同展示。通过颜色变化直观显示各样品丰度前10的门的含量情况(图5)。热图左侧的UPGMA聚类树表明,3个样本真群落结构存在差异,因而聚集为两大类。其中YBBqdL2和YBBqdL3样品群落结构较相似聚集为一类,YBBqdL1样品聚为一类,但3个样本总体差异不大。
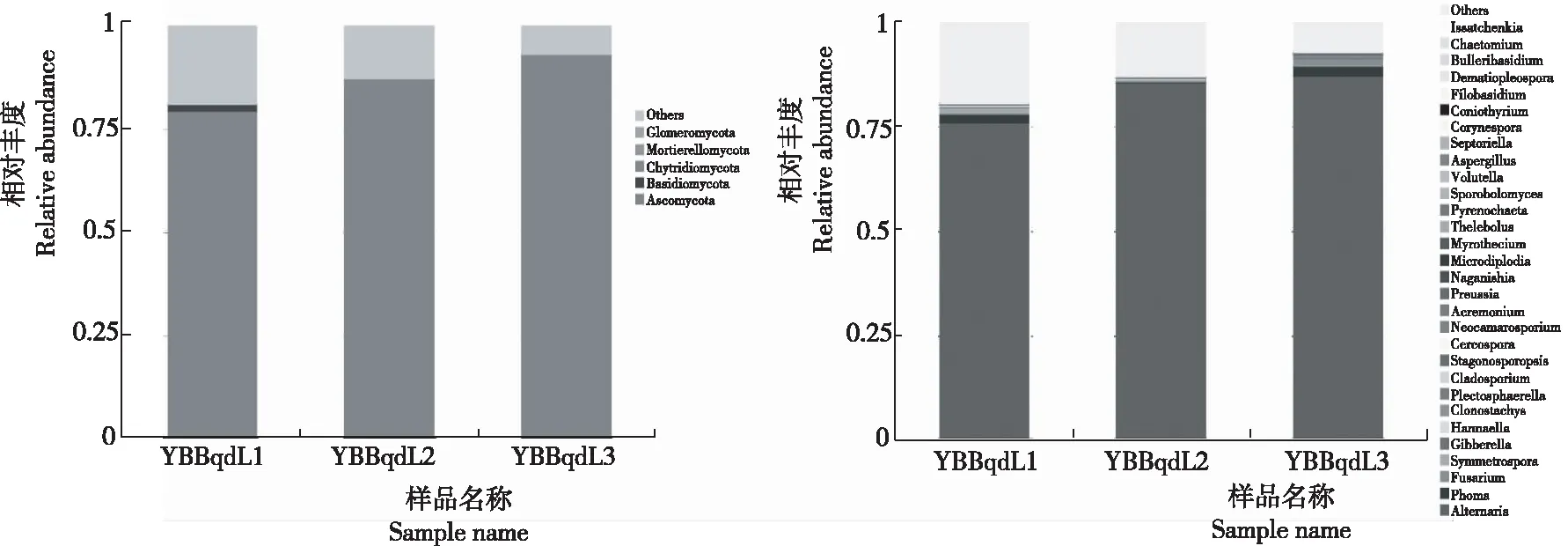
图3 不同样品门水平(左)和属水平(右)的相对丰度
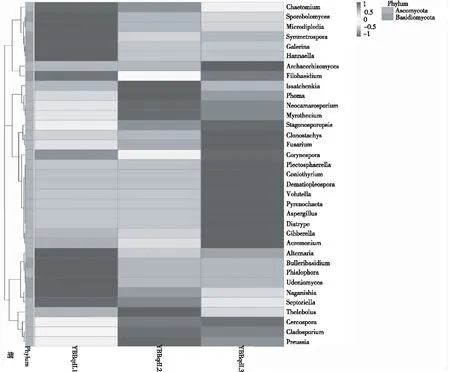
图4 属水平各个样品的相对丰度热图

图5 基于Unweighted Unifrac距离的UPGMA聚类树
3 结论与讨论
植物叶片上含有大量提供植物营养和抗病相关的微生物。近年来,叶际微生物逐渐被人们所关注,并被应用于病害防治研究[12-13]。研究运用高通量测序技术对烟草叶际真菌群落结构进行研究,3个样品测序的稀释曲线在测序深度为20 000序列数时就趋于平缓,而作者测序深度为30 000序列数。因此,可以认为测序深度已经覆盖到样品中所有的物种,测序数据量足以反映样品中的物种多样性。原始序列经优化处理后,3个样本共得到240 311条高质量序列片段,共检测到172个OTUs。研究结果证实了高通量测序技术在烟草赤星病叶际真菌群落结构和多样性上的可行性。
多年生产经验和诸多研究均证实,烟草赤星病为烟草生产中后期的主要病害,烟叶上的病斑以赤星病为主[14]。高通量测序结果发现,感病烟叶的优势病原菌为链格孢属,研究结果与烤烟生产实际一致。根据属水平上的相对丰度图还发现,烟草叶际的其他真菌如引起烟草茎点病的茎点霉属(1.43%)[3]、引起烟草枯萎病的镰刀霉属(0.79%)等,这些病原菌是否同样导致烟草中后期叶部病害以及其与优势病原菌链格孢属之间的关系还有待进一步研究。植物病原菌如枝孢霉属(Cladosporium0.15%)、赤霉菌属(Gibberella0.29%、Stagonosporopsis)[15]等是否也会引起烟草叶部病害还需相关致病力试验验证;植物内生真菌粉红螺旋聚孢霉Clonostachys(0.01%)是多种植物病原真菌重寄生真菌,被认为是已发现的拮抗微生物中最具潜力的植病生防因子之一[16],其在烟草中后期叶部病害的防控中或具有一定作用。
Ion S5XL高通量测序技术已用于烟草赤星病的叶际微生物测序分析[17],现阶段的结果有利于了解烟草赤星病的叶际真菌群落结构及多样性,为进一步研究烟草赤星病的防控奠定了基础。但测序样本数量有限,且只局限于贵州省黔东南州一个地区,今后的研究中有待进一步增加样本数量,扩大采样范围,从而使结果更具普遍性。考虑到烟草赤星病为真菌型病害,对叶际真菌群落结构及多样性的影响较大,所以仅分析了真菌群落结构及多样性,并未分析感病烟株叶际细菌群落结构与多样性,相关研究有待在下一步陆续开展。

