作为高效水氧化催化剂的多面体Cu2S块状晶体溶剂热合成
魏聪聪,钟达忠,李丹丹,王 强,郭文君,郝根彦,赵 强
(太原理工大学 精细化工研究所,气体能源高效清洁利用山西省重点实验室,太原 030024)
化石燃料储备短缺加上环境污染日益加剧迫切需要开发可再生和更清洁的能源。利用丰富的太阳能、风能等将其转换为驱动电解水制氢的能量源通过电解水转换成氢气进行能量的转化、储存和运输是目前有效的方法之一。电解水制氢过程包括两个半反应,其中析氧反应(OER)通常经历缓慢的4电子转移过程来形成O—O键,往往因为动力学不足,成为电解水过程的限速步骤。迄今为止在酸性或碱性介质中性能优异的OER催化剂是基于贵金属的氧化物,如IrO2和RuO2[1-3].RuO2在碱性条件下具有低至140 mV的过电位[4]。但是由于贵金属催化剂昂贵稀缺,在OER方面的应用受到限制,因此需要寻找一种低廉、高效、稳定性好的催化剂,以此来降低反应的过电位和电解水过程的能源消耗,达到能源的高效利用是关键。
在过去几十年里基于非贵金属Ni,Co,Fe基电催化剂在电解水中展现出优异的性能。铜作为含量丰富且价格低廉的金属和镍钴等金属比较更容易得到氧化态[5]。但是由于在电解水阳极析氧过程中容易造成阳极腐蚀,因此铜基电催化剂在催化水解中的尚未得到很好的研究。为了解决这个问题,有报道称氧化铜(CuO)具有富氧化还原性质,可以作为OER催化剂[6]。DU et al[7]报道了CuO/Cu foil纳米线在小过电位580 mV下可以达到10 mA/cm2的电流密度,但是此类催化剂的阳极析氧性能还有待提高。HAO et al[8]开发了一种Cu3P/NF纳米薄片,其电流密度为10 mA/cm2,过电压为290 mV.ZHANG et al[9]以Cu2S为前驱体经过电化学线性扫描合成了生长于泡沫铜(CF)上的三元纳米多孔硫掺杂氧化铜Cu2OxS1-x/Cu,表现出优异的全水解性能。大量研究表明,引入其他功能材料可以大大提高铜基催化剂的催化性能。XIE et al[10]从CoCO3(OH)2中开发出具有高活性面积的Cu(OH)2@CCHH(CoCO3(OH)2·nH2O)NW/CF核壳纳米线阵列,暴露更多活性位点,大大增强了OER活性。之前的研究启发寻找新的铜基电催化剂,探索提高活性的有效途径。
金属硫属化物作为优良的半导体材料,因为具有优良的电导性(快速电荷转移能力)和抗酸/碱性电解液腐蚀的能力,最初应用于析氢反应(HER),为了挖掘其潜在的双功能特性,这些材料逐渐在OER方面发挥作用,传统的碱性电解液阳极析氧催化剂过渡金属硫化物(TC,T=Ni,Co,Cu,Fe;C=S,Se,Te)在OER中通常表现出较强的催化性能,被报道的一般在10 mA/cm2的电流密度下,过电位在200~300 mV的范围内[11-15]。近年来,许多物理和化学合成技术广泛应用于合成具有可控形貌、尺寸、组成和结构的新型过渡金属硫化物纳米材料中,合成过渡金属硫化物常用合成方法包括热注入法、溶剂热法、混合溶剂热法、超声法等。其中,溶剂热法可较容易的控制催化剂的尺寸和形貌,选择一种合适的溶剂往往可用作形貌控制器。在混合溶剂热法中,溶剂往往由两种及以上组分组成,通过调节组分比例,可以控制催化剂的生长。当有机胺存在时,就可以很容易地控制产品的成核和生长过程,并能协助晶体各向异性生长[16]。LIU et al[17]以氯化铜和尿素为前驱体,在90~110 ℃下一步合成CuS,在胺的调控下,当把三亚乙基二胺(TEDA)和二丁胺(DBA)作为连接媒介时,可以分别合成纳米线、纳米管和纳米囊泡结构。溶剂的pH值、反应温度等因素对催化剂的结构尺寸也起着至关重要的作用。混合溶剂热法具有时间短,结晶度高的优势因此被广泛的应用。
本文以泡沫铜(CF)和硫代乙酰胺(TAA)为铜源和硫源,采用混合溶剂法制备得到结晶性良好的十四面体Cu2S催化剂。通过调节溶剂乙醇胺与乙醇的比例,较为容易地控制产品的成核和生长过程,对Cu2S结构的完整性和尺寸大小起着至关重要的作用。Cu2S负载到泡沫铜上作为阳极析氧催化剂在电化学性能测试中表现出优异的电化学活性和稳定性,并用X射线粉末衍射(XRD),能量分散光谱(EDS),X射线光电子能谱(XPS),对催化剂进行结构、形貌和相组成的表征。
1 实验
1.1 试剂
泡沫铜(CF,电池级,山西动力电池材料有限公司),乙醇胺(ETA,分析纯,天津市申泰化学试剂有限公司),无水乙醇(ET,分析纯,国药集团化学试剂有限公司),硫代乙酰胺(TAA,分析纯,国药集团化学试剂有限公司),超纯水(≥18 MΩ/cm,太原理工大学煤化工研究所),浓盐酸(HCl,质量分数为36%,永飞化学试剂有限公司),丙酮(分析纯,天津风船化学试剂科技有限公司)。实验过程所使用的超纯水由GWA-UN1-10C型超纯水器制备,其他试剂均为分析纯,且在使用前均未进一步纯化。
1.2 泡沫铜基底的制备
采用泡沫铜(CF)为制备电极的基底。实验前需要预处理泡沫铜,首先将大块的泡沫铜(120 mm×120 mm,厚度0.5 mm)裁剪成实验条件所需的尺寸(20 mm×30 mm),然后置于丙酮中进行10 min超声清洗,再分别用浓度为2 mmol/L的HCl、乙醇、超纯水分别超声清洗10 min,烘干备用。
1.3 RuO2负载电极的制备
在0.5 mL(Vethanol∶VH2O=1∶4)的混合溶液中加入1 mg商用RuO2和10 μL质量分数5% Nafion溶液,在超声作用下约1 h形成均匀墨汁状液体。然后,将墨汁状液体点涂到CF基底上。催化剂质量负载约1 mg/cm2).在室温下自然干燥待用。
1.4 多面体Cu2S块状晶体的合成
采用溶剂热的方法在自压反应釜中合成Cu2S,首先将0.24 g的硫代乙酰胺(TAA)溶解在16 mL乙醇胺和乙醇Ven∶Vet=1∶7的溶液中,配置好的溶液搅拌均匀后将其转入反应釜中。取干净的泡沫铜浸没到反应釜的中央,并密封,将其在180 ℃下反应6 h,反应结束后,取出负载了催化剂的泡沫铜基底,用乙醇和超纯水冲洗数次,在60 ℃烘箱中干燥待用,图1是实验的反应示意图。
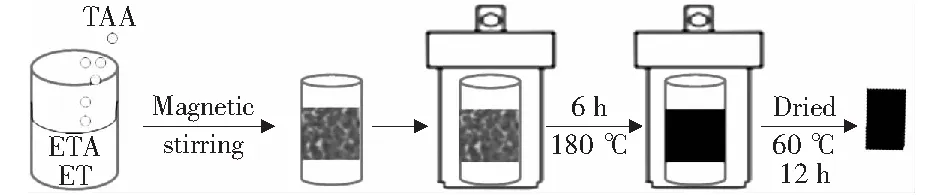
图1 催化剂合成过程示意图Fig.1 Schematic illustration of the synthesis process of catalyst
1.5 样品的分析和电化学性能测试
采用D8 Bruker型X射线粉末衍射仪(X-ray diffraction,XRD)进行物相分析。测试条件为:Cu-Kα (λ=0.154 18 nm),工作电压40 kV,工作电流40 mA,步长0.02°,扫描速度8 (°)/min.
扫描电镜(scanning electron microscopy,SEM)图谱和X射线能谱(energy-dispersive X-ray,EDS)采用日本Hitachi SU8010型扫描电子显微镜和Horiba X-MAX 50能散X射线能谱分析仪测定。操作电压:1~3 kV的加速电压下得到SEM照片;15~25 kV的加速电压下得到EDS能谱。
利用X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)对催化剂表面元素的价态等进行了分析。采用WSCAL-ab220i-XL(VG Scientific,Sussex,UK)型X射线光电子能谱仪进行测定,测试条件:Al靶,Kα射线,扫描范围:0~1 000 eV.
本实验以电化学工作站(PARSTAT MC,Princeton,USA)为测试仪器,利用三电极体系来进行测试,以铂柱电极为对电极、Hg/HgO电极为参比电极、Cu2S/CF电极为工作电极。性能测试环境条件为常温常压,电解液的搅拌速度为50 r/min.电催化析氧测试是在1 mmol/L KOH溶液中进行,在1 mmol/L KOH溶液中进行循环伏安法(CV)测试,扫描速率为0.05 V/s,电位范围为0~1 V,直到得到稳定的CV曲线。采用线性扫描伏安法(LSV)测量过电位,扫描速率为2 mV/s,过电位公式η=Vapl+pH×0.059-1.23-IR.
2 结果与讨论
以CF和硫代乙酰胺(TAA)分别作为铜源和硫源,乙醇胺(EDA)为络合剂,乙醇为溶剂,通过溶剂热法制备了负载于泡沫铜上的多面体Cu2S晶体,并考察反应温度、反应时间、乙醇胺与乙醇的体积比等条件对催化剂活性的影响。表1分别为实验的变量和参数,电化学性能测试结果表明(图2),当反应温度为180 ℃,反应时间为6 h,Ven∶Vet=2∶14时所制备的十四面体Cu2S催化剂性能最佳。
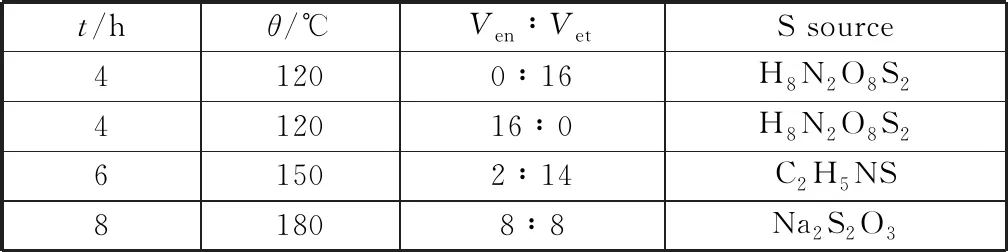
表1 实验参数Table 1 Experimental parameters
在醇溶液中乙醇胺(en)发生水解呈碱性,具有较强的配位能力,可在反应体系中激活铜基体表面和电子转移[18-20]。由于胺分子的还原性与铜离子形成配合络合物。形成的[Cu(en)2]2+金属络合物与溶液中的 S2-反应形成不稳定的无机-有机Cu2S-TAA前驱体,其可作为分子模板控制晶体的生长[18,21-23]。同时由于溶液呈碱性,会形成一部分Cu(OH)2,最后在体系S2-释放充分的情况下,最终会得到稳定的Cu2S.当硫代乙酰胺在上述碱性条件下,发生水解产生的S2-与铜离子作用反应完全时,泡沫铜变为黑色,最终得到以泡沫铜为基底负载有Cu2S的催化剂此反应历程包括两个反应方程式:
HO(CH2)2NH2+H2O=HO(CH2)2OH+NH3.
2.1 Ven∶Vet对Cu2S多面体的形貌和尺寸的影响
当反应时间为6 h,反应温度为180 ℃时,取0.24 g的硫代乙酰胺,考察乙醇胺与乙醇的体积比
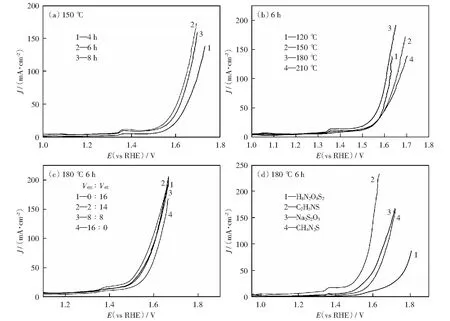
图2 不同反应时间、反应温度、乙醇胺与乙醇的体积比、S源得到的Cu2S的极化曲线图Fig.2 LSV curves of Cu2S obtained with different reaction times,temperature,volume ratios of ethanolamine to ethanol,S source
对电催化性能的影响。乙醇胺在乙醇溶液中水解后显碱性,相应的pH值会影响溶液中的无机盐和阴离子的水解率(如硫代乙酰胺)[24]。同时由于有机胺分子存在[25-26],不仅可调控催化剂的形貌,也可协助晶体各向异性生长,并可以嵌入到金属硫化物(MC)结构中,形成MC-胺-无机-有机络合物[27]。溶液只有乙醇没有乙二胺时(如图3(a)),溶剂极性减小,影响产物的聚集生长和晶体的取向生长,最终形成不规则的类球形颗粒。当加入乙醇胺时,由于形成了铜胺络合物,溶液中自由铜离子浓度较小,体系中产生的Cu2S的速度较为缓慢,有利于各向异性生长;随着乙醇胺浓度增加体系碱性增强,体系内的硫源不断水解,S2-与铜离子快速结合形成无规则Cu2S晶粒,同时高过饱和度破坏了晶体的极性生长环境,生成大量的无规则的Cu2S晶体[23-24,28]。但乙醇胺比例太高时,过多的乙醇胺又会阻碍晶体多面体的生长[29]。当Ven∶Vet=2∶14时,晶体具备完整的多面体结构,样品结晶度较高,催化剂的颗粒尺寸较小、表面积较大,因而Cu2S催化剂的电催化活性较好。

图3 不同的乙醇胺与乙醇体积比下得到的Cu2S SEM图Fig.3 Low magnification SEM images of Cu2S obtained with different volume ratios of ethanolamine to ethanol
图2(c)为不同体积比下的乙醇胺与乙醇所得Cu2S的阳极析氧反应极化曲线图。如图所示,在前面探索的设定实验条件下,改变Ven∶Vet的比例,在20 mA/cm2的电流密度下得到不同的过电位,表2显示的结果表明,当Ven∶Vet=2∶14时,催化剂表现出最小的过电位,催化活性最高。
2.2 Cu2S的XRD分析
以硫代乙酰胺为硫源,当Ven∶Vet=2∶14,并在180 ℃下反应6 h后,得到多面体的Cu2S催化剂,对此催化剂进行物相分析,从XRD图(图4)中可以看出催化剂为纯相结构的辉铜矿Cu2S,其峰位置与标准卡(JCPDS no.23-961)完全吻合,没有其他杂质峰出现,峰型尖锐、对称,表明催化剂的结晶度较高[30]。
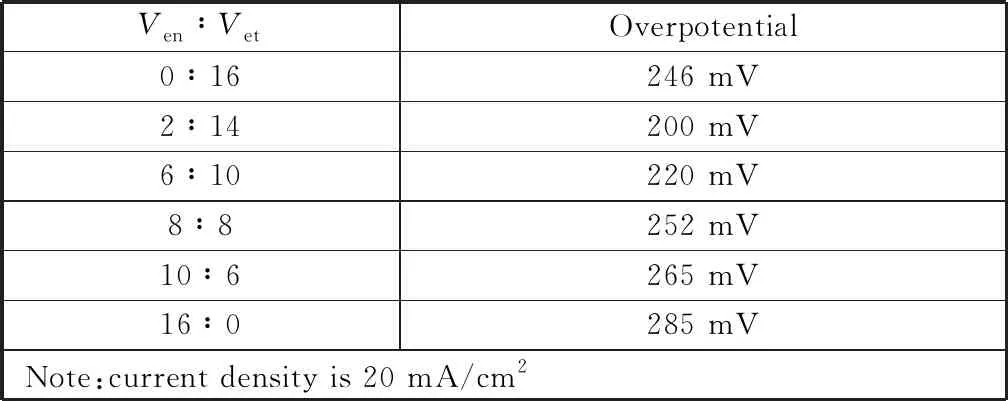
表2 不同体积比的乙醇胺与乙醇下催化剂在1 mmol/L KOH溶液中的OER活性比较Table 2 Comparison of OER catalyst in 1 mmol/L KOH with different volume ratios of ethanolamine to ethanol
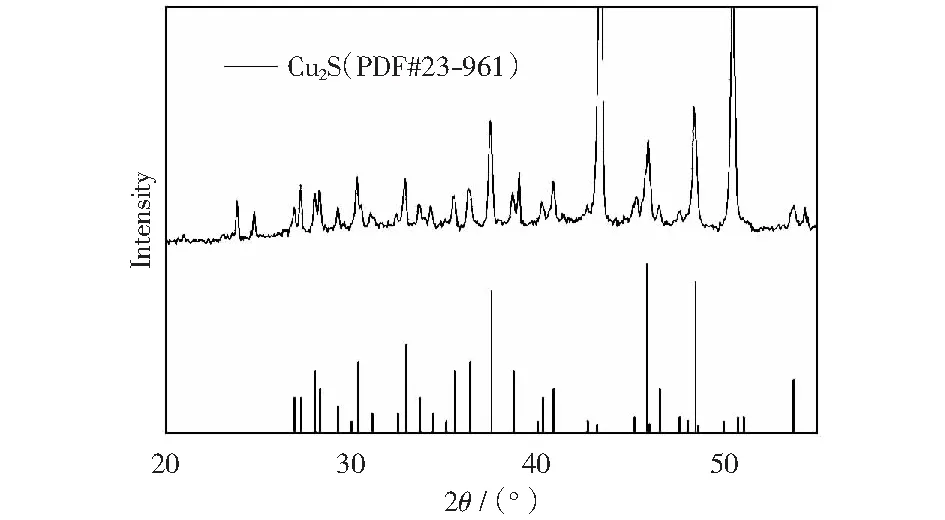
反应条件:以硫代乙酰胺为硫源,Ven∶Vet=2∶14,在180 ℃下反应6 h图4 多面体的Cu2S催化剂的XRD图Fig.4 XRD of Cu2S catalyst was obtained with thioacetamide as the sulfur source
2.3 Cu2S的XPS分析
为了进一步确定催化剂的元素价态,对催化剂进行XPS测试,分析结果如图5所示。Cu 2p的能谱图显示:在934.9 eV和955 eV结合能处的峰位置分别为Cu 2p3/2和Cu 2p1/2,表明Cu2+离子的存在[27];在944 eV和963 eV处为CuO的小卫星峰。图2(a)上Cu 2p轨道结合能谱,932.85 eV和952.7 eV的两个主峰对应的是Cu+2p3/2和Cu+2p1/2的结合能,与之前报道的文献[31-32]一致。二价铜的出现是由于催化剂表面暴露在空气中被氧化。对于图2(b)S 2p谱,在161.9 eV和 163.1 eV结合能处显示了两个强峰,证明了S2-的存在即硫化物的形成[32-33],由此进一步确定了Cu2S催化剂的形成。
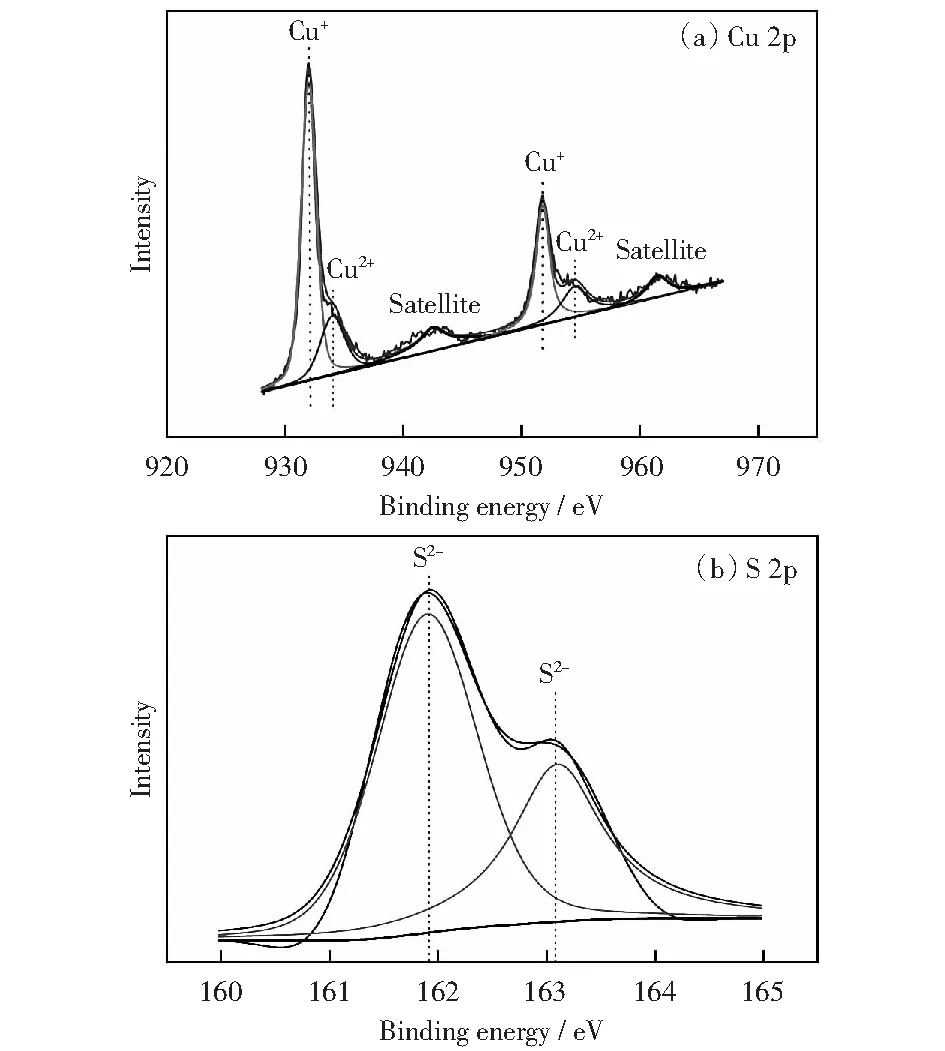
图5 催化剂Cu2S的XPS谱图Fig.5 High-resolution XPS spectra
3 Cu2S多面体的阳极析氧性能分析
3.1 催化剂的电催化性能测试
将得到的催化剂在1 mmol/L KOH碱性电解液中进行电化学性能测试,催化剂在经过多圈CV后被激活,然后采用线性扫描伏安法(LSV)测试催化剂的电化学性能。在同样的体系下分别对空白的泡沫铜利用滴涂法制备的RuO2/CF和在最佳实验条件下得到的Cu2S多面体催化剂进行电化学性能的比较。如图6(a)为三者的LSV曲线,可以明显的观察到,在电流密度为20 mA/cm2时,Cu2S 催化剂的过电位只有200 mV,Cu2S催化剂具有优于贵金属氧化物RuO2(过电位为306 mV)的OER性能,对比已报道的过渡金属阳极析氧催化剂表现出较好的电化学性能(表3是近年来所报道的阳极析氧催化剂的性能对比)[2,6,8,13,34-39],并且催化剂的稳定性是衡量其电化学性能的重要因素,在不同的外加电压下,分别得到Cu2S在10 mA/cm2和30 mA/cm2的电流密度下的计时电流曲线如图6(b)所示,催化剂可以保持至少30 h的稳定性。
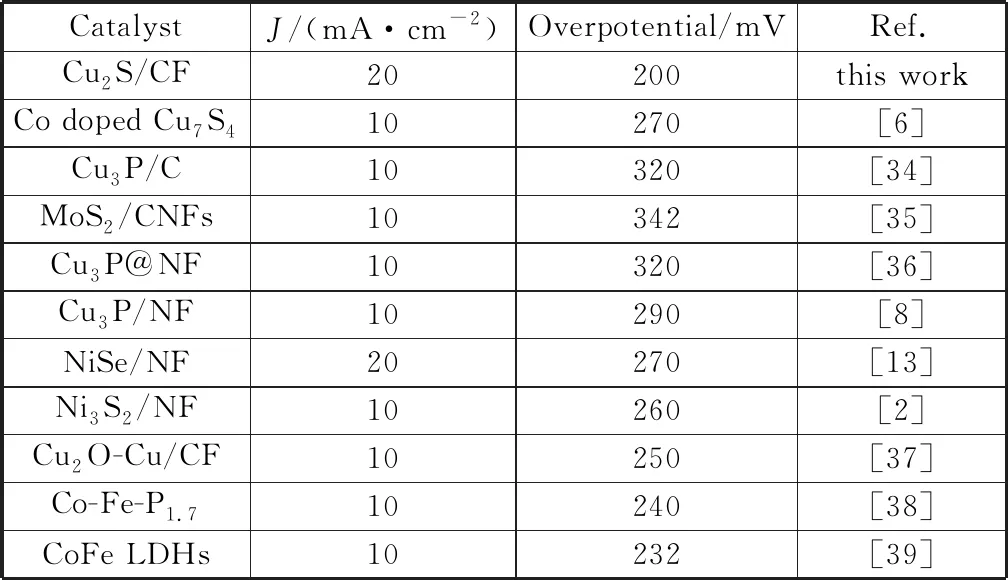
表3 报道的OER催化剂在1 mmol/L KOH溶液中的活性比较Table 3 Report on the activity comparison of OER catalyst in 1 mmol/L KOH
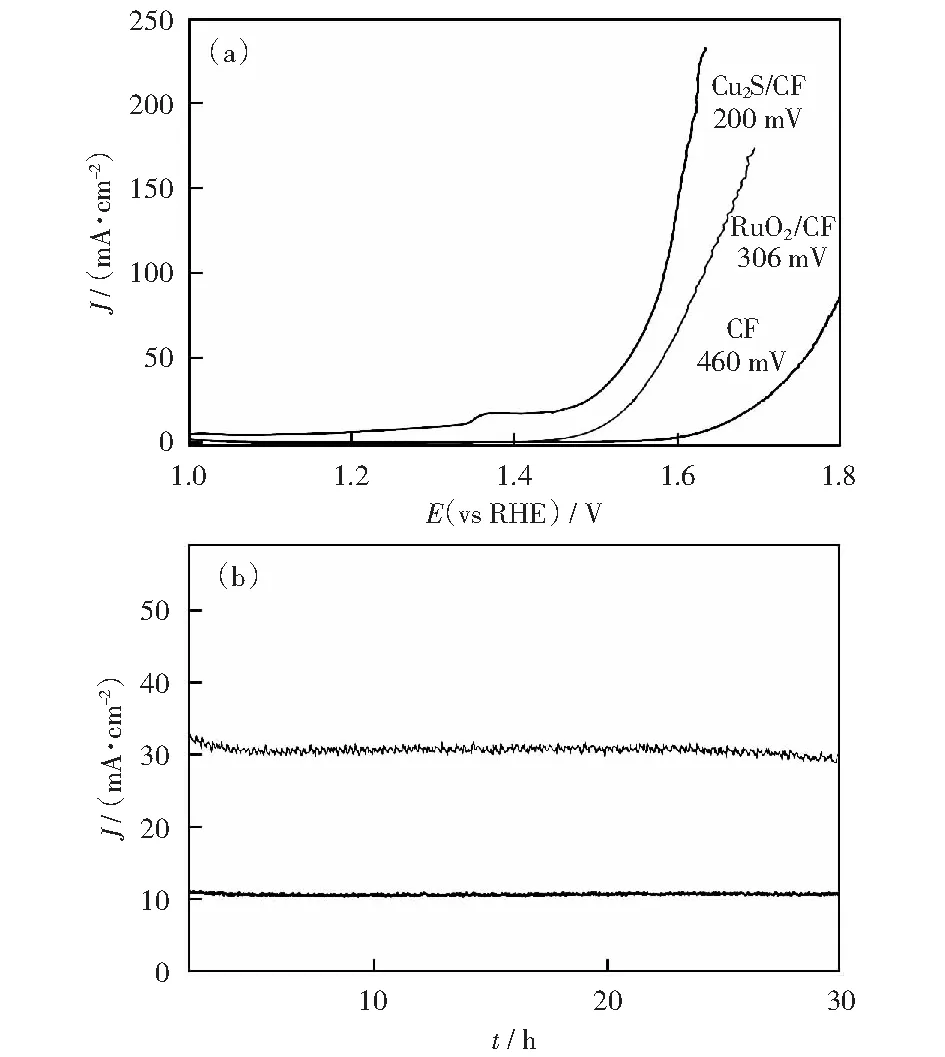
(a) 1 mmol/L KOH中空白CF,RuO2/CF和Cu2S/CF的极化曲线,扫描速率为2 mV/s;(b) Cu2S/CF在10 mA/cm2和30 mA/cm2恒电流密度下的长期稳定性试验图6 催化剂的电化学性能Fig.6 Electrochemical performance of the catalysts
3.2 Cu2S多面体催化剂OER测试前后元素组成与形貌分析
电解水OER催化剂开始于金属氧化物,氧化物是OER中真正起催化作用的物质,后来发展的过渡金属硫化物最开始应用于HER.研究者发现其在OER过程中部分或完全转化为氧化物,比过渡金属氧化物具有更好的阳极析氧性能。XU et al[40]在2016年合成了镍铁二硒化物(NixFe1-xSe2),它原位转化为氧化物时,在10 mA/cm2的电流密度下的过电位仅有195 mV.这种NixFe1-xSe2衍生催化剂的高活性主要是由于其理想的纳米结构。
对多面体Cu2S催化剂OER前后的物质组成和晶体结构进行分析,探究其电化学阳极析氧过程。通过EDS能谱图和元素映射图(见图7),考察催化剂在OER前后元素及其含量的变化,通过对比发现,S元素存在流失现象,同时O元素有明显增多。对于OER测试后的物质组成与元素分析通过XPS分析(见图8).S 2p的峰在OER测试之后几乎消失,O 1s谱图中显示的主峰值531.6 eV,代表Cu—O;530.2 eV的峰归因于CuO的晶格氧[33]。Cu 2p的峰由原来代表Cu2S中两对2p3/2Cu+和2p1/2Cu2+的峰变为了CuO的峰,峰值出现在933.6 eV和 953.6 eV的结合能处其归因于Cu 2p3/2和Cu 2p1/2,它是CuO形式的Cu2+.同时XRD分析(图8(d))也表明Cu2S相消失,CuO相形成。
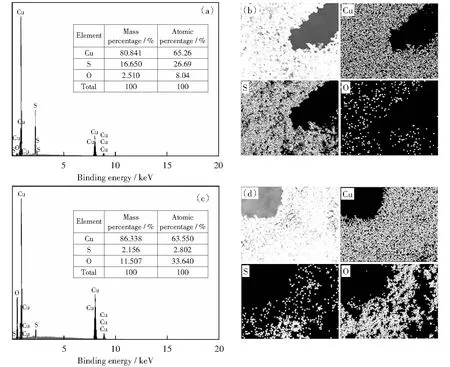
图7 OER前后催化剂的EDS谱图和对应的元素的映射图像Fig.7 EDS and corresponding Elemental mapping images before and after OER. The inset in the spectra shows the elemental atomic percentages.(a,b) the as prepared Cu2S/CF,(c, d) Cu2S/CF after OER
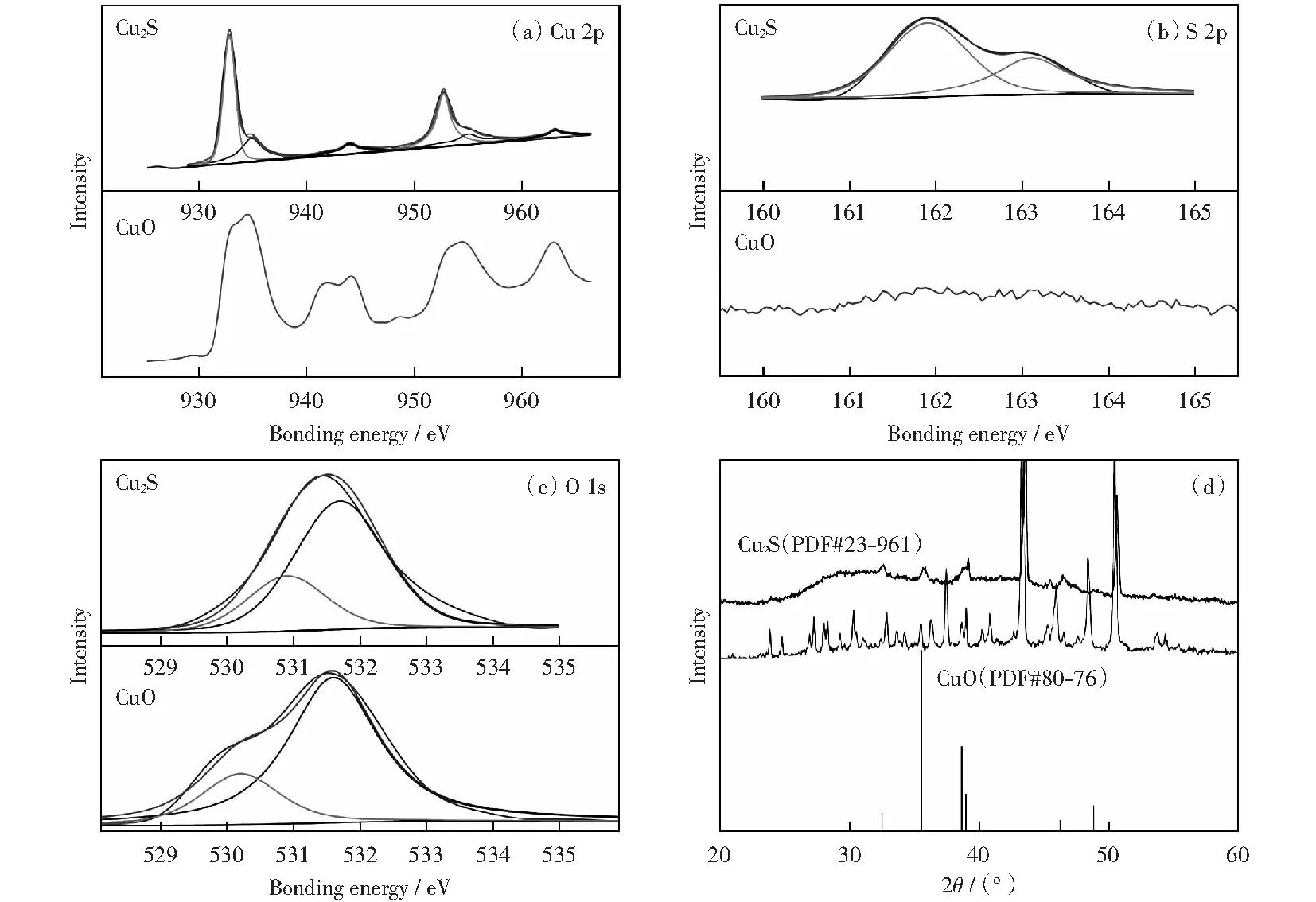
图8 Cu2S OER反应前后比较Cu 2p,S 2p,O 1s的XPS谱及XRD图Fig.8 Comparison of Cu2S before and after OER, High-resolution XPS spectra of Cu 2p, S 2p, O 1s and XRD patterns

图9 负载于泡沫铜上的Cu2S催化剂OER前后的SEM图形貌Fig.9 SEM images of structual characterization of catalysts Cu2S loaded on copper foam before and after OER
对催化剂在1 mmol/L KOH 中OER测试前后的形貌进行了对比,测试前的Cu2S催化剂为由两个六边形的面和六对梯形面组成的十四面体形貌(如图9(a)(b)).晶块的尺寸以上下2个六边形的两点最长距离为基准,平均晶体直径大约为6 μm.在对催化剂进行活化时,更有利于其转化为活性物质。通过Cu2S OER测试前后形貌的对比发现,Cu2S十四面体变的粗糙,经过电化学氧化过程出现分层,像是花团锦簇的花环,催化剂的比表面积进一步增大见图9(c)(d).显然活化后的催化剂具有更优的形貌,暴露更多的活性位点,电荷转移速率加快,促进了电解水阳极析氧反应。
4 结论
本实验主要通过液相合成法通过调节反应体系中各个反应参数探索反应温度、反应时间、乙醇胺与乙醇的体积比等对催化剂活性的影响,最终得到以硫代乙酰胺为硫源,当Ven∶Vet=2∶14,在180 ℃下反应6 h,得到十四面体的Cu2S催化剂具有最好的析氧活性。在探索过程中得到以下结论:
1) 在电流密度为20 mA/cm2时,Cu2S催化剂的过电位只有200 mV,对比已报道过的过渡金属阳极析氧催化剂表现出更优的电化学性能。
2) 调节乙醇胺与乙醇的比例,对Cu2S结构的完整性和尺寸大小起至关重要的作用。
3) 反应的温度和溶液的pH值会影响无机盐和阴离子的水解率(如硫脲和硫代乙酰胺),从而影响其晶体结构中固有的各向异性特征,导致晶体的定向生长。

