基于TMPyP卟啉与SDS组装体的铜离子荧光传感
闫伦丽,张国梅
(山西大学 化学化工学院,山西 太原 030006)
0 引言
目前发现的过渡金属中,生物体对于铜离子(Cu2+)的需求接近于锌离子(Zn2+)和铁离子(Fe3+)。铜离子(Cu2+)不仅仅是生物体一种必需的微量元素,还是生物体中氧化酶所必需的元素,在生物体的新陈代谢和繁衍过程中起着至关重要的作用[1-2]。生物体内铜离子的浓度偏高或偏低都有可能会产生不良的生理反应[3]。当生物体内铜离子含量较低时,会使得人体内造血功能及酶活性下降,很可能导致贫血、浮肿和骨骼疾病,从而引发风湿性关节炎、心脏病等较为严重的疾病;一般而言重金属对生物体具有一定的毒性,当铜离子摄入超标又会导致生物体中毒,降低免疫力,甚至对生物体生命系统构成很大的威胁[4]。铜离子在细胞内以辅基形式参与人体许多重要的代谢途径,例如辅助超氧化物歧化酶消除细胞自由基,在细胞色素C氧化酶中传递电子,帮助人体对铁的吸收,促进血红素的形成,提高生命力等等,因此它在人体许多的生理过程中起到了十分重要的作用[5]。值得注意的是,铜离子更是水体中的一种重金属污染物,如果将含大量铜离子的工厂废水及生活污水直接排放到地下水中,将会严重污染地下水从而对人类安全和生命造成威胁[6-7]。因此,精准地对水溶液中铜含量的定量检测吸引了众多科学研究者们的高度关注,成为环境改善及生物分析中的首要课题之一。近几年,设计了一些用于检测铜离子的荧光传感器[8-10], 例如碳量子点、纳米复合材料[8]和电化学传感[10]等,但是这些方法的成本高,合成步骤复杂,有的还须在有机溶剂中进行合成及检测。因此,在水溶液中寻找灵敏度高、选择性好并快速测定铜离子的方法尤为重要。
卟啉,亦可称紫质,是由次甲基桥连接四个吡咯类亚基的α-碳原子而成的18电子大π共轭体系的杂环化合物[11-12]。常见的金属卟啉如血红素、叶绿素,是自然界中能够活化二氧化碳的一种生物催化剂,广泛存在于动植物体中,对动植物生理过程和生命活动起着至关重要的作用[13-14]。此外,卟啉也可作为一种有机染料分子[15-18],在化学修饰中具有灵活可调的芳香结构、良好的生物相容性、独特的光化学活性、高稳定性和高可见光吸收率等优良特性,在输送氧气、植物光合作用、生物催化和污染物光降解等生物过程中发挥着重要作用,所以近年来卟啉及其化合物被诸多科学研究们作为研究对象。
本文研究了TMPyP和SDS水溶液组装体系中加入铜离子后荧光强度的变化。研究表明,该体系对铜离子具有选择性识别作用,铜离子对TMPyP-SDS组装体系的荧光具有显著的猝灭作用,从而建立了对Cu2+具有选择性识别能力的荧光传感体系。
1 实验部分
1.1 仪器和试剂
仪器:中国上海第二仪器厂pHs-2型酸度计;北京普析通用仪器有限公司TU-1901紫外可见分光光度计;日本日立公司日立F-4500型荧光分光光度计。
试剂:甲基吡啶基卟啉(TMPyP)是从Sigma公司购买的产品;十二烷基硫酸钠(SDS)在上海第三试剂厂购买所得;金属无机盐(主要是硝酸盐);所有试剂均为分析纯试剂。溶液酸度由0.1 mol/L Tris(三羟甲基氨基甲烷)-HCl缓冲溶液控制,实验室用水为二次蒸馏水。
1.2 实验方法
首先将SDS水溶液(0.01 mol/L)、TMPyP储备液(0.1 mL,1×10-5mol/L)及一定体积的待测金属离子依次加入到10.0 mL玻璃比色管中,用二次蒸馏水将混合溶液定容、摇匀。然后在室温下静置30 min,移取1 mL混合溶液转入石英比色皿中,在F-4500荧光仪上测定混合溶液的荧光强度。固定激发和发射狭缝均为10 nm,激发波长为426 nm。
2 结果与讨论
2.1 TMPyP与SDS溶液的组装作用
通过上述的方法在荧光仪上扫TMPyP-SDS水体系作用的发射光谱,扫描结果如图1所示。从图1可以明显观察到固定激发波长为426 nm时,水溶液中TMPyP在655 nm处产生相对较弱的荧光,随着不同浓度SDS的加入,水溶液中TMPyP的荧光强度也随之发生改变, 因此可以说明形成的SDS胶束诱导TMPyP在水溶液中产生强的荧光发射。这是由于形成的表面活性剂(SDS)胶束为处于激发态的TMPyP分子提供了一个刚性的微环境,SDS分子改变了卟啉(TMPyP)分子的聚集状态,抑制了溶液中溶解的氧分子对TMPyP的猝灭,减弱了其聚集诱导荧光猝灭(ACQ)效应。随着SDS浓度不断增加体系的荧光强度呈现出逐渐升高后趋于稳定状态,进一步的说明了随着SDS浓度的改变,SDS的胶束结构在一定程度上也产生改变,导致TMPyP激发态分子所处的微环境产生改变,从而引起了荧光强度也发生改变。实验研究表明:SDS最适宜的浓度应选择为0.001 mol/L,这时组装体系的荧光强度可达到最大。
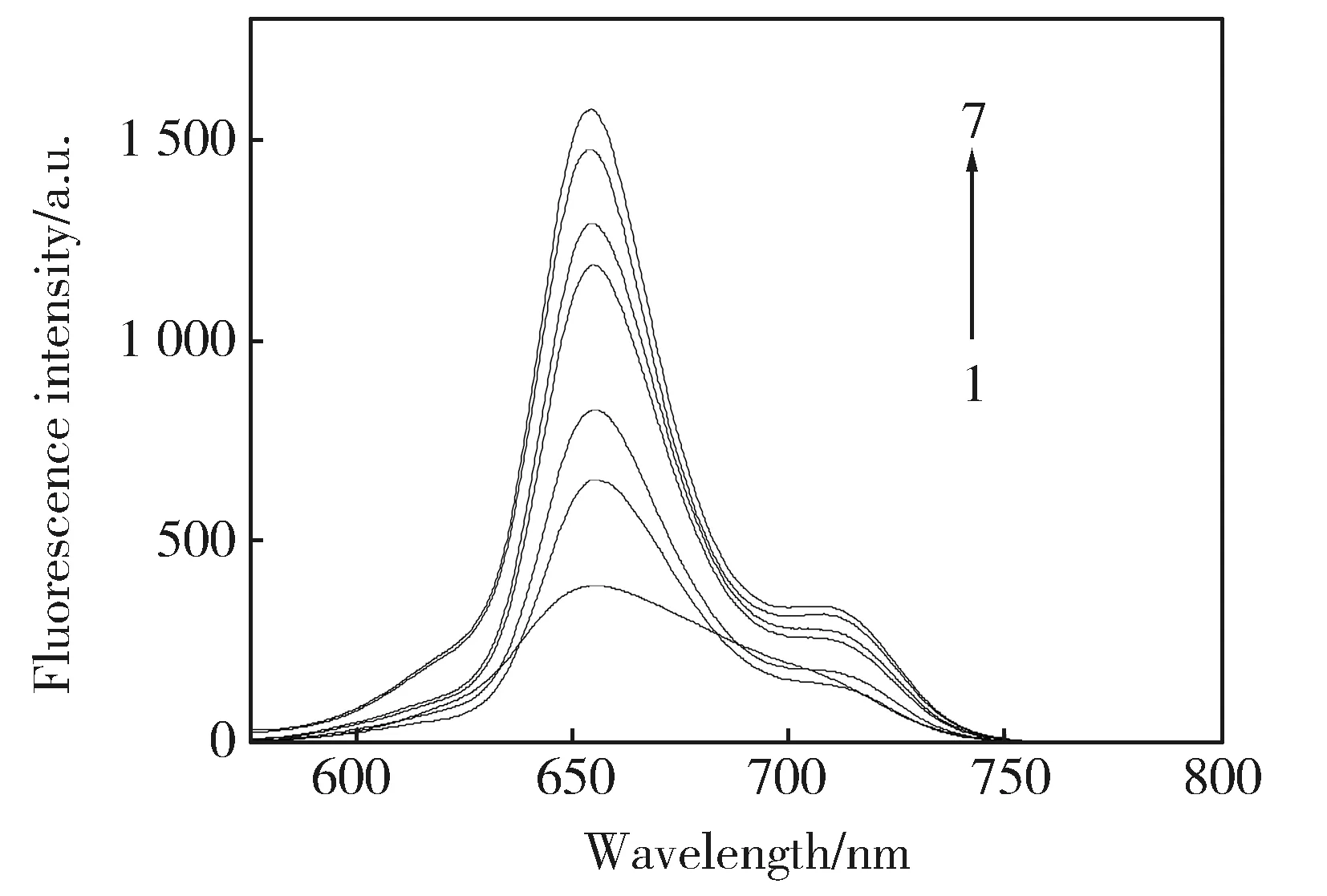
Fig.1 Fluorescence spectra of TMPyP in different concentrations of SDS solutions (pH=8.0)[SDS](10-3M) (1)-(7):0; 0.05; 0.1; 0.15; 0.4; 0.8; 1.0.图1 pH=8.0时TMPyP与不同浓度的SDS组装作用的荧光光谱图
为了探索TMPyP与SDS溶液的组装作用,进行上述实验。实验结果也表明TMPyP与SDS之间进行了快速的组装,TMPyP-SDS的组装机理是TMPyP为带正电的小分子,SDS是带负电荷,TMPyP和SDS之间通过静电相互作用进行组装。
2.2 TMPyP与Cu2+的相互作用
图2(A)所示是在pH=8.0时TMPyP与Cu2+相互作用的紫外吸收光谱图。由谱图上可明显看出,当pH=8.0时TMPyP在426 nm和440 nm处出现两个吸收峰,随着Cu2+浓度的增加,TMPyP在426 nm处吸收峰逐渐增强,而440 nm处吸收峰逐渐降低,证明Cu2+与TMPyP发生了显著的相互作用。图2(B)插图所示是在pH=8.0时TMPyP与其他金属阳离子相互作用的紫外吸收光谱图,从图中可以看出,TMPyP与Cu2+和本文所选其他金属阳离子的相互作用现象有显著不同,其他金属阳离子在426 nm处吸收峰几乎没有发生变化,而在440 nm处吸收峰也只有略微的下降,说明TMPyP与其他金属离子基本不发生相互作用,只对Cu2+有选择性识别。
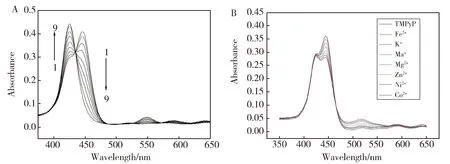
Fig.2 (A)Absorption spectra of interaction of TMPyP with Cu2+[Cu2+](10-3 mol/L):(1)-(9): 0; 0.05; 0.15; 0.3; 0.5; 0.75; 1.0; 1.25. (pH=8.0);(B) Absorption spectra of interaction of TMPyP with various metal ions[Mn+](10-1 mol/L) (pH=8.0).图2 (A)pH=8.0时TMPyP与Cu2+相互作用的吸收光谱图;(B)pH=8.0时TMPyP与其他金属离子相互作用的吸收光谱图
2.3 TMPyP-SDS组装体与Cu2+的作用
图3(A)所示的是在pH=8.0时,TMPyP-SDS组装体系与Cu2+之间相互作用的荧光图。在TMPyP和一定浓度的SDS溶液形成相对稳定的组装体系条件下,固定激发波长为426 nm,向TMPyP-SDS组装体系中加入不同浓度的铜离子。由图可看出,随着Cu2+浓度的增加,TMPyP-SDS组装体系在655 nm处的荧光强度逐渐降低,且二者在一定的范围内成良好的线性关系。这是定量测定铜离子(Cu2+)的基础。图3(B)所示为Cu2+对TMPyP-SDS组装体系的荧光猝灭进行拟合后的标准曲线以及相关系数,Cu2+对TMPyP-SDS组装体系的荧光猝灭符合Stern-Volmer方程。以X=[Cu2+]对Y=I0/I(I0、I分别为TMPyP-SDS组装体系中加入Cu2+前后的荧光强度)作图得到良好的线性关系,线性相关系数R2=0.999。从图3(B)可以看出,线性范围为5.2×10-6~ 3.3×10-4mol/L。同时根据空白标准偏差的3倍计算得检出限为7.63×10-7mol/L。
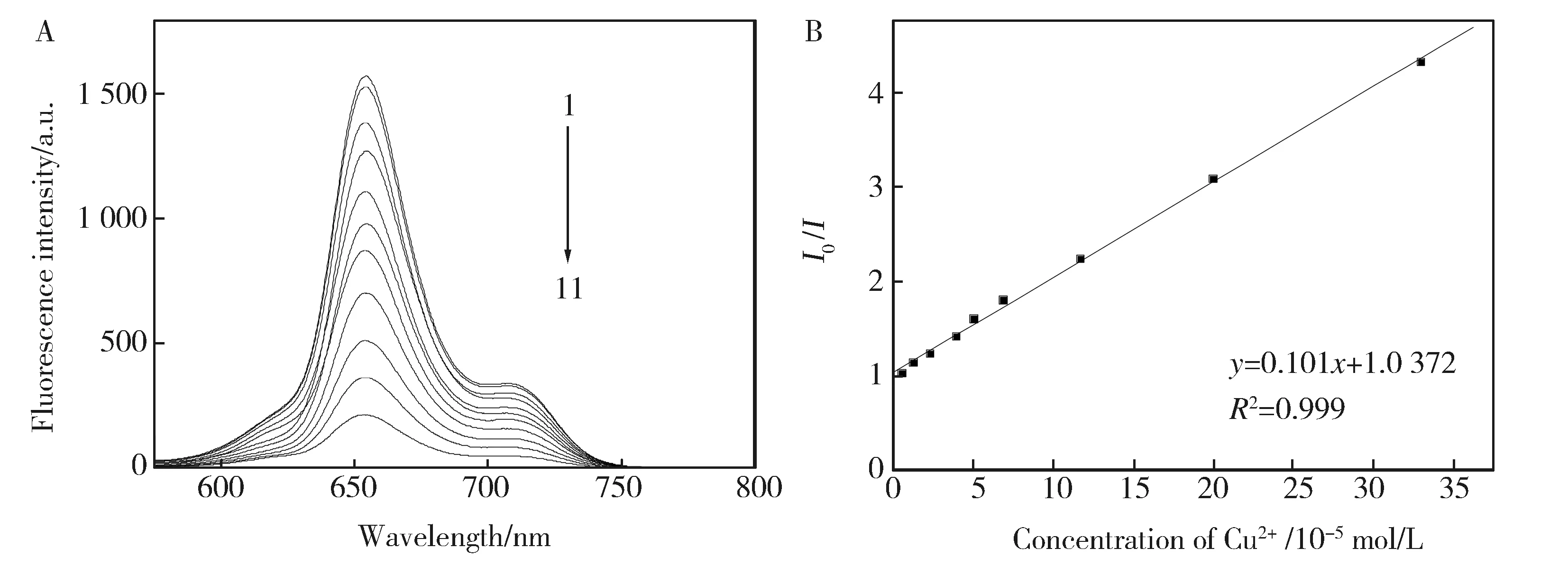
Fig.3 (A)Fluorescence of spectra of the interaction of TMPyP-SDS assembly system withCu2+, ([Cu2+](10-4 mol/L):(1-11):0; 0.014 3; 0.028 6; 0.57; 0.12; 0.24; 0.48; 0.86; 1.43; 2.15; 7.5);(B) Plot of fluorescence quenching of TMPyP-SDS assembly system by Cu2+图3(A) pH=8.0时TMPyP-SDS组装体系与Cu2+作用的荧光光谱图;(B)Cu2+ 对TMPyP-SDS组装体系的荧光碎灭的线性关系图和相关系数
2.4 TMPyP-SDS组装体系选择性测定铜离子(Cu2+)
2.4.1 金属阳离子对TMPyP-SDS组装体系荧光强度的影响
为了进一步探索TMPyP-SDS组装体对Cu2+的专一性识别,本文考察了其他金属离子对TMPyP-SDS组装体系荧光强度的响应程度。由图4可看出,本文所选其他金属离子对TMPyP-SDS组装体系均有略微的淬灭效应,但相比较而言Cu2+对TMPyP-SDS组装体系的淬灭效果尤为显著。Cu2+(120 μmol/L)即可使组装体系的荧光基本淬灭(90%),而相同浓度的大部分其他金属离子只有略微淬灭。TMPyP-SDS组装体系对于Cu2+的高选择性,机理为:TMPyP带正电,SDS带负电荷,二者通过静电作用进行了组装,而Cu2+带正电荷,其加入组装体系后会与带正电的TMPyP相互竞争带负电荷的SDS,抑制了TMPyP与SDS的结合,使得组装体系被破坏,体系荧光强度下降。
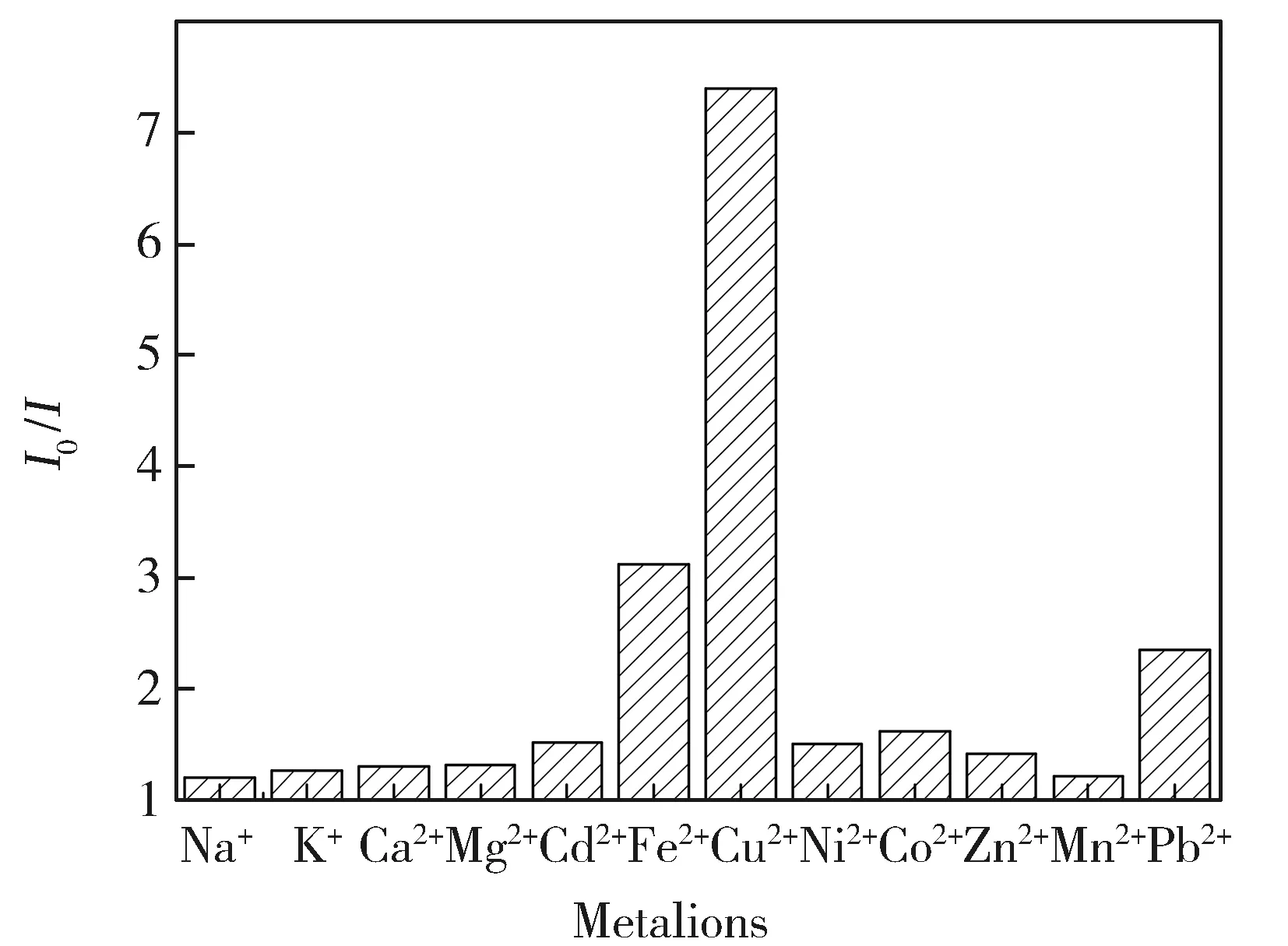
Fig.4 Effect of various metal ions on the fluorescence intensity of TMPyP-SDS assembly system Measuring conditions: [TMPyP]=2.0×10-5 mol/L, [Mn+]=4×10-4 mol/L, [SDS]=0.1 mol/L图4 各种金属离子对TMPyP-SDS组装体系荧光强度的影响
2.4.2 阴离子对TMPyP-SDS组装体系荧光强度的影响
本文还研究了不同阴离子的铜盐对TMPyP-SDS组装体荧光强度的响应程度。向TMPyP-SDS组装体系加入带有不同阴离子的铜盐,诸如CuCl2、CuSO4及Cu(OAc)2。图5A所示为硝酸铜对TMPyP-SDS组装体系荧光的影响,从图中明显看出,当TMPyP-SDS组装体系中随着硝酸铜浓度的增加,体系荧光强度逐渐下降,当Cu2+浓度达到30 μmol/L时,体系荧光基本被淬灭。图5B所示的是当铜离子浓度为30 μmol/L时,不同阴离子的铜盐对TMPyP-SDS组装体系荧光的影响,实验现象与图5的Cu(NO3)2基本相似,在Cu2+浓度为30 μmol/L时,不同阴离子的铜盐也使体系荧光基本被淬灭,而且这几种铜盐的猝灭效果几乎一样,可以说明TMPyP-SDS组装体系的荧光强度几乎不受各种阴离子的干扰。从图4和图5的结果可以得出,TMPyP-SDS组装体系在此实验条件下对Cu2+有很好的选择性。
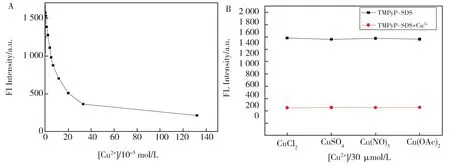
Fig.5 (A)Effect of nitrate ion on fluorescence intensity of TMPyP-SDS assembly system;(B)Effect of various anion on fluorescence intensity of TMPyP-SDS assembly system.图5 (A)硝酸根离子对TMPyP-SDS组装体系荧光强度的影响;(B)各种阴离子对TMPyP-SDS组装体系荧光强度的影响
3 结论
本文成功实现了TMPyP与SDS的组装及其对铜离子的选择性识别,SDS胶束可以有效地诱导TMPyP产生强的荧光,而Cu2+对TMPyP-SDS组装体系的荧光具有强的淬灭效应,此方法对于Cu2+的测定响应快且选择性高,因此该体系对于水样中中铜离子的测定有潜在的应用前景。

