山羊母源抗体对小反刍兽疫疫苗免疫效果的影响
李 芳 严斯刚 黄小武 苏益琼 覃万福 韦玉庆余 波 薛新绵 梁丽娟 罗 生 覃周岚
1.广西壮族自治区鹿寨县动物疫病预防控制中心,广西鹿寨545600;
2.广西壮族自治区柳州市动物疫病预防控制中心,广西柳州545006;
3.广西壮族自治区鹿寨县鹿寨镇水产畜牧兽医站,广西鹿寨545600;
4.广西壮族自治区柳州市兽医化制场,广西柳州545004;
5.广西壮族自治区鹿寨县平山镇水产畜牧兽医站,广西鹿寨545612
小反刍兽疫(peste des petits ruminants,PPR)是由副粘病毒科麻疹病毒属小反刍兽疫病毒引起的小反刍动物的一种急性接触传染病,俗称羊瘟,以发热、口炎、腹泻、肺炎为主要特征,主要感染绵羊和山羊,危害相当严重[1]。目前,小反刍兽疫无特效治疗药物,以疫苗接种为主的综合措施是预防控制小反刍兽疫有效策略。免疫母畜能通过母乳使幼畜获得母源抗体,为幼畜提供保护的同时又会干扰其接种疫苗的主动免疫反应。幼畜首次免疫需要考虑母源抗体水平、自身免疫应答能力等因素影响。张子荣等[2]、何世成等[3]、郝飞等[4]、李芳等[5]对小反刍兽疫母源抗体消长规律进行了研究。本试验采用小反刍兽疫疫苗接种不同母源抗体水平山羊组群,监测其免疫水平,旨在探索直观评价更加接近当地生产实际的疫苗免疫效果,为有效预防及控制小反刍兽疫提供参考。
1 材料与方法
1.1 试验疫苗
小反刍兽疫弱毒疫苗,新疆天康畜牧生物技术股份有限公司生产,规格:50 头份/ 瓶,批号:2016044-2,每头份疫苗含有的小反刍兽疫弱毒病毒至少为103TCID50。按瓶标签注明头份,用灭菌生理盐水将疫苗稀释至每毫升含有1 头份,充分混合均匀,冷藏保存备用,稀释后的疫苗在3 h 内使用完毕。
1.2 诊断试剂
小反刍兽疫抗体ELISA 检测试剂盒,购自北京勤邦生物技术有限公司,批号为20170802。
1.3 试验场地及试验动物
在笔者单位辖区内随机抽取6 个符合试验要求的山羊养殖场(母羊均已接种小反刍兽疫疫苗12个月以上),场名分别标记为A、B、C、D、E、F;每个养殖场选取2~4月龄、未接种过小反刍兽疫疫苗且临床检查健康的本地山羊30 只,每只山羊颈部皮下注射疫苗1 mL,做好标识,在未改变原有条件下按照养殖场常规饲养。
1.4 样品采集
分别于接种疫苗当天(即0 d)以及接种疫苗后28、120、180 d 颈静脉采血,每次3~5 mL/只,分离的血清不少于1 mL/只,血清清亮、无溶血、无染污,-20 ℃以下保存待检。
1.5 抗体检测
1)检测方法。使用前将各试剂盒放置室温30 min,恢复至室温。取相应用量酶标板条,设阴性和阳性对照各2 孔;阴、阳性对照孔分别加入阴、阳性对照50 μL;样品孔每孔加入5 倍稀释后的样品50 μL;每孔加抗体工作液50 μL,混匀,置37 ℃反应30 min;除去孔内液体,每孔加满洗涤液,静置30 s 后弃去,重复洗涤5 次,拍干;每孔加酶标记物100 μL,置37 ℃反应30 min;甩去孔内液体,每孔加满洗涤液,静置30 s后弃去,重复洗涤5 次,拍干;每孔依次加底物液A、底物液B 各50 μL,混匀,37 ℃避光反应15 min;每孔加终止液50 μL,混匀,于450 nm 波长下测定各孔吸光值。
2)结果判定,以 450 nm 吸光值为判定标准。正常试验情况下,阴性对照吸光值≥1.0,阳性对照吸光值≤阴性对照吸光值×50%。按照公式计算阻断率(PI):PI=(1-样本值/阴性对照孔均值)×100%。根据PI 进行结果判定:PI≥50%为阳性;PI<50%为阴性。阴性结果表明,羊只抗体水平不足,需要补打相应疫苗。该试验仅定性检测羊血清中PPR 抗体,根据PI 对抗体水平进行粗略评估。
2 结果与分析
2.1 各养殖场山羊母源抗体检测情况
6 个养殖场的山羊母源抗体阳性率都在70%以下;F 养殖场山羊母源抗体阳性率最高,为66.67%;A 养殖场山羊母源抗体阳性率最低,为3.33%;A、B、C 养殖场平均PI 小于50%,D、E、F 养殖场平均PI 大于50%(表1)。
2.2 各养殖场山羊接种疫苗后免疫抗体检测情况
1)接种疫苗28 d 后免疫抗体检测情况。从表2可以看出,接种疫苗28 d 后,F 养殖场的山羊免疫抗体阳性率为50%,其余5 个养殖场的山羊免疫抗体阳性率均在80%以上。A、C、D 3 个养殖场平均阻断率大于79.96%,B、E、F 3 个养殖场平均阻断率小于79.96%。由于F 养殖场山羊母源抗体阳性率较高,可能是母源抗体对疫苗抗原有部分中和作用,所以免疫后28 d 阳性率较低。
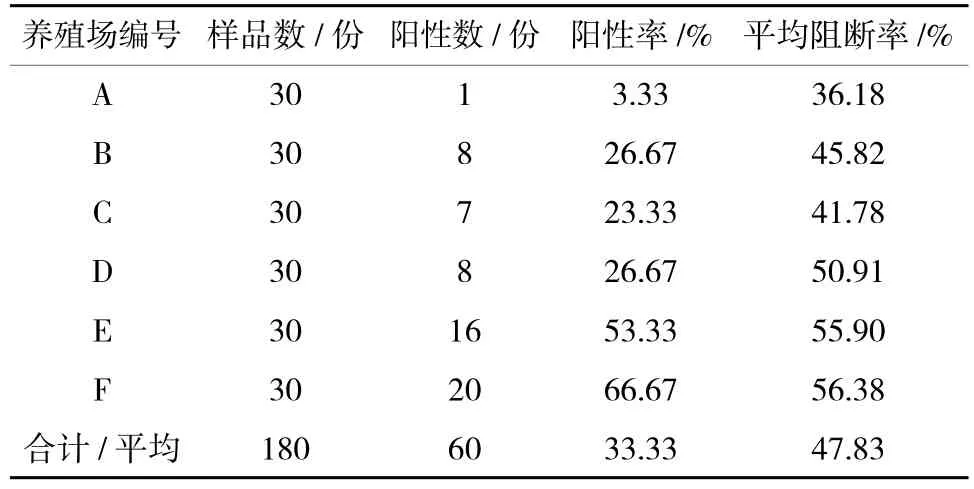
表1 各养殖场的山羊母源抗体检测结果
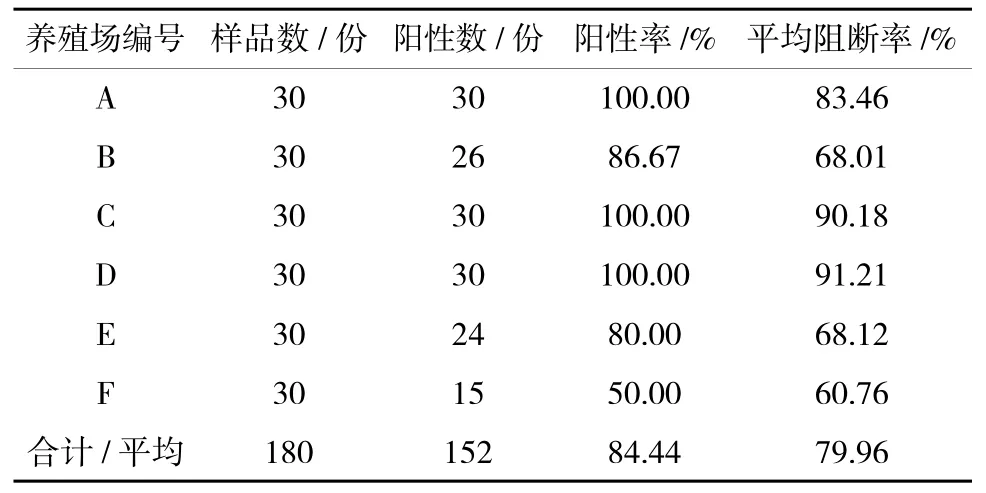
表2 免疫后28 d 山羊免疫抗体检测结果
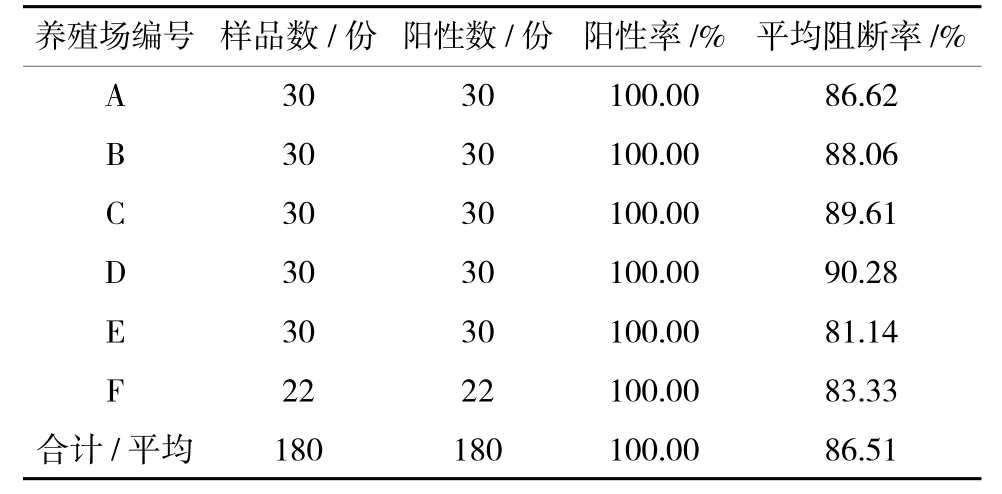
表3 免疫后120 d 山羊免疫抗体检测结果
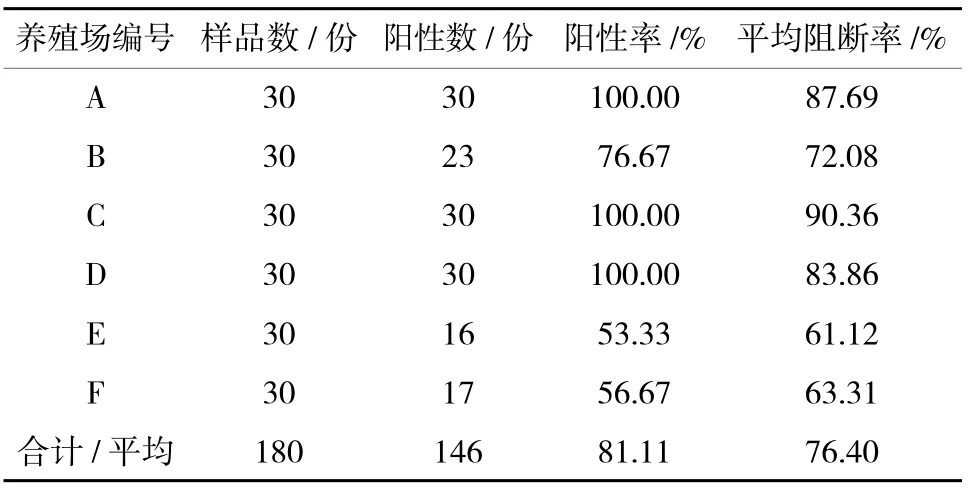
表4 免疫后180 d 山羊免疫抗体检测结果
2)接种疫苗120 d 后山羊免疫抗体检测情况。从表3可以看出,6 个养殖场山羊在接种疫苗120 d后免疫抗体的阳性率均为100%,其平均PI 在80%以上。
3)接种疫苗180 d 后山羊免疫抗体检测情况。从表4可以看出,山羊接种疫苗180 d 后,E 养殖场和F 养殖场山羊的免疫抗体阳性率分别为53.33%和56.67%,均在70%以下;其余4 个养殖场山羊的免疫抗体阳性率均在70%以上。A、C、D 3 个养殖场平均阻断率大于76.40%,B、E、F 3 个养殖场平均阻断率小于76.40%。
图1为各监测时间点山羊抗体阳性率比较。从图1可以看出,山羊母源抗体水平与接种疫苗后28、180 d 免疫抗体阳性率成反比关系,即母源抗体阳性率高的羊群,接种疫苗后28、180 d 免疫抗体阳性率就低。
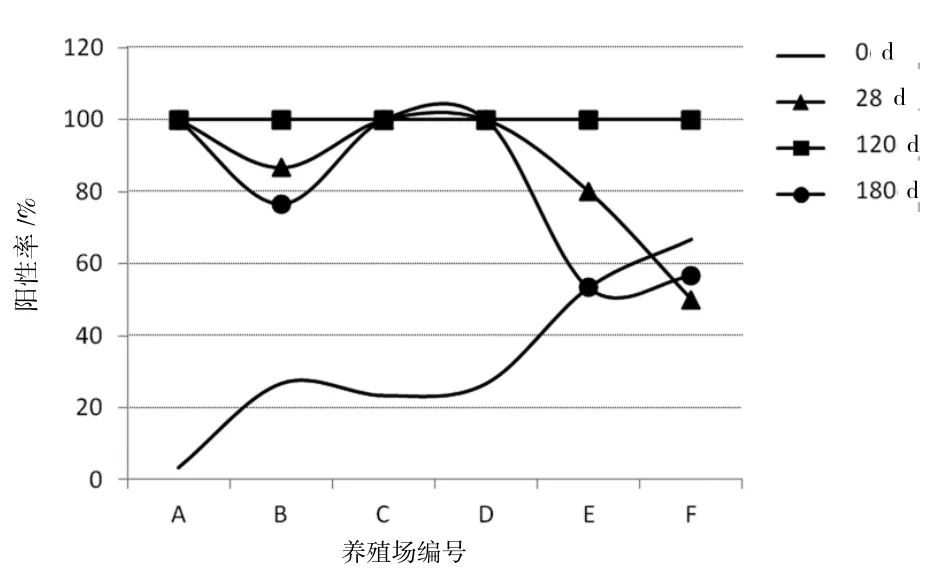
图1 各监测时间点抗体阳性率比较
3 讨 论
本研究结果显示,6 个山羊养殖场小反刍兽疫母源抗体的阳性率在3.33%~66.67%,平均PI 值36.18%~56.38%,说明大部分免疫母羊的子代羔羊中有母源抗体存在。张子荣等[2]、何世成等[3]、郝飞等[4]、李芳等[5]的研究也证实,免疫母羊后代获得一定水平母源抗体。
本研究结果显示,羔羊PPR 母源抗体阳性率下降到70%以下,接种疫苗28 d 后,有5 个山羊养殖场的免疫抗体阳性率高于70%,达到预期免疫效果,而F 养殖场山羊的母源抗体阳性率为66.67%,接种疫苗28 d 后的免疫抗体阳性率仅为50%(远低于70%);接种疫苗180 d 后,E 和F 养殖场山羊的免疫抗体阳性率分别为53.33%和56.67%,均在70%以下,其余4 个养殖场山羊的免疫抗体阳性率均在70%以上。试验结果说明,从母羊中获得的母源抗体对其接种疫苗的主动免疫反应有一定的干扰作用,养殖场母源抗体阳性率低于50%时接种疫苗的免疫效果较好。羔羊的母源抗体水平受母羊免疫时间与次数,即免疫抗体水平有关,同时也与羔羊断奶时间和日龄有关;大部分羔羊在2月龄以后,母源抗体水平显著下降,因此,建议羔羊的最早免疫时间为60日龄左右[5]。有条件的养殖场可通过监测评估,根据母源抗体消长情况选择最佳免疫时机,即可减少其对疫苗免疫效果影响,又可防止羔羊出现过长免疫空白期。
75/1 毒株是OIE 规定的唯一允许使用的PPRV疫苗,该疫苗用于全国PPRV 疫情防控,疫苗效果在多个研究报道中获得良好评价[6-12]。本试验结果显示,不同监测时间点羊群免疫抗体阳性率均发生明显的变化。在养殖生产实践中,羊群免疫状况往往会受到各种因素影响而发生改变,适时开展监测区域羊群免疫效果的监测和评估,并及时掌握群体抵御病毒侵袭的能力是非常必要的。当羊群免疫水平低于防疫目标时,应当及时加强免疫。群体免疫力的存在可阻断病原在羊群中的传播,长期使用疫苗并配合其他相应措施可逐步达到净化疫病的目的。

