鹦歌岭土壤来源Streptomyces sp. YG-7的次生代谢产物及其α-葡萄糖苷酶抑制活性研究
潘洁明 陈惠琴 王昊 梅文莉 蔡彩虹 谭志琼 戴好富


摘 要 为了研究原始热带雨林鹦歌岭土壤放线菌(Streptomyces sp.)YG-7的次生代谢产物及其α-葡萄糖苷酶抑制活性,采用多种柱色谱方法对土壤放线菌YG-7的发酵产物进行分离纯化得到9个化合物,经过波谱数据分析分别鉴定为:(1) 2-acetamido-5-chlorobenzamide, (2) cyclo (L-Pro-L-Leu), (3) 3,6-dibenzylidene-2,5-piperazinedione, (4) albonoursin,
(5) (3Z,6S)-3-benzylidene-6-isobutylpiperazine-2,5-dione, (6) 3-hydroxy-2-methyl-4-pyrone, (7) isophthalic acid, (8) methyl 3-carbamoylbenzoate, (9) 2,3-dihydroxypropyl hexadecanoate. 其中,化合物1、7和8为新天然产物。活性测试结果表明化合物1、3~5和7~8对α-葡萄糖苷酶具有明显的抑制活性。
关键词 放线菌;鹦歌岭;化学成分;α-葡萄糖苷酶
中图分类号 R915 文献标识码 A
Abstract The α-glucosidase activities of secondary metabolites from Streptomyces sp. YG-7 actinomycetes isolated from the soils collected from the virgin tropical rainforest Yingge Ridge were investigated. Nine compounds were isolated and purified by various chromatographic techniques, and the structures were identified as (1) 2-acetamido-5- chlorobenzamide, (2) cyclo (L-Pro-L-Leu), (3) 3,6-dibenzylidene-2,5-piperazinedione, (4) albonoursin, (5) (3Z, 6S)-3-benzylidene-6-isobutylpiperazine-2,5-dione, (6) 3-hydroxy-2-methyl-4-pyrone, (7) isophthalic acid, (8) methyl 3-carbamoylbenzoate, and (9) 2,3-dihydroxypropyl hexadecanoate through a combined analysis of physicochemical properties and spectral data. Among them, compounds 1, 7 and 8 were new natural products, and compounds 1, 3–5, 7–8 exhibited significantly α-glucosidase inhibitory activity.
Keywords actinomycetes; Yingge Ridge; chemical constituent; α-glucosidase
DOI 10.3969/j.issn.1000-2561.2019.07.026
放线菌是在自然界中分布极为广泛的一类微生物,种类繁多,其次生代谢产物则具有结构丰富、活性多样的特点,是一类具有重要经济和生物研究价值的微生物资源[1-3]。目前临床上使用的红霉素、马杜拉霉素、利富平和洋红霉素等药物,都直接或间接地来源于放线菌产生的次生代谢产物[4]。土壤是放线菌的重要寄所,虽然对土壤放线菌的研究及应用已有多年,但是目前发现的放线菌无论在数量还是种类上都只占到很少的部分,所以土壤仍是放线菌来源的巨大宝库[5]。鹦歌岭位于海南省乐东县,属于原始热带雨林(N 19°04.255′,E 109°57.037′),海拔1811 m,山高坡陡,人烟稀少,交通闭塞,绝大部分地区从未有过正规和大规模的开发利用[6],表现出非常明显的原始特征,对其中的土壤放线菌研究鲜有报道。本课题组对鹦歌岭土壤中的放线菌进行了分离,得到了168株放线菌菌株,研究发现其中3株放线菌的次生代谢产物具有体外酶抑制活性,9株具有抗菌活性,其中Streptomyces sp. YG-7发酵粗提物具有显著的α-葡萄糖苷酶抑制活性。本研究对Streptomyces sp. YG-7进行了次级代谢产物的分离,并从中共分离鉴定了9个化合物,其中化合物1,7和8为未报到过的天然产物。活性测试结果表明化合物1,3~5和7~8对α-葡萄糖苷酶具有明显的抑制效果。
1 材料与方法
1.1 材料
1.1.1 供试菌株 放线菌YG-7分离自海南省乐东县鹦歌岭(N 19°04.255′,E 109°57.037′,海拔619.6 m)的土壤中,保藏于中国热带农业科学院热带生物技术研究所。
1.1.2 仪器与试剂 Basis Hei-VAP Value旋转蒸发仪(德国Heidolph Laborota公司),Micromass Autospec-Uitima TOF质谱仪(美国Waters公司),Brucker AV-500核磁共振波谱仪(以TMS为内标,瑞士 Bruker 公司);安捷伦1260分析型高效液相色谱仪(美国安捷伦科技有限公司),戴安Summit P680A半制备高效液相色谱仪(美国戴安公司);ELX-800酶標仪(美国Bio-Tex公司),超净工作台,上海博讯实业有限公司;超纯水装置,厦门锐思捷水纯化技术有限公司。α-葡萄糖苷酶,北京Solarbio公司;阿卡波糖,北京百灵威科技有限公司;Sephadex LH-20,德国Merck公司;C18反相材料,日本FU-JI公司;柱色谱硅胶和薄层色谱硅胶板,青岛海洋化工厂产品;氘代试剂(CD3OD和CDCl3),德国Merck公司;色谱溶剂购自天津康科德公司;其他试剂均为重蒸工业试剂。
1.1.3 培养基 高氏一号培养基:可溶性淀粉
20.0 g,NaCl 0.5 g,MgSO4?7H2O 0.5 g,KNO3 1.0 g,K2HPO4·3H2O 0.5 g,FeSO4 0.01 g,琼脂18.0 g,蒸馏水1000 mL,pH 7.4~7.6。
1.2 方法
1.2.1 菌株鉴定 将放线菌YG-7接种于高氏一号培养基,28 ℃培养7 d,观察菌株的形态特征。将放线菌YG-7接种于高氏一号培养基上,然后把灭菌的盖玻片以45°插入培养基中,置于28 ℃培养,菌丝体生长出来并附着在盖玻片上时,轻轻地拔出盖玻片,置于显微镜下观察菌丝和孢子的形态。使用试剂盒[E.Z.N.A Bacterrial DNA Kit(50)]提取DNA,以27f(5′-AGAGTTTGAT CCTGGCTCAG-3′)和1492r(5′-TACGGCTACCTT GTTACGACTT-3′)作为引物(上海生工生物工程股份有限公司),对该菌株16S rDNA基因序列进行测定,将测序结果提交于NCBI基因库,并与BLAST数据库进行同源比对,并利用软件MEGA 6.0构建系统发育树。
1.2.2 菌株发酵 放线菌YG-7在高氏一号培养基中活化后,挑取单个菌落接种到装有100 mL高氏一号液体培养基的500 mL三角瓶中,置于28 ℃, 200 r/min的摇床中振荡培养2 d,得到种子液,按4%接种量接种到1 L三角瓶中(含400 mL培养基),28 ℃,200 r/min条件下发酵8 d,共发酵120瓶。
1.2.3 提取与分离 菌株发酵结束后,在发酵液
中加入1∶1乙酸乙酯,用Bruker FA25匀浆机破
碎菌丝与孢子,重复萃取3遍,回收合并乙酸乙酯相,减压浓缩,获得乙酸乙酯提取物(66.0 g)。
将提取物用95%甲醇溶解,以1∶1用石油醚萃取,
除去石油醚层,减压浓缩得到23.0 g膏状粗提物。
将粗提物经过减压硅胶柱色谱,得到20个流份(Fr.1~Fr.20)。Fr.7(1.1 g)以甲醇-水为流动相,经C18反相硅胶柱色谱梯度洗脱,得到15个流分(Fr.7-1~Fr.7-15)。Fr.7-3和Fr.7-6分别经重结晶方法得到白色晶体即化合物6(2.1 mg)和米黄色晶体即化合物7(5.9 mg)。Fr.7-7和Fr.7-8分别经半制备高效液相色谱(C18柱,甲醇-水为流动相,流速4 mL/min;检测波长200、254 nm/ 200、220 nm)分离得到化合物1(2.5 mg,保留时间13.5 min)、2(1.1 mg,保留时间11 min)和8(1.0 mg,保留时间15.5 min)。Fr.7-11依次經过Sephadex LH-20、硅胶柱色谱和半制备高效液相色谱分离纯化得到化合物3(1.6 mg)、9(8.5 mg)和4(2.0 mg)。Fr.7-12经半制备高效液相色谱 (C18柱,40%甲醇-水,流速4 mL/min;检测波长200、220 nm)分离得到化合物5(1.2 mg,保留时间18.5 min)。
1.2.4 α-葡萄糖苷酶抑制活性筛选 使用PNPG(4-硝基苯基-α-D-吡喃葡萄糖苷)法[7]对化合物1~9的α-葡萄糖苷酶抑制活性进行评价。0.2 mol/L的PBS溶液(pH 6.8)作为反应溶液,样品终质量浓度为500 μg/mL,阴性对照为DMSO PBS溶液,阳性对照为阿卡波糖溶液(500 μg/mL),将混匀的各溶液加入到96孔酶标板后,于37 ℃放置15 min后,加入PNPG溶液20 μL,然后将96孔板于37 ℃放置15 min后,加入0.2 mol/L的Na2CO3终止液80 μL,于酶标仪405 nm波长下测定吸光度值,并计算化合物对α-葡萄糖苷酶的抑制率。结果见表1。
抑制率=[(B-B0)-(A-A0)]/(B-B0)其中,A0:背景对照组吸光值;A:实验组吸光值;B0:空白对照组吸光值;B:阴性对照组吸光值。
2 结果与分析
2.1 菌株鉴定
放线菌YG-7在高氏一号培养基上生长良好,菌落呈圆形,边缘不规则,中间略微凸起,灰色,有放射状菌丝产生(图1A)。分生孢子梗细长,分生孢子为球形,呈串状生长,末端蜷曲呈圈(图1B)。通过PCR扩增获得菌株YG-7的16S rDNA基因序列,GenBank登录号为KY860902。将该
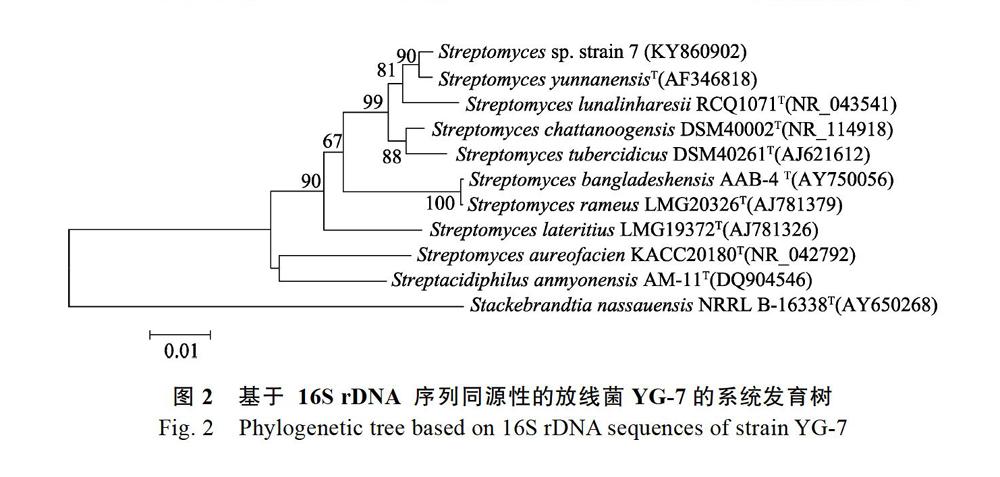
序列在GenBank上进行BLAST比对,选取与其同源性较高的菌株,使用MEGA 6.0构建系统发育树(图2)。结果显示,菌株YG-7与Streptomyces yunnanensis(AF346818)在同一分支上,且与Streptomyces yunnanensis相似度达99%以上,因此,鉴定该菌株为Streptomyces sp. YG-7。
A:菌落
A: Colony of YG-7
B:分生孢子梗及分生孢子(光学显微镜40×)
B: Conidiophores and conidia (Light microscope 40×)
2.2 结构鉴定
化合物1:白色粉末,分子式为C9H9ClN2O2; ESI-MS m/z : 235[M+Na]+; 1H-NMR (CD3OD, 500 MHz) δH : 8.37 (1H, d, J=8.9 Hz, H-3), 7.75 (1H, d, J=2.5 Hz, H-6), 7.46 (1H, dd, J=8.9 Hz, 2.5 Hz, H-4), (C-5, C-6), 171.4 (C-7), 172.0 (C-8), 24.7 (C-9)。以上数据与文献[8]报道基本一致,确定化合物1为2-acetamido-5-chlorobenzamide。
化合物2:粉色粉末,分子式为C11H18N2O2; ESI-MS m/z : 211[M+H]+; 1H-NMR (CDCl3, 500 MHz) δH : 4.17 (1H, m, H-6), 4.03 (1H, d, J=6.3 Hz, H-9), 3.61~3.66 (1H, m, H-3α), 3.56~3.60 (1H, m, H-3β), 2.36 (2H, m, H-10), 2.13~2.23 (1H, m, H-5α, 11), 2.04~2.06 (1H, m, H-4α), 1.89~1.93 (1H, m, H-5β), 1.72~1.78 (1H, m, H-4β), 0.96 (3H, d, J=6.6 Hz, H-12), 1.01 (3H, d, J=6.6 Hz, H-13); 13C-NMR (CDCl3, 125 MHz) δC : 166.4 (C-1), 45.7 (C-3), 23.5 (C-4), 28.3 (C-5), 59.1 (C-6), 163.7 (C-7), 53.5 (C-9), 38.8 (C-10), 24.9 (C-11), 21.3 (C-12), 22.9 (C-13)。以上数据与文献[9]报道基本一致,确定化合物2为cyclo(L-Pro-L-Leu)。
化合物3:黄色粉末,分子式为C18H14N2O2; ESI-MS m/z : 329[M+K]+; 1H-NMR (CDCl3, 500 MHz) δH : 8.19 (2H, s, 1, 4-NH), 7.47 (4H, t, J=7.5 Hz, H-9, 13, 16, 20), 7.40 (6H, m, H-10, 11, 12, 17, 18, 19), 7.04 (2H, s, H-7, 14); 13C-NMR (CDCl3, 125 MHz) δC : 116.9 (C-2, 5), 157.1 (C-3, 6), 129.7 (C-7, 14), 132.8 (C-8, 15), 129.2 (C-9, 13, 16, 20), 128.6 (C-10, 12, 17, 19), 125.7 (C-11, 18)。以上数据与文献[10]报道基本一致,确定化合物3为3,6-dibenz ylidene-2,5-piperazinedione。
化合物4:白色粉末,分子式为C15H16N2O2; ESI-MS m/z : 257[M+H]+; 1H-NMR (CDCl3, 500 MHz) δH : 8.19 (1H, s, 4-NH), 8.12 (1H, s, 1-NH), 7.34~7.45 (5H, m, Ar-H), 6.99 (1H, s, H-7), 6.02 (1H, d, J=10.2 Hz, H-14), 2.61 (1H, m, H-15), 1.12 (6H, d, J=6.6 Hz, H3-16, 17); 13C-NMR (CDCl3, 125 MHz) δC : 124.4 (C-2), 157.5 (C-3), 125.9 (C-5), 157.3 (C-6), 116.4 (C-7), 132.9 (C-8), 128.5 (C-9, 13), 129.7 (C-10, 12), 129.0 (C-11), 127.4 (C-14), 25.7 (C-15), 22.2 (C-16, 17)。以上數据与文献[11]报道基本一致,确定化合物4为albonoursin。
化合物5:白色粉末,分子式为C15H18N2O2; ESI-MS m/z : 259[M+H]+; 1H-NMR (CDCl3, 500 MHz)δH:7.86 (1H, s, 1-NH), 7.44 (2H, m, H-9, 13), 7.35 (3H, m, H-10, 11, 12), 7.00 (1H, s, H-7), 6.07 (1H, s, 4-NH), 4.19 (1H, m, H-5), 1.86 (2H, m, H-14), 1.78 (1H, m, H-15), 1.02 (3H, d, J=6.2 Hz, H-16), 0.98 (3H, d, J=6.2 Hz, H-17); 13C-NMR (CDCl3, 125 MHz) δC : 125.4 (C-2), 159.6 (C-3), 54.4 (C-5), 166.3 (C-6), 116.3 (C-7), 132.9 (C-8), 128.9 (C-9, 13), 129.6 (C-10, 12), 128.6 (C-11), 43.8 (C-14), 24.5 (C-15), 23.1 (C-16), 21.4 (C-17)。以上数据与文献[12]报道基本一致,确定化合物5为(3Z, 6S)-3-benzylidene-6-isobutylpiperazine-2, 5- dione。
化合物6:米白色晶体,分子式为C6H6O3; ESI-MS m/z : 127[M+H]+; 1H-NMR (CDCl3, 500 MHz) δH : 7.71 (1H, d, J=5.5 Hz, H-6), 6.42 (1H, d, J=5.5 Hz, H-5), 2.37 (3H, s, H-7); 13C-NMR (CDCl3, 125 MHz) δC : 148.8 (C-2), 143.2 (C-3), 173.0 (C-4), 113.0 (C-5), 154.4 (C-6), 14.4 (C-7)。以上数据与文献[13]报道基本一致,确定化合物6为3-hydroxy-2-methyl-4- pyrone。
化合物7:浅黄色粉末,分子式为C8H6O4; ESI-MS m/z : 167[M+H]+; 1H-NMR (CD3OD, 500 MHz) δH : 8.65 (1H, t, J=1.7 Hz, H-2), 8.24 (2H, dd, J=7.8 Hz, 1.7 Hz, H-4, 6), 7.60 (1H, t, J=7.8 Hz, H-5); 13C-NMR (CD3OD, 125 MHz) δC : 132.5 (C-1, 3), 131.9 (C-2), 134.9 (C-4, 6), 129.8 (C-5), 168.9 (C-7, 8)。以上数据与文献[14]报道基本一致,确定化合物7为isophthalic acid。
化合物8:棕色粉末,分子式为C9H9NO3; ESI-MS m/z : 180[M+H]+; 1H-NMR (CD3OD, 500 MHz)δH:8.54 (1H, dd, J=1.7, 1.7 Hz, H-2), 8.19 (1H, ddd, J=7.8, 1.3, 1.3 Hz, H-4), 8.11 (1H, ddd, J=7.8, 2.8, 2.8 Hz, H-6), 7.60 (1H, t, J=7.8 Hz, H-5), 3.94 (3H, s, H-8); 13C-NMR (CD3OD, 125 MHz) δC : 135.6 (C-1), 129.7 (C-2), 131.8 (C-3), 133.6 (C-4), 129.9 (C-5), 133.1 (C-6), 167.8 (C-7), 52.8 (C-8), 171.1 (C-9)。以上数据与文献[15]报道基本一致,确定化合物8为methyl 3-carbamoylbenzoate。
化合物9:棕色油状,分子式为C19H38O4; ESI-MS m/z : 331[M+H]+; 1H-NMR (CD3OD, 500 MHz) δH: 4.08 (2H, m, H-3), 3.80 (1H, m, H-2), 3.53 (2H, m, H-1), 2.34 (2H, t, J=7.8 Hz, H-5), 1.60 (2H, m, H-6), 1.23-1.35 (24H, m, H-7-18), 0.86 (3H, m, H-19); 13C-NMR (CD3OD, 125 MHz) δC: 64.1 (C-1), 71.1 (C-2), 66.5 (C-3), 175.5 (C-4), 34.9 (C-5), 23.8 (C-6), 26.0~33.1 (C-7-18), 14.5 (C-19)。以上数据与文献[16]报道基本一致,确定化合物9为2,3-dihydroxypropyl hexadecanoate。
2.3 活性测试
采用PNPG法测定化合物1~9的α-葡萄糖苷酶抑制活性,结果表明,化合物1、3~5和7~8具有较好的α-葡萄糖苷酶抑制活性,具体活性结果见表1。
3 讨论
本研究通过多种色谱技术从原始热带雨林鹦歌岭土壤放线菌YG-7中分离得到9个化合物,其中化合物1、7和8为新天然产物,化合物2~5为二酮哌嗪类化合物。二酮哌嗪类化合物在自然界中广泛存在,生物活性多样,包括抑菌、抗肿瘤、抗氧化、抗病毒、抗动脉硬化等[17],其中关于抑菌和抗肿瘤的报道较多,而对α-葡萄糖苷酶抑制活性却少有报道。本研究发现的4个二酮哌嗪类化合物中有3个(3~5)表现出了α-葡萄糖苷酶抑制活性,只有化合物2在相同浓度下未见其抑制效果,其原因可能是化合物3~5结构中的苯烯基对活性起到了关键作用,但还需更多的研究进一步验证。化合物4的α-葡萄糖苷酶活性略强于化合物3,推测结构中14位的取代基为苯环时相比异丙基有微弱的增强作用。化合物4和5相比,化合物5的活性更显著,由此推测,化合物5中C6-C7为单键时更利于α-葡萄糖苷酶抑制活性。
放线菌是一类能产生丰富活性次级代谢产物的微生物资源,在药物研究与开发中占有极其重要的地位。虽然该来源的药物在20世纪70年代达到高峰,之后从中发现新药物的速率变得缓慢,但Watve等[18]研究认为,放线菌的次生代谢产物产生潜力还远未挖掘出来,目前所发现的仅占3%左右,而且鹦歌岭尚属于未开发地带,特殊的植被赋予土壤滋养不同的放线菌菌群。本次对其中Streptomyces sp. YG-7次生代谢产物得研究就发现了二酮哌嗪类、吡喃酮类、酚酸类和脂肪酸类等不同化合物结构类型的化合物,说明其代谢产物丰富多样,所以从鹦歌岭土壤来源的放线菌的次生代谢物中发现结构新颖、活性独特的先导化合物前景依然广阔。
参考文献
Thong W L, Shin-ya K, Nishiyama M, et al. Methylbenzene-containing polyketides from a Streptomyces that spontaneously acquired rifampicin resistance: Structural elucidation and biosynthesis[J]. Journal of Natural Products, 2016, 79(4): 857-864.
Wu C, Du C, Gubbens J, et al. Metabolomics-driven discovery of a prenylated isatin antibiotic produced by Streptomyces species MBT28[J]. Journal of Natural Products, 2015, 78(10): 2355-2363.
Kim S H, Shin Y, Lee S H, et al. Salternamides A–D from a halophilic Streptomyces sp. actinobacterium[J]. Journal of Natural Products, 2015, 78(4): 836-843.
王淑霞, 朱天驕, 卢圳域, 等. 海洋新放线菌及其次级代谢产物研究进展[J]. 中国抗生素杂志, 2007(9): 513-519..
Errakhi R, Lebrihi A, Barakate M. In vitro and in vivo antagonism of actinomycetes isolated from Moroccan rhizospherical soils against Sclerotium rolfsii: a causal agent of root rot on sugar beet (Beta vulgaris L.)[J]. Journal of Applied Microbiology, 2009, 107(2): 672-681.
林家怡, 吴世捷, 庄雪影, 等. 海南鹦歌岭轮叶三棱栎 (Trigonobalanus verticillata) 群落特征与保护对策[J]. 生态学报, 2007, 27(6): 2230-2238.
Nilubon J A, Megh R B, Jun K. α-Glucosidase inhibitors from devil tree (Alstonia scholaris)[J]. Food Chemistry, 2007, 103(4): 1319-1323.
Kelleher J M, Mcauliffe M T, Monihan H A, et al. Studies on the preparation and crystal polymorphism of 2-acetam idobenzamide and related compounds[J]. Arkivoc, 2007, 16: 209-226.
Zhao P J, Wang H X, Li G H, et al. Secondary metabolites from endophytic Streptomyces sp. Lz531[J]. Chemistry & Biodiversity, 2010, 4(5): 899-904.
Kwak M K, Kim H, Song Y S, et al. Antioxidant activity of diketopiperazines from Bacillus idriensis[J]. Journal of Korean Chemistry Society, 2015, 59(6): 545-550.
Arnone A, Nasini G, Pava O, et al. Structure elucidation of diatretol–a new diketopiperazine metabolite from the fungus Clitocybe diatreta[J]. European Journal of Organic Chemistry, 2010, 1996(11): 1875-1877.
Wang P, Xi L J, Liu P P, et al. Diketopiperazine derivatives from the marine-derived actinomycete Streptomyces sp. FXJ7. 328 [J]. Marine Drugs, 2013, 11(4): 1035-1049.
Tsurumi S, Takagi T, Hashimoto T. A γ-pyronyl-triterpenoid saponin from Pisum sativum[J]. Phytochemistry, 1992, 31(7): 2435-2438.
Derissen J L. The crystal structure of isophthalic acid[J]. Acta Crystallographica Section B, 1974, 30(11): 2764-2765.
Keshipour S, Shaabani A. Selective aerobic hydrolysis of nitriles to amides using cobalt (II)/zinc[J]. Research on Chemical Intermediates, 2015, 41(8): 5071-5078.
Chang H S, Chen Y S, Cheng M J, et al. Chemical constituents of the fungus Mycoleptodiscus sp. 09F0149[J]. Chemistry of Natural Compounds, 2018, 54(2): 396-398.
郭秀春, 鄭 立, 周文辉, 等. 海洋微生物中二酮哌嗪类化合物的研究进展[J]. 微生物学通报, 2009, 36(10): 1596-1603.
Watve M G, Tickoo R, Jog M M, et al. How many antibiotics are produced by the genus Streptomyces[J]. Archives of Microbiology, 2001, 176(5): 386-390.

