哈萨克药骆驼蓬草的质量标准研究
许欢 江阿古丽·艾山 汪晶 李筱婧 陈斌 木拉提·克扎衣别克 黄一平


中圖分类号 R282;R917 文献标志码 A 文章编号 1001-0408(2019)20-2818-06
DOI 10.6039/j.issn.1001-0408.2019.20.16
摘 要 目的:建立哈萨克药骆驼蓬草药材的质量标准。方法:以新疆哈萨克地区采集的10批骆驼蓬草药材为研究对象,考察其性状;采用薄层色谱(TLC)法对药材中骆驼蓬碱和去氢骆驼蓬碱进行定性鉴别;采用2015版《中国药典》(四部)相关方法检查其水分、总灰分、酸不溶性灰分和醇浸出物含量;采用高效液相色谱(HPLC)法测定药材中骆驼蓬碱和去氢骆驼蓬碱的含量,色谱柱为X-bridge C18(250 mm×4.6 mm,5 μm),流动相为乙腈-醋酸铵缓冲液(冰醋酸调节pH至6),梯度洗脱,检测波长为267 nm,柱温为25 ℃,流速为1 mL/min,进样量为5 μL。结果:TLC法鉴别结果显示,10批药材在骆驼蓬碱和去氢骆驼蓬碱对照品相同位置处均显示清晰斑点;水分、总灰分、酸不溶性灰分分别不得高于12%、22%、2%,醇浸出物不得低于16%。HPLC法考察结果显示,骆驼蓬碱、去氢骆驼蓬碱分别在15.22~301.40、15.09~301.80 μg/mL质量浓度范围内线性关系良好,精密度、重复性、稳定性试验的RSD均小于4%,平均回收率分别为100.22%、100.94%(RSD均小于2%);含量测定结果显示,该药材总生物碱含量(以骆驼蓬碱、去氢骆驼蓬碱合计)不得少于6.5 mg/g。结论:本研究在原标准基础上增加了检查项,建立了TLC法鉴别骆驼蓬碱、去氢骆驼蓬和HPLC法测定两者含量的方法。所建质量标准可用于全面控制新疆哈萨克地区骆驼蓬草药材的质量。
关键词 骆驼蓬草;质量标准;检查;鉴别;骆驼蓬碱;去氢骆驼蓬碱;含量测定;薄层色谱法;高效液相色谱法
ABSTRACT OBJECTIVE: To establish the quality standard for Kazakhstan medicine Peganum harmala. METHODS: Ten batches of P. harmala collected in Xinjiang Kazakh region were selected as research objects to investigate their characteristics. Qualitative identification of harmaline and harmine was conducted by TLC. The contents of water, total ash, acid-insoluble ash and ethanol extract were tested according to Chinese Pharmacopoeia(2015 edition). The contents of harmaline and harmine were determined by HPLC. The determination was performed on X-bridge C18 column(250 mm×4.6 mm,5 μm) with mobile phase consisted of acetonitrile-ammonium acetate buffer (adjusted to 6 with glacial acetic acid, gradient elution) at the flow rate of 1 mL/min. The detection wavelength was set at 267 nm, and column temperature was 25 ℃. The sample size was 5 μL. RESULTS: TLC identification results showed that 10 batches of medicinal material showed clear spots at the same position as harmaline and harmine reference substances. Water, total ash, acid-insoluble ash should not be more than 12%,22%,2%, respectively; ethanol extract must not be less than 16%. HPLC results showed that the linear ranges of harmaline and harmine were 15.22-301.40,15.09-301.80 μg/mL; RSDs of precision, reproducibility and stability tests were all lower than 4%; average recoveries were 100.22% and 100.94%(all RSD<2%). The determination results showed that the content of total alkaloids (harmaline and harmine) should not be less than 6.5 mg/g. CONCLUSIONS: Based on the original standard, test items are added in this study. TLC method is established to identify harmaline and harmine. HPLC method is established to determine their contents. Established quality standard can be used for comprehensive quality control of P. harmala from Xinjiang Kazakh region.
KEYWORDS Peganum harmala;Quality standard;Examina- tion; Identification; Harmaline; Harmine; Content determina- tion; TLC; HPLC
哈萨克族医学是我国传统医药的重要组成部分,其具有鲜明的民族特色、完整的理论体系及独创的特色疗法[1]。骆驼蓬草是哈萨克医学常用药材之一,其广泛分布于新疆维吾尔地区,产量较大,为蒺藜科植物骆驼蓬(Peganumharmala L.)的干燥地上部分[2],具有祛风止痛、通血调经的功效;同时,其亦是伊犁哈萨克自治州中医医院传统医院制剂祛风阿德尔阿斯盘蜜膏中的主药之一[3-4]。江苏省中医药研究院与伊犁哈萨克自治州中医医院进行了战略合作,对祛风阿德尔阿斯盘蜜膏进行了深度开发。在研发过程中发现,骆驼蓬草在哈萨克地区多以该植物地上部分入药,而且缺乏相应的药材质量标准,而现行《卫生部药品标准(维吾尔药分册)》收载的骆驼蓬草标准中仅对该药材进行了性状描述及显微鉴别[2];此外,已有研究虽然对骆驼蓬不同部位的生物碱进行了深入研究[5-9],但所建立的标准不适用于骆驼蓬草。基于此,本研究建立了新疆哈萨克地区骆驼蓬草药材的质量标准,分别从性状、鉴别、检查等方面进行全面控制,并重点对具有调节免疫、抗炎、抗肿瘤等功效的β-咔啉类生物碱[10-13]进行含量测定,同时进一步优化含量测定方法,为该药材质量标准的完善提供依据。
1 材料
1.1 仪器
1100型高效液相色谱(HPLC)仪,含G1311A型四元泵、G1322A型在线真空脱气机、G1313A型自动进样器、G1316型柱恒温箱、G1315B型二极管阵列检测器、Agilent化学工作站(美国Agilent公司);Milli-Q Intergral型水纯化系统(美国Millipore公司);HH-2型恒温水浴锅、SX2-8-16型马弗炉(上海力辰邦西仪器科技有限公司);KQ 500DE型数控超声波清洗器(昆山市超声仪器有限公司);MS-105DU型电子天平(瑞士Mettler Toledo公司);DHG-9055A型电热恒温鼓风干燥箱(上海吉众仪器有限公司)。
1.2 药品与试剂
骆驼蓬碱对照品(批号:H1237,纯度:以98%计,供含量测定用)、去氢骆驼蓬碱对照品(批号:H0001,纯度:以98%计,供含量测定用)均购自东京化成工业株式会社;硅胶G薄层板(青岛海洋化工厂分厂,规格:10 cm×20 cm);甲醇、乙腈均为色谱纯(美国Tedia公司);醋酸铵、三乙胺、磷酸、冰醋酸均为色谱纯[阿拉丁试剂(上海)有限公司];乙酸乙酯、浓氨水、乙醇均为分析纯(南京化学试剂有限公司);水为超纯水。
1.3 药材
10批骆驼蓬草由伊犁哈萨克自治州中医医院提供,来源信息详见表1。
2 方法与结果
2.1 性状
本品全长15~35 cm;茎呈圆柱形,多分枝,直径为2~4 mm;表面黄绿色,具纵条纹,略光滑,质脆易折断,断面黄白色,中央髓部白色;叶互生,无柄或有短柄,叶片呈鹿角状分歧,颜色为浅绿色至深绿色,有的老叶呈灰白色,常皱缩或卷曲,展平后呈二回羽状全裂(鹿角狀分歧),裂片呈条形,且光滑无毛、厚革质;花瓣呈淡黄色至浅棕色,雄蕊15,幼果近球形;气特异芳香,味微咸苦[14]。各批次骆驼蓬草药材及其不同部位示例详见图1、图2。
2.2 鉴别
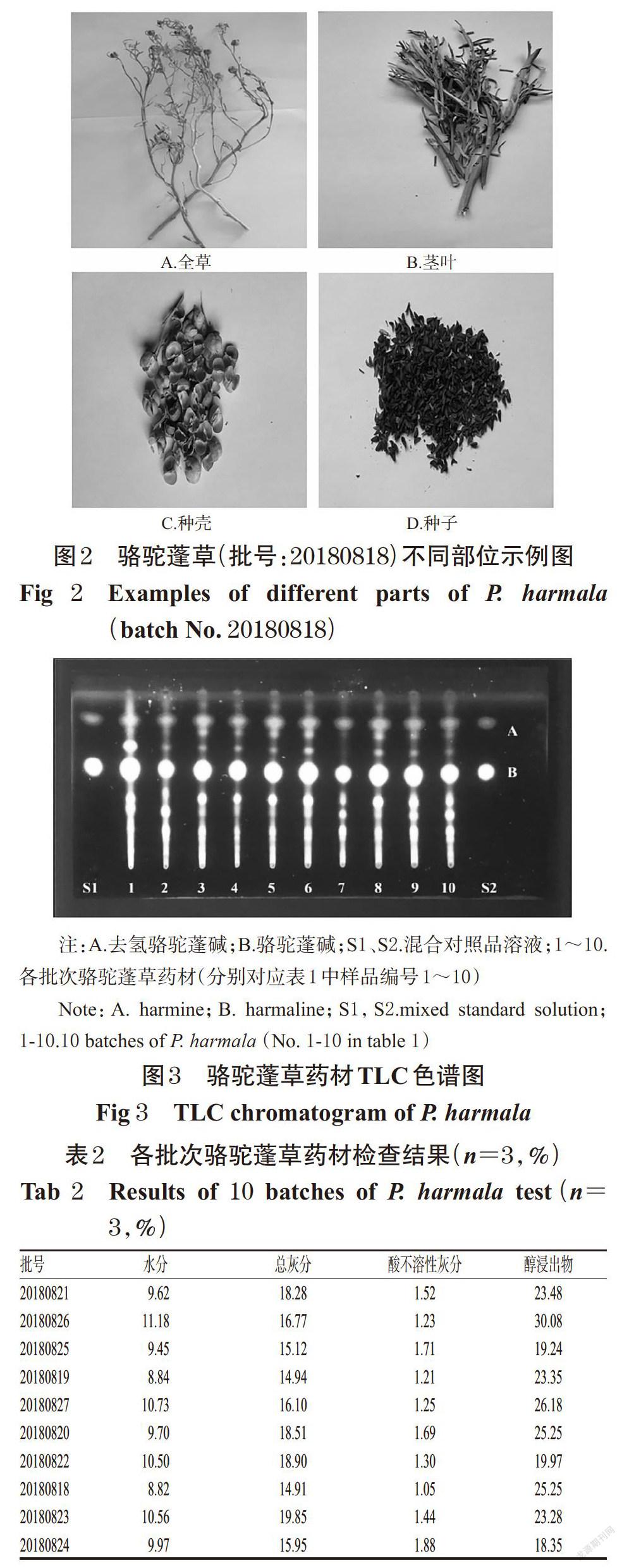
参照2015年版《中国药典》(四部)通则0502[2],采用薄层色谱(TLC)法对药材中的骆驼蓬碱和去氢骆驼蓬碱进行鉴别。取骆驼蓬草细粉(过5号筛,下同)1 g,加入95%乙醇40 mL,100 ℃水浴回流30 min;滤过,滤液蒸干,残渣加甲醇2 mL复溶,作为供试品溶液。另取骆驼蓬碱、去氢骆驼蓬碱对照品,以甲醇制成质量浓度均为0.05 mg/mL的混合对照品溶液。吸取上述供试品溶液和混合对照品溶液各5 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-甲醇-氨水(20 ∶ 5 ∶ 1,V/V/V)展开,取出,晾干,置于紫外灯下(365 nm)检视[7,15]。结果显示,在与混合对照品溶液色谱相应的位置上,供试品溶液色谱中显相同颜色的紫色荧光斑点(去氢骆驼蓬碱)和蓝色荧光斑点(骆驼蓬碱),详见图3。
2.3 检查
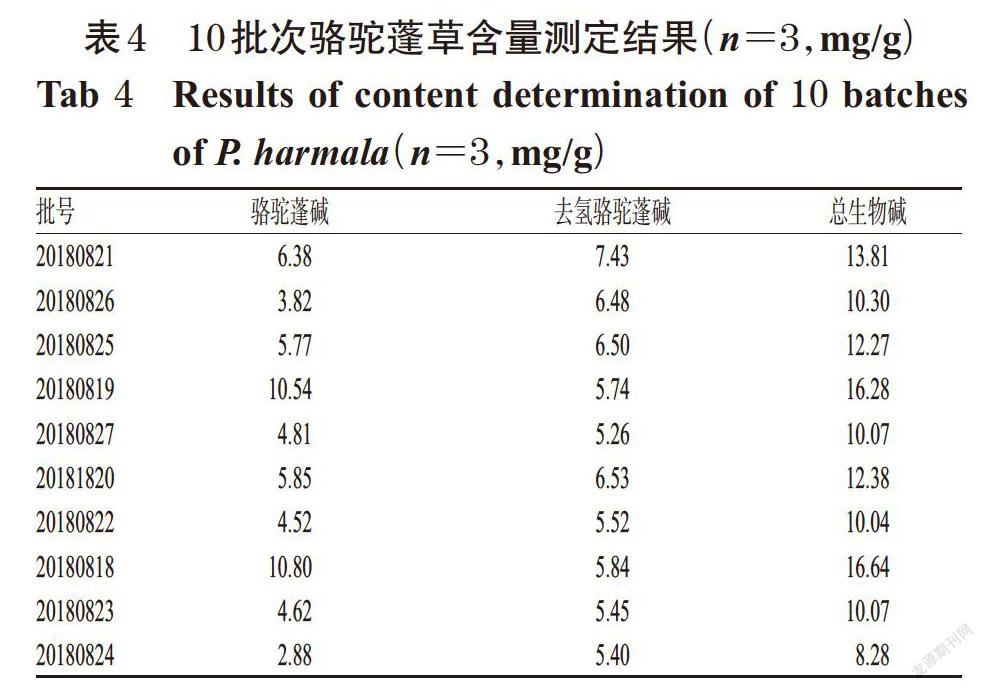
参照2015年版《中国药典》(四部)通则0832第二法、通则2302第一法和第二法酸不溶性灰分测定法、通则2201热浸法[2],分别检测药材样品的水分、总灰分、酸不溶灰分、醇浸出物(即50%乙醇浸出物),结果详见表2。
由表2可见,各批次骆驼蓬草药材的水分为8.82%~11.18%,总灰分为14.91%~19.85%,酸不溶性灰分为1.05%~1.88%,醇浸出物为18.35%~30.08%。因此,规定该药材的水分、总灰分、酸不溶性灰分分别不得高于12%、22%、2%,醇浸出物不得低于16%。
2.4 含量测定
采用HPLC法测定骆驼蓬药材中骆驼蓬碱和去氢骆驼蓬碱的含量。
2.4.1 溶液的制备 (1)混合对照品溶液:取骆驼蓬碱、去氢骆驼蓬碱对照品各适量,精密称定,加甲醇溶解制成每1 mL分别含骆驼蓬碱301.40 μg、去氢骆驼蓬碱301.80 μg的混合溶液,即得。(2)供试品溶液:取药材样品细粉0.1 g,精密称定,置于具塞锥形瓶中,精密加入甲醇10 mL,密塞,称定质量,超声(功率:250 W,频率:30 kHz)处理45 min,放冷,再用甲醇补足减失的质量,然后以13 000 r/min离心10 min,取上清液,即得。(3)空白对照溶液:以甲醇作为空白对照。
2.4.2 色谱条件与系统适用性考察 色谱柱:X- bridge C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A相)-醋酸铵缓冲液(冰醋酸调节pH至6,B相),梯度洗脱(0~7 min,11%A;7~8 min,11%A→19%A;8~25 min,19%A;25~26 min,19%A→27%A;26~37 min,27%A);检测波长:267 nm;柱温:25 ℃;流速:1 mL/min;进样量:5 μL。取“2.4.1”项下混合对照品溶液、供试品溶液(批号:20180818)按上述色谱条件进样检测。结果,待测成分的分离度均大于1.5,空白溶剂无干扰,理论板数按骆驼蓬碱峰计应不低于3 000,色谱见图4。
2.4.3 线性关系考察 精密量取“2.4.1”项下混合对照品溶液,以甲醇稀释制成骆驼蓬碱质量浓度分别为15.22、30.44、38.05、60.88、152.20、301.40 μg/mL,去氢骆驼蓬碱质量浓度分别为15.09、30.18、37.72、60.36、150.90、301.80 μg/mL的系列混合对照品溶液,按“2.4.2”项下色谱条件进样测定。以对照品溶液的质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得骆驼蓬碱的标准曲线方程为y=7 414.2x-35 968(r=0.998 8),去氢骆驼蓬碱的标准曲线方程为y=15 536x-88 850(r=0.999 0)。结果表明,骆驼蓬碱、去氢骆驼蓬碱质量浓度分别在15.22~301.40、15.09~301.80 μg/mL范围内线性关系良好。
2.4.4 精密度试验 精密称取药材样品(批号:20180818)细粉0.1 g,按“2.4.1(2)”项下方法制备供试品溶液,再按“2.4.2”项下色谱条件连续进样6次。结果,骆驼蓬碱、去氢骆驼蓬碱峰面积的RSD分别为2.40%、3.10%(n=6),表明仪器精密度良好。
2.4.5 重复性试验 精密称取药材样品(批号:20180818)细粉0.1 g,平行6份,按“2.4.1(2)”项下方法制备供试品溶液,再按“2.4.2”项下色谱条件进样测定,并以标准曲线法计算含量。结果,骆驼蓬碱平均含量为10.80 mg/g(RSD=3.76%,n=6),去氢骆驼蓬碱平均含量为5.84 mg/g(RSD=3.62%,n=6),表明本方法重复性良好。
2.4.6 稳定性试验 精密称取药材样品(批号:20180818)细粉0.1 g,按“2.4.1(2)”项下方法制备供试品溶液,分别在室温条件下放置0、4、8、10、12、24 h时,按“2.4.2”项下色谱条件进样测定。结果,骆驼蓬碱、去氢骆驼蓬碱峰面积的RSD分别为0.57%、2.76%(n=6),表明供试品溶液在上述条件下放置24 h稳定性良好。
2.4.7 回收率试验 分别精密称取骆驼蓬碱、去氢骆驼蓬碱对照品各适量,以甲醇溶解制成质量浓度分别为0.304 2、0.288 5 mg/mL的混合对照品溶液。精密称取已准确测得含量的药材样品(批号:20180818)细粉0.06 g,精密称定,置于具塞锥形瓶中,分别加入上述混合对照品溶液适量,制备低、中、高3个浓度样品,均平行3份操作,然后按“2.4.5”项下方法配制供试品溶液、进样测定并计算含量及回收率。结果,骆驼蓬碱平均回收率为100.22%(RSD=0.51%,n=9),去氢骆驼蓬碱平均回收率为100.94%(RSD=1.75%,n=9),表明本方法准确度良好,详见表3。
2.4.8 样品含量测定 取10个批次药材样品细粉各0.1 g,按“2.4.5”项下方法制备供试品溶液、进样测定,并计算样品含量。结果,10批药材的骆驼蓬碱含量范围为2.88~10.80 mg/g,去氢骆驼蓬碱含量范围为5.26~7.43 mg/g;以骆驼蓬碱、去氢骆驼蓬碱的含量之和计算总生物碱含量,结果详见表4。
由表4可见,10批次骆驼蓬草药材的总生物碱含量为8.28~16.64 mg/g,故拟定该药材总生物碱含量(以骆驼蓬碱、去氢骆驼蓬碱合计)不得低于6.5 mg/g。
3 讨论
3.1 TLC法鉴别条件筛选
骆驼蓬草中主要含有生物碱类、黄酮类等成分,本研究初步建立了鉴别药材中骆驼蓬碱和去氢骆驼蓬碱的TLC法,考察了乙酸乙酯-甲醇(4 ∶ 1,V/V)、乙酸乙酯-甲醇-氨水(20 ∶ 5 ∶ 1,V/V/V)等展开系统。结果显示,乙酸乙酯-甲醇-氨水(20 ∶ 5 ∶ 1,V/V/V)为展开系统时分离效果较好[7,15]。
3.2 HPLC法含量测定色谱条件优化
本研究考察了在乙腈-0.1%醋酸体系、乙腈-0.1%磷酸(三乙胺)体系、乙腈-醋酸铵(0.1%醋酸)体系等流动相下的分离效果。结果显示,乙腈-醋酸铵(0.1%醋酸)体系为流动相时色谱峰分离效果最佳,同时对色谱柱柱效的影响较小,故确定该流动相为本研究含量测定色谱条件。
3.3 不同样品中骆驼蓬碱和去氢骆驼蓬碱的含量分析
本研究通过含量测定发现,哈萨克地区不同产地骆驼蓬草中骆驼蓬碱和去氢骆驼蓬碱含量差异较大,其中以新疆伊犁哈萨克自治州伊宁市伊宁县潘津乡和察县24公里处收集样品的含量最高;10批次药材中骆驼蓬碱含量范围为2.88~10.80 mg/g,去氢骆驼蓬碱含量范围为5.26~7.43 mg/g,这可能与其不同的生长环境及采收时间等因素有关。
据文献报道,骆驼蓬碱和去氢骆驼蓬碱等β-咔啉类生物碱主要分布于骆驼蓬种子中;而茎叶、种壳等部位除主要含有鸭嘴花碱等喹唑啉类生物碱成分外,还含有较多的黄酮类成分[13,16]。本研究仅对2种β-咔啉类生物碱进行了定量控制,尚未全面研究骆驼蓬草中喹唑啉类生物碱以及黄酮类成分含量。但是本研究实现了不同成分(保留时间分别约為6、11、15、19、21、27 min)的色谱分离,然而受标准对照物质缺乏等因素限制,暂未全面对其进行定性鉴别和定量控制,后续拟结合质谱学技术对上述成分作进一步研究。
骆驼蓬属植物在我国境内主要共有3种,分别为骆驼蓬、骆驼蒿、多裂骆驼蓬。总体而言,在新疆较多的是骆驼蓬;在青海和甘肃中部及东部黄土高原多为多裂骆驼蓬;在内蒙古、宁夏、陕西北部及河西走廊的大部分地区则同时分布有2~3种骆驼蓬属植物;骆驼蓬草主产地依然是新疆[17-19]。本文系在深度开发哈萨克传统制剂祛风阿德尔阿斯盘蜜膏过程中总结而来,而哈萨克族当地即采用新疆地区骆驼蓬草入药,故本研究采集的骆驼蓬草样品仅来自于新疆哈萨克地区。后续将收集我国境内不同产地骆驼蓬草进行比较,以期进一步完善该药材的质量标准。
综上所述,本研究在原标准基础上增加了骆驼蓬草药材的水分、总灰分、酸不溶性灰分、浸出物等检查项,建立了TLC法鉴别骆驼蓬碱、去氢骆驼蓬碱和HPLC法测定两者含量的方法,提升了《卫生部药品标准(维吾尔药分册)》收载的原骆驼蓬草质量标准,可为该药材的全面质量控制提供依据。
参考文献
[ 1 ] 伊努艳·赛都拉木,江阿古丽·艾山,木拉提·克扎衣别克,等.哈萨克医药学发展现状、存在问题及对策[J].中国民族民间医药,2017,26(16):1-4.
[ 2 ] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:57、104、202、204.
[ 3 ] 昂沙尔·塔力道,地达尔·巴合提坚,拉扎提·吐尔逊拜,等.哈医祛风巴布膏中3种成分的含量测定及其抗炎镇痛作用[J].中国医院药学杂志,2016,36(5):361-365.
[ 4 ] 古丽娜尔·叶尔森那力,木拉提·克扎衣别克,江阿古丽·艾山,等.HPLC法同时测定哈医祛风膏中去氢骆驼蓬碱和骆驼蓬碱的含量及疗效观察[J].世界中医药,2015,10(8):1246-1249.
[ 5 ] 王长虹,刘军,郑立明,等.不同产地骆驼蓬不同药用部位中生物碱的含量分析[J].中国药学杂志,2002,37(3):53-57.
[ 6 ] 孙晓惠,胡慧华,陆锦锐.北京及新疆产骆驼蓬中两种生物碱的含量比较[J].黔南民族医专学报,2017,30(1):1-5.
[ 7 ] 温方方,郑立明,李晓静,等.维药骆驼蓬草质量标准研究[J].中国中药杂志,2012,37(19):2971-2976.
[ 8 ] 韦悦,程娟娟,程雪梅,等.维吾尔药复方木尼孜其颗粒剂的质量控制方法研究[J].药物分析杂志,2017,37(10):1799-1809.
[ 9 ] 马亭云,姜继宗,张刘红,等.去氢骆驼蓬碱醇质体的制备及处方优化[J].中国实验方剂学杂志,2018,24(8):34- 39.
[10] 孙殿甲,李岩.骆驼蓬及其主要有效成分去氢骆驼蓬碱的研究进展[J].新疆医科大学学报,2003,26(2):125-128.
[11] LI S,WANG A,GU F,et al. Novel harmine derivatives for tumor targeted therapy[J]. Oncotarget,2015,6(11):8988-9001.
[12] 张婷,蒋世烨,金星星,等.骆驼蓬碱对胃癌细胞增殖、凋亡的影响及其机制研究[J].胃肠病学,2018,23(4):221-225.
[13] 王嘉乐,魏丽,鲍红琴.骆驼蓬生物碱抗炎和免疫调节的药理作用机制研究进展[J].上海中医药杂志,2019,53(2):97-100.
[14] 卫生部药典委员会.中华人民共和国卫生部药品标准:维吾尔药分册[S].乌鲁木齐:新疆科技卫生出版社,1998:80-81.
[15] 排孜也提·排孜拉,程雪梅,滕亮,等.骆驼蓬生物碱乳膏剂的质量标准研究[J].中国药师,2015,18(11):1864- 1870.
[16] 任丽君,李岩,孙婷,等.复方骆驼蓬子水凝胶贴剂透皮吸收促进剂的筛选[J].中国药师,2016,19(10):1834-1836.
[17] 马骥,王勋陵.中国荒漠地区骆駝蓬属植物种类与分布[J].中国沙漠,1998,18(2):36-41.
[18] 马骥,董剑利.骆驼蓬属主分量及模糊聚类分析[J].甘肃科学学报,1998,10(2):21-25.
[19] 杨旭,陆嘉惠,陈晓翠,等.荒漠植物骆驼蓬的繁殖生物学特性研究[J].石河子大学学报(自然科学版),2018,36(1):81-88.
(收稿日期:2019-04-06 修回日期:2019-08-26)
(编辑:段思怡)

