Cu胁迫下基质中凹凸棒石粘土对当归幼苗的保护作用
张牡丹 赛闹汪青 冉瑞兰





摘 要:在含有不同比例凹凸棒石粘土的混合基質中(凹凸棒石粘土∶基质的体积比分别为0∶1、1∶100、1∶70、1∶50、1∶20)培育当归幼苗,以研究Cu胁迫对当归幼苗的生理学影响及凹凸棒石粘土对Cu胁迫下当归幼苗的保护作用。结果表明:(1)基质中不存在凹凸棒石粘土时,随着CuCl2处理浓度的上升,当归幼苗叶片的实际光化学效率 [Y(Ⅱ)]、PSⅡ电子传递速率(ETR)、光化学淬灭(qP)和叶绿素含量都逐渐降低;而叶片的非光化学猝灭(qN)、可溶性蛋白含量、抗氧化酶活性(SOD、POD、CAT、APX)、过氧化氢含量以及根和叶片中的Cu含量均显著性增加,表明Cu胁迫降低了当归幼苗的光化学效率、叶绿素的合成、增加了组织中Cu含量和氧化压力。(2)CuCl2胁迫下,当基质中存在不同比例的凹凸棒石粘土时,Cu胁迫所导致的叶片Y(Ⅱ)、ETR、qP及叶绿素含量的降低以及叶片qN、可溶性蛋白含量、抗氧化酶活性、过氧化氢含量、根和叶片的Cu含量的升高均有所缓解,说明凹凸棒石粘土通过吸附或固定基质中游离的以及可交换的Cu离子,减少了当归幼苗对有效Cu离子的吸收,从而缓解了Cu离子对植物造成的生理学压力,且这种缓解作用依次为1∶70 > 1∶50 > 1∶20 ≥ 1∶100 > 0∶1,这是基质中存在过多的凹凸棒石粘土时,其在吸收基质中Cu离子的同时也会影响基质的通气性、透水性和酸碱度等。这表明凹凸棒石粘土在基质中的适当加入能缓解Cu胁迫对当归幼苗造成的的生理学压力。
关键词:当归幼苗, 铜胁迫, 凹凸棒石粘土, 氧化压力, 缓解作用
中图分类号:Q945.78
文献标识码:A
文章编号:1000-3142(2019)04-0453-11
Abstract:Seeds of Angelica sinensis were planted in a matrix containingdifferent proportions of attapulgite clay (the volume ratio of attapulgite clay and matrix was 0∶1, 1∶100, 1∶70, 1∶50, 1∶20) to study the physiological effects of Cu stress on A. sinensis seedlings and the protective effect of attapulgite clay on A. sinensis seedlings under CuCl2 stress. The results were as follows:(1) With the increase of exogenous CuCl2 concentration, Y(Ⅱ) (PS Ⅱ operation efficiency), ETR (rate non-cyclic electron transport throughPS Ⅱ ), qP (photochemical quenching), and chlorophyll content of leaves of A. sinensis seedlingsdecreased, while the qN (non-photochemical quenching), soluble protein content, activities of antioxidant enzymes (SOD, POD, CAT, and APX), the content of H2O2and the CuCl2 content in the leaves and roots increased significantly. The results showed that the Cu stressdecreased in both photochemical efficiency and chlorophyll synthesis of A. sinensis seedlings, and increased the content of Cu and oxidation pressure in tissues. (2) Under Cu stress, the presence of attapulgite clay in the growth matrix could alleviate the copper-stress-induceddecreases in the Y(Ⅱ), qP, ETR, and chlorophyll content of the leaves, and could alleviate the copper-stress-induced increases of the qN, soluble protein content, activities of antioxidant enzymes, content of H2O2 as well as copper contents in the leaves and roots. Our results indicate that the attapulgite clay can reduce the absorption of available Cu2+ by adsorbing or immobilizing free and exchangeable Cu2+ in the matrix, thus relieving the physiological pressure caused by Cu2+ on plants, which is propitious to its growth. And in the order of the mitigation is 1∶70 > 1∶50 > 1∶20 ≥ 1∶100 > 0∶1, this isdue to the fact that when there is too much attapulgite clay in the matrix, the absorption of Cu2+ in the matrix will also affect the original physical properties of the matrix such as aeration, permeability and pH and so on. These results together manifest that the attapulgite clay in the matrix can alleviate the copper-induced physiological stress on A. sinensis seedlings.
Key words:Angelica sinensis seedlings, copper stress, attapulgite clay, oxidant pressure, alleviation effect
当归(Angelica sinensis)为伞形科植物,在中国传统医学中,其根可用于补益血液,润肠,治疗月经失调、虚寒腹痛、风湿痹痛、跌扑损伤,并作为慢性泻药来治疗体弱老人的便秘(Wei et al., 2009;Fang et al.,2012)。目前,当归在甘肃、四川、云南、湖北等地都有栽培,其中以甘肃省栽培面积最大,主要分布在甘肃省岷山山脉东支南北两面山麓地区(邱黛玉等,2010)。
铜(Cu)作为植物必需的微量元素,其在蛋白质构成、光合电子传递和细胞壁的新陈代谢等方面起着重要作用(Guerrero,2005)。然而,过量的Cu离子则会对植物的生长和发育产生不良影响。Maksymiec & Krupa(2006)发现,在重金属Cu胁迫早期,植物组织中的H2O2含量和抗氧化酶活性增加,表明过量的Cu会引起植物细胞的氧化压力。同时,谢佳佳等(2018)研究表明,Cu胁迫还会阻碍植物的光合作用和影响叶绿素的合成。Kopittke et al.(2006)进一步的研究表明,这些Cu胁迫所引起的生理学的变化最终会引起植物的生长发育受阻,甚至造成植物死亡。近年来,Cu离子对环境污染较为严重(Sharma & Agrawal, 2005;谢佳佳等,2018),尤其是铜矿导致的水土污染(Li et al.,2008;赵静,2009)以及含铜杀虫剂(如波尔多液,Cu离子含量在1.5 g·L-1)(Druart et al.,2012)的大量施用使环境中的植物遭受严重的Cu离子胁迫。因此,研究Cu胁迫对植物(特别是对重金属有着严格标准的药用植物)的生理学影响具有重要意义。然而,Cu胁迫对植物生理学影响的研究多集中于拟南芥等模式植物或重要作物中,而其对当归等药用植物影响的研究则鲜有报道。
如何有效降低Cu离子对植物的影响也是目前研究的热点问题。凹凸棒石粘土,简称凹土,是一种具有土和石特性的非金属矿质资源(胡涛等,2005)。凹凸棒石粘土可通过吸收、离子交换等多种形式减少环境中游离的重金属离子,且其成本低廉(魏荣道和崔峤,2005;朱海清和周杰,2004)。目前,已有研究利用凹凸棒石粘土对Pb、Cu、Cd等污染的生态环境进行修复(王成等,2016;杨秀敏和胡桂娟,2004;谭科艳等,2011),发现凹凸棒石粘土能够吸附和固定基质中游离的重金属,从而保护生态环境。基于凹凸棒石粘土的这一特性,在栽培基质中加入凹凸棒石粘土有可能缓解Cu胁迫对当归等药用植物产生的不良影响。然而,这方面的研究在国内外未见报道。
基于以上原因,本研究以当归幼苗为材料,研究了在短期重金属Cu的胁迫下,当归幼苗的生理学变化以及凹凸棒石粘土对Cu胁迫的缓解作用,以期能进一步丰富凹凸棒石粘土在农学研究领域的应用,并对如何减少重金属离子对植物的毒害作用提供一定的借鉴和参考。
1 材料与方法
1.1 材料
1.1.1 植物材料的培养 供试验材料当归(Angelica sinensis)品种为岷当归。种子用蒸馏水冲洗4次,并用1%的NaClO消毒处理10 min,然后用蒸馏水清洗8次以除去种子表面残存的NaClO。之后将种子放在铺有双层纱布的培养皿中,在25 ℃培养箱中培养催芽。7d后,挑选发芽一致的种子栽种于不同比例的混合基质中(凹凸棒石粘土:基质的体积比分别为0∶1、1∶100、1∶70、1∶50、1∶20,且各混合基质的总体积相等,下同),并浇灌1/2倍的Hoagland营养液至基质完全湿润,在25 ℃、200 μmol · m-2 · s-1光强条件下进行生长,待子叶展开后每隔3d浇一次营养液。
1.1.2 材料处理 选取30d苗龄、长势一致的當归幼苗作为供试验材料进行如下两个实验:(1)分别用60 mL浓度为5、15、25、35 mmol·L-1的CuCl2溶液[参考赵静(2009)报道设立Cu污染浓度)施加于基质中(该基质不含有凹凸棒石粘土)],对照组加等量蒸馏水,处理24 h后进行相关指标测量(不同处理单独取样4个,各指标均重复3次,下同)。(2)用60 mL 25 mmol·L-1 CuCl2溶液施加于各混合基质中(凹凸棒石粘土∶基质体积比分别为0∶1、1∶100、1∶70、1∶50、1∶20),对照组加等量蒸馏水,继而在培养室培养24 h后进行相关指标的测量。
1.2 研究方法
1.2.1 叶绿素荧光相关系数的测定 参照Genty et al.(1989)、Flexas et al.(1999)、Hazrati et al.(2016)的方法,用调制叶绿素荧光成像系统——IMAGING-PAM对当归幼苗进行测定,具体测定步骤如下:连接仪器,仪器正常运行后测得暗适应状态的初始荧光(Fo)和最大荧光(Fm),当所测材料在作用光下的实时荧光(Fs)达到稳态(20 s)后打开饱和脉冲光,测得最大荧光(Fm′),再打开远红外光,测光最小荧光(Fo′)。公式如下:光适应下实际光化学效率[Y(Ⅱ)]=(Fm′-Fs)/Fm′;电子传递速率(ETR)=[(Fm′-Fs)/Fm′]×PAR×0.5×0.84;光化学猝灭(qP)=(Fm′-Fs)/(Fm′–Fo′); 非光化学猝灭(qN)=(Fm′-Fo′)/(Fm-Fo),测量结束后导出记录。
1.2.2 叶绿素含量的测定 当归幼苗叶片的叶绿素含量根据Arnon(1949)所报道的方法进行。称取真叶0.02 g切碎,置于5 mL的离心管中,加入4 mL 80%的丙酮提取液,黑暗浸提至叶片发白(4 ℃),摇匀后取浸提液3 mL于比色杯中,在645 nm和663 nm波长下测定吸光值,并计算叶绿素含量。
1.2.3 可溶性蛋白含量的测定 当归幼苗叶片的可溶性蛋白含量参照赵英永等(2016)描述的方法进行。称取当归幼苗真叶0.01 g放入研钵中,加4 mL蒸馏水研磨成匀浆,放置30 min后在4 000 r·min-1离心20 min,弃去沉淀,上清液转入另一离心管,并以蒸馏水定容所得提取液。吸取提取液1 mL,加入5 mL考马斯亮蓝G-250蛋白溶液,充分混合,放置2 min后,在595 nm下测定吸光值,并依标准曲线计算蛋白质含量(mg·g-1)。
1.2.4 抗氧化酶活性和过氧化氢含量的测定 用Nishikimi et al.(1972)的氮蓝四唑(NBT)还原法测定超氧化物歧化酶(SOD)活性;用Fernández et al.(2013)和Martins et al.(2011)的愈创木酚法测定过氧化物酶(POD)活性;用Chance & Maehly (1995)的方法测定过氧化氢酶(CAT)活性;参照Nakano & Asada(1981)的方法测定抗坏血酸过氧化酶(APX)的活性;用Ferguson et al.(1983)的方法测定过氧化氢酶含量。
1.2.5 植物组织中铜含量的测定 为了测定Cu的含量,用70% HNO3溶液微波下消解植物材料(当归幼苗的根和叶),根据Chen et al.(2004)的报道,
采用电感耦合等离子体原子发射光谱法进行分析。
1.3 统计学分析
采用Excel和Origin统计软件完成试验原始数据的处理和制图,并将数值表示为平均值±标准偏差。数据采用双尾总体t检验,以P<0.05表明在统计学上有显著性差异。
2 结果与分析
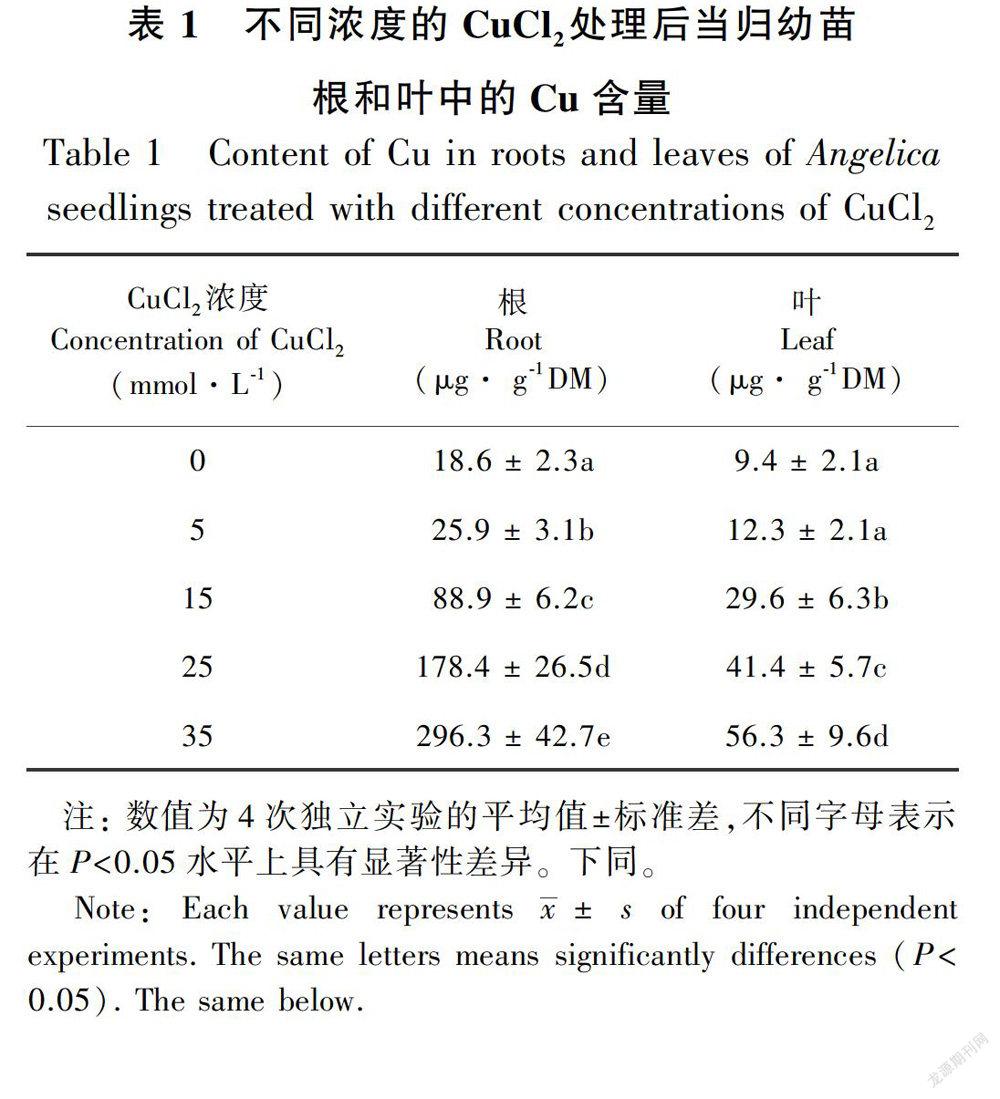
2.1 不同浓度的CuCl2处理对当归幼苗组织中的Cu含量的影响
表1结果表明,随着CuCl2浓度的上升,当归幼苗根和叶片中的Cu含量增加。当CuCl2的浓度为5 mmol·L-1时,当归幼苗叶片中的Cu含量和对照相比没有显著性差异,而根中的Cu含量和对照相比已有显著性差异;CuCl2浓度达到15 mmol·L-1,叶片中的Cu含量和对照相比显著性升高。这表明CuCl2胁迫导致植物根和叶中积累了大量的Cu,且随着CuCl2浓度的上升,Cu在当归幼苗的根和叶中的积累越多。
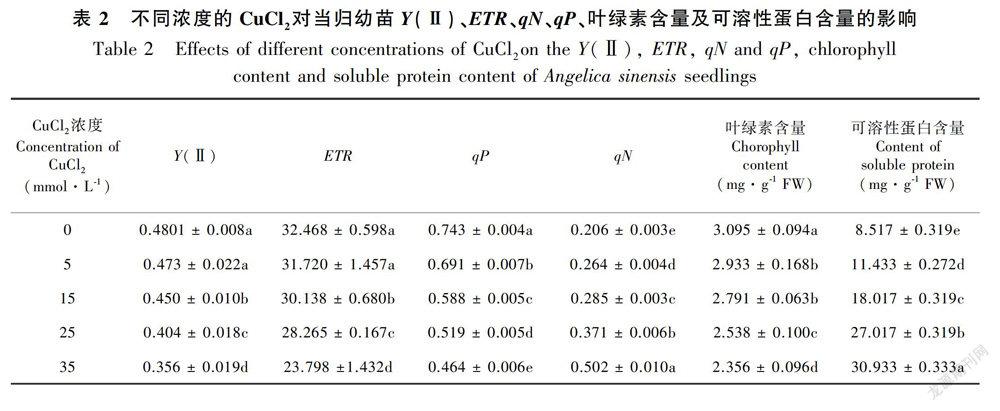
2.2 不同浓度的CuCl2对当归幼苗叶片叶绿素荧光参数、叶绿素含量及可溶性蛋白含量的影响
当归幼苗根和叶片中的Cu含量随CuCl2浓度的升高而显著性上升(表1)。由表2可知,用5 mmol·L-1的CuCl2处理后,当归幼苗Y(Ⅱ)、ETR与对照相比无显著性变化;当CuCl2的浓度升高至15 mmol·L-1时,当归幼苗的Y(Ⅱ)、ETR均显著性下降,并随CuCl2浓度的升高而进一步下降。较之Y(Ⅱ)和ETR,qP和qN对于CuCl2胁迫更加敏感,与对照相比,当归幼苗随CuCl2浓度的升高,qP显著性下降,qN显著性上升(表2)。说明外源CuCl2浓度的升高不仅仅使得根细胞中Cu含量上升,且過量的Cu可以导致光合电子传递链中QB结合蛋白以及PSⅡ氧化侧或还原侧一些电子传递相关蛋白结构的改变,从而导致PSⅡ电子传递的紊乱(卫丹丹,2016;Baker et al.,1988;Amina et al.,2013),最终导致叶片中Cu的积累以及PSⅡ反应中心开放比例、 激发能捕获效率以及运行效率的下降,进而通过影响PSⅡ中电子传递体的功能而导致当归叶片叶绿素荧光参数的变化。此外,研究进一步发现,伴随当归幼苗叶片中的Cu含量和叶绿素荧光的变化,叶绿素含量随之降低(表2),推测这可能是Cu取代了叶绿素中的 Fe2+、Zn2 +、Mg2+等离子,致使叶绿素中心离子组成发生变化而失活,从而使叶绿素含量降低(Rousos & Harrison,1987;Liu et al.,2008;彭向永和宋敏,2011;薛盈文等,2016)。由于叶绿素的含量也影响着PSⅡ的光能利用率(杨扬等,2016;冯鹏等,2016),因此,CuCl2所造成的叶绿素荧光参数的变化应该是PSⅡ中电子传递体的功能改变以及叶绿素结构破坏综合作用的结果。
可溶性蛋白含量作为一种渗透调节物质在植物抵御逆境胁迫中起重要作用,它的变化可作为一项生理指标反映外界环境对植物的影响(鲍思伟等,2001;陈明涛等,2010)。研究发现,随CuCl2浓度的升高,当归幼苗叶片的可溶性蛋白含量与对照相比显著性增加,表明CuCl2胁迫对当归幼苗叶片的蛋白质代谢造成了影响。
2.3 不同浓度的CuCl2对当归幼苗叶片抗氧化酶活性和过氧化氢含量的影响作用
SOD、POD、CAT及APX是活性氧清除系统中的关键酶,能保护细胞免受氧化压力的损伤;同时,其活性的变化是表征植物抗氧化压力的重要指标(龚双姣等,2008;孙卫红等,2005),例如,SOD可以有效阻止活性氧对细胞膜产生的伤害(Cakmak & Horst, 2006; Kornyeyev et al., 2001);POD 作为活性较高的适应性酶,能反映植物体内代谢状况以及对外界环境的适应性(周超凡等,2016);APX 和 CAT 属于不同的 H2O2清除酶类别(Mittler, 2002);同时,H2O2含量的增加,可表明植物细胞受到了环境胁迫(Qrozco-Cárdenas et al., 2001; Foyer & Noctor, 2003; Knight, 2004)。本研究发现,与对照相比,随CuCl2浓度的升高,当归幼苗叶片的抗氧化酶活性(SOD、POD、CAT、APX)均显著性增加,SOD分别增加了1.4倍、1.9倍、2.5倍、3.3倍;POD分别增加了1.9倍、3.4倍、6.2倍、7.8倍;CAT分别增加了2.2倍、3.2倍、5.7倍、6.7倍;APX分别增加了2.0倍、3.0倍、3.1倍、4.1倍(表3)。同时,与对照相比,随CuCl2浓度的上升,当归幼苗叶片中的H2O2含量也依次增加。可见,栽培基质中过量的Cu对当归幼苗产生了生理学压力。
2.4 CuCl2胁迫下基质中凹凸棒石粘土对当归幼苗组织中Cu含量的影响
本研究结果表明,Cu胁迫下当归幼苗根和叶片均受到了不良影响。而在25 mmol·L-1的CuCl2胁迫下,当归幼苗的生理学参数均明显改变,而且该浓度的Cu离子含量和波尔多液中的Cu离子含量近似。因此,在进一步的研究中,我们将生长于混合基质(凹凸棒石粘土∶基质的体积比分别为0∶1、1∶100、1∶70、1∶50、1∶20)的当归幼苗置于25 mmol·L-1的CuCl2胁迫下,并将上述的生理学参数进行对比,以判断基质中凹凸棒石粘土的添加能否缓解CuCl2对当归幼苗造成的生理学压力。
本研究首先对CuCl2胁迫后当归幼苗根和叶中Cu含量进行测定(表4)。表4结果表明,在CuCl2处理下,当凹凸棒石粘土与基质的比值为1∶100时,当归幼苗根和叶中的Cu含量和不含凹凸棒石粘土的基质中生长的植株相比无显著性差异;随着凹凸棒石粘土在基质中含量的增加,当归幼苗根和叶中的Cu含量和不含凹凸棒石粘土的基质中生长的植株相比呈现出显著性递减。这可能是因为凹凸棒石粘土通过吸收、离子交换等形式减少了基质中游离的Cu离子所导致的。
2.5 CuCl2胁迫下基质中凹凸棒石粘土对当归幼苗叶绿素荧光及叶绿素含量的影响
测量发现,在CuCl2脅迫下,和不含凹凸棒石粘土的基质相比,基质中存在凹凸棒石粘土可使当归幼苗叶片的Y(Ⅱ)、ETR和qP有所上升,同时使qN有所下降(图1)。表明,添加凹凸棒石粘土可以吸附基质中过量的Cu离子,阻止了Cu离子对光合电子传递链中QB结合蛋白以及PSⅡ氧化侧或还原侧一些电子传递相关蛋白结构的改变,减轻了PSⅡ电子传递的紊乱程度,从而缓解了CuCl2胁迫对PSⅡ的不良影响。进一步的观察发现,基质中凹凸棒石粘土的比例从1∶100增加到1∶70时,凹凸棒石粘土缓解CuCl2对PSⅡ造成的不良影响的作用也随之增强;但随着基质中凹凸棒石粘土比例的进一步增加,该作用仍然存在,但是和含有1∶70凹凸棒石粘土的基质相比较,其缓解CuCl2对PSⅡ的不良影响的作用有所减弱,且其缓解作用依次为1∶70>1∶50>1∶20>1∶100>0∶1,这可能是由于过多的凹凸棒石粘土在吸收基质中Cu离子的同时也影响了基质的通气性、透水性和酸碱度等多种理化因素,其具体原因需要进一步查明(下同)。
如图2所示,在CuCl2胁迫下,和不含凹凸棒石粘土的基质相比,在基质中存在1∶70和1∶50的凹凸棒石粘土可以使叶绿素含量显著性上升。其中,基质中凹凸棒石粘土比例为1∶70时这种作用最为明显。表明,添加凹凸棒石粘土能够通过吸附或固定基质中游离的Cu,从而减少叶绿素中的 Fe2+、Zn2 +、Mg2+等被Cu2+所取代,即减少了叶绿素中心离子组成的变化或失活程度,进而缓解了CuCl2胁迫对叶绿素合成造成的抑制作用。
2.6 CuCl2胁迫下基质中凹凸棒石粘土对当归幼苗的可溶性蛋白含量、抗氧化酶活性和过氧化氢含量的影响
3 讨论与结论
本研究中,CuCl2胁迫导致当归幼苗的Y(Ⅱ)、ETR、qP以及叶绿素含量下降,说明Cu胁迫使叶片PSⅡ的容量和PSⅡ在光下运行效率降低,同时使PSⅡ接受和传递电子的能力也下降。和上述变化相应的是,表征能量耗散的qN在CuCl2胁迫下显著性升高,表明了CuCl2胁迫使得更多的光能无法用于光反应,而以热的形式耗散掉(谢佳佳等,2018)。同时,随着植物组织中Cu含量的积累,当归叶片中的可溶性蛋白含量、抗氧化酶活性以及过氧化氢含量显著性升高(表1、表3、表4),表明Cu胁迫对当归叶片产生了严重的生理压力。
如上文所述,凹凸棒石粘土对重金属离子具有良好的吸附性能(胡涛等,2005;魏荣道和崔峤,2005),可通过吸附或离子交换原理在栽培基质中固定一部分重金属元素,从而降低植物对重金属的吸收量(谭科艳等,2011)。因此我们研究了基质中凹凸棒石粘土的添加能否有效缓解Cu胁迫对当归幼苗造成的上述生理学压力。在进一步的研究中,我们将生长于混合基质(凹凸棒石粘土∶基质的体积比分别为0∶1、1∶100、1∶70、1∶50、1∶20)的当归幼苗置于25 mmol·L-1的CuCl2胁迫下(该浓度的Cu离子含量和波尔多液中的Cu离子含量近似),并将上述的生理学参数进行对比。实验发现,在CuCl2胁迫下,和不含凹凸棒石粘土的基质相比,含凹凸棒石粘土的基质使得当归幼苗中的Cu含量、可溶性蛋白含量、抗氧化酶活性(SOD、POD、CAT、APX)及过氧化氢含量显著性降低,同时也使得光化学效率和叶绿素含量升高,说明在基质中添加凹凸棒石粘土能缓解Cu离子对当归幼苗造成的生理压力,提示了凹凸棒石粘土应是通过吸附或固定基质中游离的以及可交换的Cu离子,通过减少当归幼苗对有效Cu离子的吸收,从而缓解Cu离子对植物造成的生理学压力。值得注意的是,CuCl2胁迫下,尽管基质中凹凸棒石粘土比例的上升能够不断降低植物组织中Cu的积累,但凹凸棒石粘土对其他生理学压力的缓解作用没有呈现出绝对的平行性关系。从整体数据分析来看,基质中凹凸棒石粘土比例低于1∶70时,凹凸棒石粘土缓解CuCl2对当归幼苗产生的生理压力的作用随凹凸棒石粘土比例的上升而随之增强,但其比例高于1∶70时,凹凸棒石粘土仍然能够在不同程度上缓解CuCl2对当归幼苗产生的生理学压力,然而,这种作用随着基质中凹凸棒石粘土比例的上升在不同程度上有所减弱,且凹凸棒石粘土与基质的这种缓解作用的体积比依次为1∶70>1∶50>1∶20≥1∶100>0∶1。这可能是由于基质中存在过多的凹凸棒石粘土时,其在吸收基质中Cu离子的同时也影响了基质的通气性、透水性和酸碱度等(谭科艳等,2011),其具体原因需要进一步查明。
综上所述,适量的凹凸棒石粘土在一定程度上能够缓解CuCl2胁迫对植物所造成的生理学压力。在大田种植当归的过程中,添加凹凸棒石粘土能够缓解重金属对当归的毒害作用,且当凹凸棒石粘土与栽培基质的体积比为1∶70时,这种缓解作用最佳。
参考文献:
AMINA B, REDAdM, RACHID R, et al., 2013. Physiological and biochemical changes observed in alternative cellular model:Paramecium tetraurelia treated with paracetamol [J]. Int J Biosci, 9(3):132-141.
ARNONdI, 1949. Copper enzymes in isolated chloroplasts. Polyphenoloxidase in Beta vulgaris [J]. Plant Physiol, 24(l): 1.
BAKER J,dENNSTEELE CV,dURE L, 1988.Sequence and characterization of 6 Lea proteins and their genes from cotton [J]. Plant Mol Biol, 11( 3):277-291.
BAO SW, TAN F, LIAO ZH, 2001. Effects of soildrought on the osmoregulating ability of Vicia faba leaves [J]. J SW Agric Univ, 23 (4):353-359. [鮑思伟, 谈 锋, 廖志华, 2001. 土壤干旱对蚕豆叶片渗透调节能力的影响 [J]. 西南农业大学学报, 23(4):353-359.]
BOULASSEL A,dJEBAR MR, ROUABHI R, et al., 2013. Physiological and biochemical changes observed in alternative cellular model:Paramecuim tetraurelia treated with paracetamol [J]. Int J Biol, 3(9):132-141.
CAKRNMAK I, HORST WJ, 2006. Effect of aluminium on lipid peroxidation, superoxidedismutase, catalase, and peroxidase activities in root tips of soybean (Glycine max) [J]. Physiol Plant, 83(3):463-468.
CHANCE B, MAEHLY AC, 1995. Assay of catalase and peroxidase [J]. Meth Enzymol, 2:764-775.
CHEN CT, CHEN TH, LO KF, et al., 2004. Effects of proline on copper transport in rice seedlings under excess copper stress [J]. Plant Sci, 166:103-111.
CHEN MT, ZHAO Z, QUAN JE, 2010. Variation of soluble protein components and contents in seedling root tips of four trees underdrought stress [J]. Acta Bot Boreal-Occident Sin, 30(6):1157-1165. [陈明涛, 赵忠, 权金娥, 2010. 干旱对4种苗木根尖可溶性蛋白组分和含量的影响 [J]. 西北植物学报, 30(6):1157-1165.]
DRUART C, SCHEIFLER R, MILLET M, et al., 2012. Landsnail eggs bioassays:A new tool to assess embryotoxicity of contaminants in the solid, liquid or gaseous phase of soil [J]. Appl Soil Ecol, 53(1):56-64.
FANG L, XIAO XF,LIU CX, et al., 2012. Recent advance in studies on Angelica sinensis [J]. Chin Herb Med, 4(1):12-25.
FENG P, SUN L, SHEN XH, et al., 2016. Response and enrichment ability of Perennial ryegrass under lead and cadumium stress [J]. Acta Pratac Sin, 25(1):153-162. [冯鹏, 孙力, 申晓慧, 等, 2016. 多年生黑麦草对Pb、Cd胁迫的响应及富集能力研究 [J]. 草业学报, 25(1):153-162.]
FERGUSON IB, WATKINS CB, HARMAN JE, 1983. Inhibition by calcium of senescence ofdetached cucumber cotyledons:Effect on ethylene and hydroperoxide production [J]. Plant Physiol, 71(1):182-186.
FERNNDEZ R, BERTRAND A, REIS R, et al., 2013. Growth and physiological responses to cadmium stress of two populations of Dittrichia viscosa(L.) Greuter [J]. J Hzar Mater, 244-245(2):555-562.
FLEXAS J, ESCALONA JM, MEDRANO H, 1999. Water stress inducesdifferent levels of photosynthesis and electron transport rate regulation in grapevines [J]. Plant Cell Environ, 22(1):39-48.
FOYER CH, NOCTOR G, 2003. Redox sensing and signalling associated with reactive oxygen in chloroplasts, peroxisomes and mitochondria [J]. Physiol Plant, 119(3):355-364.
GENTY B, BRIANTAIS JM, BAKER NR, 1989. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence [J]. Biochim Biophys Acta, 990(1):87-92.
GONG SJ, MA TW, JIANG YF, et al., 2008. Antioxidant enzyme activities induced by Cadmium stress in three species of Mosses [J]. Acta Bot Boreal-Occident Sin, 28(9):1765-1771. [龔双姣, 马陶武, 姜业芳, 等, 2008. 镉胁迫下3种藓类植物抗氧化酶活性变化的比较研究 [J]. 西北植物学报, 28(9):1765-1771.]
GUERRERO IY, 2005. Copper in plants [J]. Braz J Pl Physio, 17(1).
HAZRATI S, TAHMASEBI-SARVESTANI Z, MODARRES-SANAVY SA, et al., 2016. Effects of water stress and light intensity on chlorophyll fluorescence parameters and pigments of Aloe vera L. [J]. Plant Physiol Biochem, 106:141-148.
HU T, QIAN YH, JIN YL, et al., 2005. Study on the application of attapulgite clay [J] . China Min Maga, 14 (10):73-76. [胡涛, 钱运华, 金叶玲, 等, 2005. 凹凸棒土的应用研究 [J]. 中国矿业, 14(10):73-76.]
KNIGHT MR, 2004. Oxidative stress-induced Calcium signaling in Arabidopsis [J]. Plant Physiol, 135(3):1471-1479.
KOPITTKE PM,dART PJ, MENZIES NW, 2006. Effect of Cu on the growth and nodulation of Cowpea (Vigna unguiculata) [C]// World congress of soil science-frontiers of soil science [J]. Int Union Soil Sci, 1-1.
KORNYEYEVd, LOGAN BA, PAYTON P, et al., 2001. Enhanced photochemical light utilization anddecreased chilling-induced photoinhibition of photosystem Ⅱ in cotton overexpressing genes encoding chloroplast-targeted antioxidant enzymes [J]. Physiol Plant, 113(3):323-331.
LI H, GUO A, WANG H, 2008. Mechanisms of oxidative browning of wine [J]. Food Chem,108(1):1-13.
LIU SH, LIU XH, HOU J, et al., 2008. Study on the spectral response of Brassica Campestris L. leaf to the copper pollution [J]. Sci China , 51(2):202-208.
MAKSYMIEC W, KRUPA Z, 2006. The effects of short-term exposition to Cd, excess Cu ions and jasmonate on oxidative stress appearing in Arabidopsis thaliana [J]. Environ & Ex Bot, 57(1-2):187-194.
MARTINS LL, MOURATO MP, CARDOSO AI, et al., 2011. Oxidative stress induced by cadmium in Nicotiana tabacum L.:Effects on growth parameters, oxidativedamage and antioxidant responses indifferent plant parts [J]. Acta Physiol Plant, 33(4):1375-1383.
MITTLER R, 2002. Oxidative stress, antioxidants and stress tolerance [J]. Trends Plant Sci, 7(9):405.
NAKANO Y, ASADA K, 1981. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in Spinach chloroplasts [J]. Plant Cell Physiol, 22:867-880.
NISHIKIMI M, RAO AN, YAGI K, 1972. The occurrence of super oxide anion in the reaction of reduced phenazine methosulfate and molecular oxygen [J]. Biochem Biophys Res Comm, 46:849-854.
PENG XY, SONG M, 2011. Effects of exogenous cysteine on growth, copper accumulation and antioxidative systems in wheat seedlings under Cu stress [J]. Acta Ecol Sin, 31(12):3504-3511. [彭向永, 宋敏, 2011. 外源半胱氨酸对铜胁迫下小麦幼苗生长、铜积累量及抗氧化系统的影响 [J]. 生态学报, 31(12):3504-3511.]
QIUdY, LIN HM, CHEN Y, et al., 2010. Effect of altitude, longitude and altitude on Angelica growth and early bolting in medicine formation period [J]. Acta Agr Sin, 18 (6):838-843. [邱黛玉, 蔺海明, 陈 垣, 等, 2010. 经纬度和海拔对当归成药期植株长势和早期抽薹的影响 [J] .草地学报,18(6):838-843.]
QROZCO-CRDENAS ML, RYAN CA, 2001. Hydrogen peroxide acts as a second messenger for the induction ofdefense genes in tomato plants in response to wounding, systemin, and methyl jasmonate [J]. Plant Cell, 13(1):179-91.
ROUSOS PA, HARRISON HC, 1987. Identification ofdifferential responses of cabbage cultivars to copper toxicity in solution culture [J]. J Am Soc Hortic Sci, 112( 6):928-931.
SHARMA RK, AGRAWAL M, 2005. Biological effects of heavy metals:An overview [J]. J Environ Biol, 26(2 Suppl.):301.
SUN WH,WANG WQ, MENG QW, 2005. Functional mechanism and enzymatic and molecular characteristic of ascorbate peroxidase in plants [J]. Acta Phytophysiol Sin, 41(2):143-147. [孫卫红, 王伟青, 孟庆伟, 2005. 植物抗坏血酸过氧化物酶的作用机制、酶学及分子特性 [J]. 植物生理学报, 41(2):143-147.]
TAN KY, LIU XD, LIU JC, et al., 2011. Remediation experiments of attapulgite clay to heavy metal contaminated soil [J]. Rock Min Anal, 30(4):451-456. [谭科艳, 刘晓端, 刘久臣, 等, 2011. 凹凸棒石用于修复铜锌镉重金属污染土壤的研究 [J]. 岩矿测试, 30(4):451-456.]
WEIdD, 2016. The protection mechanism of glycinebetaine on photosynthesis under chilling stress in tomato leaves [D]. Jinan:J Shangdong Agric Univ. [卫丹丹, 2016. 低温胁迫下甜菜碱对番茄叶片光合作用的保护机制 [D]. 济南:山东农业大学]
WANG C,CAO JS,XIE K, et al., 2016. Research progress of the modification of attapulgite and its application in water treatment [J]. Appl Chem Ind, 45(8):1575-1578. [王成, 操家顺, 谢坤,等, 2016. 凹凸棒土改性及其在水处理中的应用研究进展 [J]. 应用化工, 45(8):1575-1578. ]
WEI RD, CUI Q, 2005. The exploitation and application of the attapulgite claydeposit in Linze, Gansu Province [J]. Gansu Sci Sin, 17 (3):43-45. [魏荣道, 崔峤, 2005. 甘肃临泽凹凸棒石粘土矿开发应用研究 [J]. 甘肃科学学报,17(3):43-45.]
WEI W, GONG SX, ZHANG TJ, 2009. Research progress on the compositions of angelica polysaccharide and their pharmacological action [J] .drug Eval Res, 32(2):130-134.
XIE JJ, LU LN, SHIdL, et al., 2018. Protective effects of alternative respiratory pathway on photosystem Ⅱ in Phaseolus vulgaris under CuCl2 stress [J].Bull Bot Res, (1):75-80. [谢佳佳, 芦丽娜, 石岱龙, 等, 2018. 交替呼吸途径对CuCl2胁迫下菜豆叶片光系统Ⅱ的保护作用 [J]. 植物研究, (1):75-80.]
XUE YW, WANG YF, ZHAO CJ, et al., 2016. Effects of copper stress on germination and antioxidant system in wheat seedlings [J] . Acta Agric Univ Jiangxi (Nat Sci Ed), 38(1):54-59. [薛盈文, 王玉鳳, 赵长江, 等, 2016. 铜胁迫对小麦种子萌发及幼苗抗氧化系统的影响 [J]. 江西农业大学学报, 38(1):54-59.]
YANG XM, HU GJ, 2004. Study on remediation of cadmium contaminated soil by attitugite [J]. J Heilongjiang Sci Technol Univ, 14(2):80-82. [杨秀敏, 胡桂娟, 2004. 凹凸棒石修复镉污染的土壤 [J]. 黑龙江科技大学学报, 14(2): 80-82.]
YANG Y, WANG XY, WANG J, et al., 2016. Effects of speciesdiversity on plant growth and remediation of Cd contamination in soil [J]. Acta Sci Cirumst, 36(6):2103-2113. [杨扬, 王晓燕, 王江, 等, 2016. 物种多样性对植物生长与土壤镉污染修复的影响 [J]. 环境科学学报,36(6): 2103-2113.]
ZHAO J, 2009. Elsholtzia splendens remediation of copper contaminated soil assisted by trichoderma [D]. Wuhan:Huazhong Agricultural University. [赵静, 2009. 铜污染土壤的木霉强化海州香薷修复研究 [D]. 武汉:华中农业大学]
ZHAO YY,dAI Y, CUI XM, et al., 2016.determination of protein contents of Radix aconiti kusnezoffii using Coomassie Brillant Blue G-250dye binding [J] . J Yunnan Natl Univ (Nat Sci Ed), 15 (3):235-237. [赵英永, 戴云,崔秀明, 等, 2016. 考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量 [J]. 云南民族大学学报(自然科学版), 15(3):235-237.]
ZHOU CF, WU GX, LI T, et al., 2016. Effect of exogenous hydrogen sulfide on photosynthesis and antioxidant system of cucumber leaves under low temperature in solar-greenhouse [J]. Acta Hortic Sin, 43(3):462-472. [周超凡, 吴帼秀, 李婷, 等, 2016. 外源H2S对低温下日光温室黄瓜光合作用及抗氧化系统的影响 [J]. 园艺学报, 43(3):462-472.]
ZHU HQ, ZHOU J, 2004. The present exploitation situation anddevelopment trend of attapulgite clay [J]. Conserv Utiliz Min Res, 4:14-17. [朱海清, 周杰, 2004. 凹凸棒石粘土的开发利用现状及发展趋势 [J] .矿产保护与利用, 4:14-17.]

