‘东红’猕猴桃高效再生体系的建立
吕海燕 李大卫 钟彩虹



摘 要:为有力推动猕猴桃产业化种苗生产及推广,快速高效地繁育猕猴桃新种质资源,同时为猕猴桃多倍体育种、转基因育种等新兴育种技术创造新种质资源奠定基础,该研究以‘东红’猕猴桃叶片、叶柄为外植体,探讨了不同植物生长调节剂种类及质量浓度组合对不定芽诱导过程中不定芽形成的影响,并研究了不同植物生长调节剂对‘东红’组培苗不定根诱导的影响。结果表明:‘东红’再生最佳外植体为叶柄,叶柄不定芽再生最佳培养基为MS + 0.5 μg·mL-1 6-BA + 0.2 μg·mL-1 NAA,不定芽平均再生率为91.2%;不定芽经过壮苗培养(MS + 0.2 μg·mL-1 6-BA + 0.05 μg·mL-1 NAA),取2~3 cm高幼苗进行生根诱导,不定根再生率为93%,平均根数为6条;生根后,种苗移栽成活率在80%以上。初步建立了‘东红’叶柄高效再生体系,为猕猴桃快速的产业化种苗生产及推广提供了有力保证,也为后期猕猴桃育种研究提供理论依据。
关键词:猕猴桃, ‘东红’, 再生体系, 叶柄, 移栽
中图分类号:Q943.1, Q945
文献标识码:A
文章编号:1000-3142(2019)04-0464-08
Abstract:In order to promote the massive seedling industrialization and popularization of Actinidia chinensis, and multiply the new seedling resources fast and effectively, and lay foundation for the genetic transformation of kiwifruit, the petioles and leaves of A. chinensis ‘Donghong’ were chosen as explants, and the effects ofdifferent plant growth regulators on frequencies of callus formation and adventitious bud regeneration were investigated by culturing on the induction medium. Moreover, the influence ofdifferent types of plant growth regulators on the induction of adventitious roots was also analyzed. The results showed that the combination ofdifferent concentrations of 6-BA and NAA had strong effect on the bud regeneration rate, and the optimum combination (MS + 0.5 μg·mL-1 6-BA + 0.2 μg·mL-1 NAA) were obtained, in which the frequency of bud regeneration from leaves and petioles reached 63.4% and 91.2% after 35d culture, respectively. The adventitious bud regeneration rate of petiole explant of A. chinensis ‘Donghong’ was significantly higher than that of leaf explant. The frequency of adventitious bud regeneration from petioles was up to 91.2% and the average amount of regenerated buds for each petiole explant was 9-12. The result suggested that IBA was much more effective than NAA for rooting. The best cencentration of IBA was 0.5 μg·mL-1, and the rate of adventitious root regeneration and the average number of roots per shoot were 93% and 6, respectively. More than 80% of plantlets survived after transplanting. This fast anddirectdiffe-rentiation simplified the process of adventitious bud formationdifferentiated from callus, which shortened the culture process and provided a powerful guarantee for the rapid industrialization of seedling production.
Key words:kiwifruit, Actinidia chinensis ‘Donghong’, regeneration system, petiole, transplanting
獼猴桃资源收集、品种选育始于20世纪初,经过一百多年的生产、推广、发展已在全球形成近24.5万hm2的种植规模,年产值已在百亿以上。中国猕猴桃的大规模种植、生产始于20世纪70年代末,目前中国猕猴桃的种植面积和产量均跃居世界第一(张计育等,2014)。红肉猕猴桃因其甜浓的风味及丰富的营养,在国内外消费市场上颇受消费者的喜爱。从全球不同果肉颜色的猕猴桃种植面积来看,红肉猕猴桃的种植面积还有进一步的发展空间(齐秀娟等,2015)。中国科学院武汉植物园从‘红阳’开放式授粉种子实生后代中,经过15 a的种质筛选培育获得一个猕猴桃新品种——‘东红’猕猴桃,该新品种于2012年12月通过品种审定(国S-SV-AC-031-2012)。‘东红’猕猴桃在风味口感、可溶性固形物、维生素含量及耐储性上都更优于‘红阳’,集早熟、耐储、优质为一体的红肉猕猴桃新品种(黄宏文等,2000;黄宏文,2013)。
随着中国猕猴桃新品种选育速度的加快,为了更快速地推广新品种和保留新品种优良品质,采用猕猴桃的组织培养技术进行繁殖是最快速有效的方法之一。利用组织培养快速高效的繁育大量优质猕猴桃种苗,将为加速猕猴桃优良品种的产业化生产及推广做出贡献(隆前进,2010)。近年来,有关猕猴桃组织培养技术的研究已获得了重要进展。猕猴桃花药培养、离体胚培养、胚乳培养、叶片、茎段、根、叶柄等器官培养、原生质体培养及融合以及新兴的生物技术育种都取得了很大的成效(刘铮等,2013;秦永华等,2004)。
基于对‘东红’猕猴桃优良性状的保存及产业化种苗生产模式的探讨,本研究以‘东红’猕猴桃的叶片、叶柄为外植体,通过不定芽诱导和生根诱导试验,建立其快繁再生体系,为‘东红’猕猴桃快速的产业化种苗生产及推广提供有力保证,也为后期猕猴桃倍性育种及遗传转化育种研究提供理论依据。
1 材料与方法
1.1 材料
2015年3月25日从中国科学院武汉植物园猕猴桃国家资源圃采集‘东红’猕猴桃未木质化的嫩枝。用自来水冲洗1 h,在超净工作台上用75%酒精浸泡45 s,0.1%升汞10 min,无菌水冲洗4~5次,然后切成1~2个腋芽的茎段,形态学下端插入MS + 1.0 μg·mL-1 6-BA + 0.2 μg·mL-1 NAA上,置于光培养室光下培养,12 h·d-1,(25 ± 2)℃,21~28d后调查腋芽萌发率,并以获得的无菌试管苗为外植体来源进行再生试验。
1.2 方法
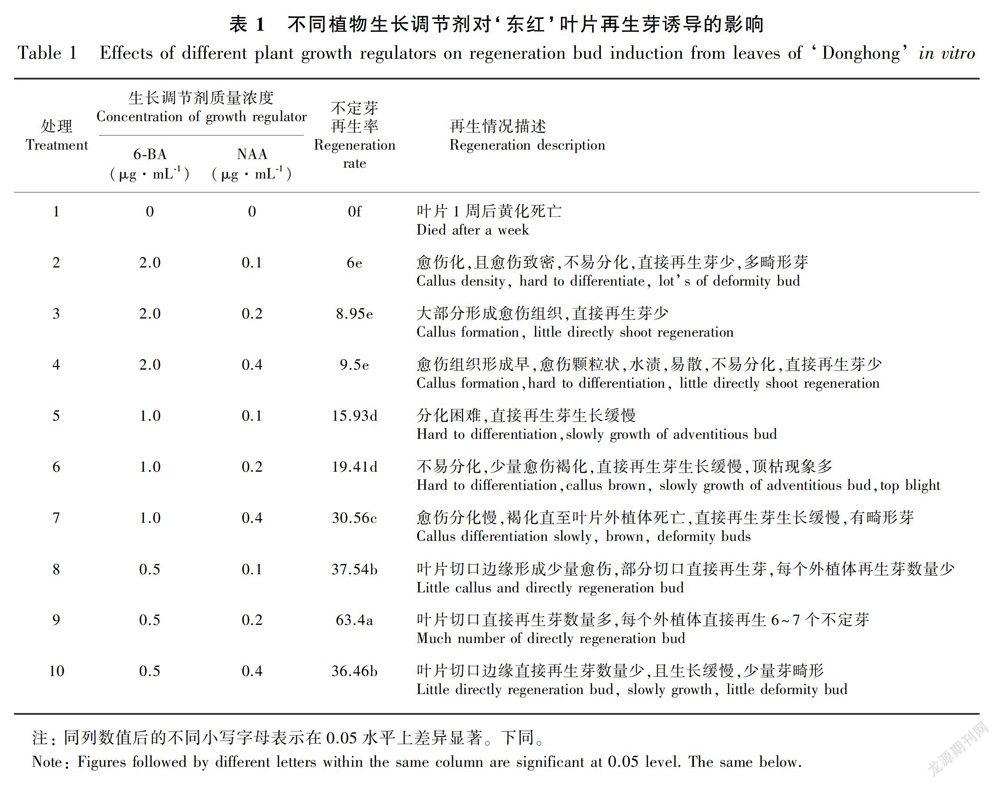
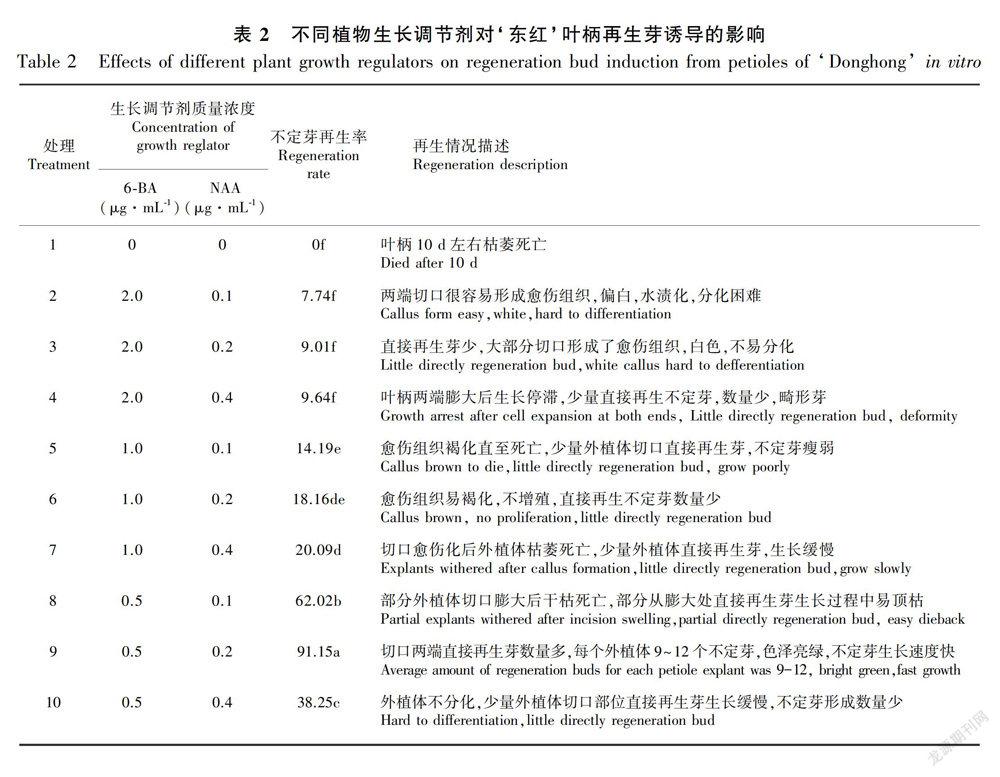
1.2.1 不定芽的再生 切取试管苗完全展开幼嫩叶片,0.5 cm × 0.5 cm,叶柄及主脉靠叶柄端单独取出,切成0.5 cm小段,置于培养基上,培养基以MS为基本培养基,附加不同质量浓度的6-BA,NAA,以不加任何激素的MS为对照,6-BA质量浓度2.0、1.0、0.5 μg·mL-1,NAA质量浓度0.1、0.2、0.4 μg·mL-1,随机设置9个处理,加上对照共10个,每处理3次重复,每个重复15个外植体。接种后置于光照条件下培养,培养28d后统计不定芽和愈伤再生率,不定芽在最佳不定芽再生培养基上继代一次后,转入壮苗培养基中进行培养。
1.2.2 不定芽的生根 将生长状态相对一致的高 2~3 cm,具3~4片叶的不定芽切下,分别接种到附加有不同质量浓度的NAA、IBA的1/2 MS培养基上进行生根培养,以1/2MS为对照,每处理重复3次,每个重复15个不定芽,培养21d后,统计生根率和平均生根数量。本研究的光培养条件为12 h·d-1光照,光照强度2 500 lx,温度(25 ± 2) ℃,MS基本培养基添加蔗糖质量浓度3×104 μg·mL-1,琼脂质量浓度7.5×103 μg·mL-1,pH 6.0。
1.2.3 种苗的驯化移栽 当组培苗根长1~2 cm时,将瓶苗取出至移栽温室进行驯化,2~3d后松瓶盖,一周后取出生根苗,清水洗净根部培养基,移栽至装有灭菌基质(泥炭土∶草炭土∶珍珠岩=2∶1∶1)的穴盘中。移栽后一到两周保证环境温度20~30 ℃,空气湿度70%~85%,夏季移栽适当遮阴,两周后可适当过渡到常规管理。一个月后统计种苗移栽成活率及生长状况。
1.2.4 数据分析 采用SPSS数据分析软件处理数据,进行方差分析。
愈伤再生率=再生愈伤叶片数(叶柄数)/接种外植体总数×100%;不定芽再生率=再生芽叶片数(叶柄数)/接种外植体总数×100%;不定芽生根率=生根芽数/接种不定芽数量×100%。
2 结果与分析
2.1 不同质量浓度组合的植物生长调节剂对不定芽形成的影响
外植体接入各处理培养基9~10d后,叶片和叶柄切口处都开始膨大, 部分切口边缘生成少量愈伤组织并随之出现增殖生长, 部分切口处直接再生出单个或芽丛状不定芽。在培养基中添加不同浓度的6-BA和NAA,结果表明不同配比的植物生长调节剂对离体叶片和叶柄不定芽再生的影响很大。使用6-BA 0.5 μg·mL-1和NAA 0.2 μg·mL-1浓度组合可以显著提高叶片和叶柄不定芽再生率,不定芽直接再生率可分别达到63.4%和91.2%,显著高于其他处理(表1,表2)。
2.2 不同外植体类型对不定芽诱导的比较
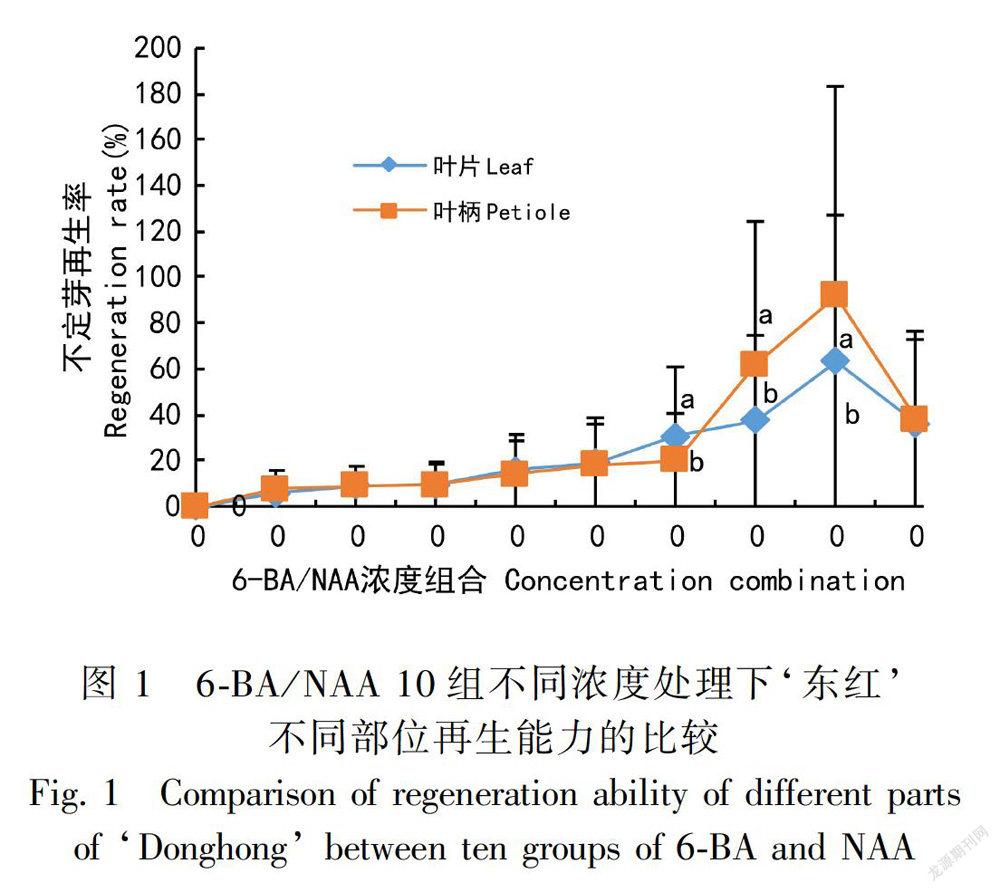
以‘东红’组培苗的叶片、叶柄为外植体对其分化能力进行了比较,发现在相同植物生长调节剂的相同浓度诱导下叶柄的分化能力明显好于叶片(图1)。叶片愈伤组织分化率高,且形成的愈伤组织致密,不易分化,直接再生芽多为畸形芽,分化耗时长,大部分叶片外植体分化形成了愈伤组织,影响了直接再生不定芽的进程;叶柄直接再生不定芽多为丛芽, 分化快, 颜色亮绿色。因此,对‘东红’来说叶柄是更好的分化材料, 所以考虑选择叶柄为‘东红’不定芽再生的最佳外植体。
2.3 不同质量浓度植物生长调节剂对不定芽生根的影响
在‘东红’再生培养最后的生根阶段,为保证用于不定根诱导的不定芽状态的相对一致,将再生芽接种至壮苗培养基培养35d后,选择株高2~3 cm,叶片3~4片的不定芽进行生根诱导,接种到含不同质量浓度的NAA和IBA的生根培养基7d后发现IBA 0.5 μg·mL-1最先产生不定根,随后其他处理陆续有不定根产生,21d后统计不定根形成率。由表3可知,不同处理情况下不定芽生根率和平均根数存在显著差异。1/2MS培养基附加IBA和NAA均可诱导生根。不同的是IBA诱导生根较早,第9天就能肉眼观察到不定根,且不定根生长粗壮,数量多,直接都是从不定芽基部生根,没有愈伤组织的产生。而NAA诱导生根于不定芽基部容易形成愈傷组织再分化出不定根,但生出的根细长,瘦弱。因此,1/2 MS + 0.5 μg·mL-1 IBA为‘东红’最适生根培养基。
2.4 种苗移栽
组培种苗炼苗后移栽至灭菌后基质中,20d后即有新叶长出,30d后统计成活率在80%以上。生长后期长势良好,70~90d后即可出圃,此时苗高12.5 cm,含6~8个饱满芽(图版I:E、F)。
3 讨论
植物生长调节剂的种类及浓度是植物组织培养条件摸索的最关键的环节。在猕猴桃组织培养过程中研究应用较多的的植物生长调节剂有细胞分裂素如6-BA、ZT、KT、CPPU等,生长素如NAA、2,4-D、IBA、IAA等(Muleo & Morini,1990;贾海慧,2010;刘小刚等,2013;朱学栋等,2012)。前人研究发现,培养基中添加1.0~2.0 μg·mL-1的ZT对猕猴桃组培再生及后期瓶苗的生根都有很显著的促进作用(谢志兵和鲁旭东,2003;张远记和钱迎倩,1996)。细胞分裂素和生长素适宜浓度组合的培养基配方对猕猴桃组织培养过程中愈伤的分化及芽的再生有很好的促进作用。研究发现,适宜浓度的6-BA和NAA组合能显著促进猕猴桃愈伤组织形成和不定芽的分化(田娜等,2007)。另有研究表明,不同浓度的6-BA 和NAA的组合处理比6-BA 和2,4-D的组合处理更显著促进猕猴桃茎段愈伤组织的分化(王大平,2007)。本研究以附加不同浓度的6-BA和NAA的MS培养基对‘东红’叶柄和叶片进行不定芽的再生诱导,结果表明低浓度的6-BA 0.5 μg·mL-1和NAA 0.2 μg·mL-1的组合浓度处理对‘东红’直接再生不定芽具有很好的效果,愈伤率低,器官分化直接进行不定芽的再生阶段,不定芽直接再生率高达91.2%。植物组织培养过程中,低浓度的植物生长调节剂促进生长,而高浓度的植物生长调节剂则抑制生长,该原理在猕猴桃组织培养中也不例外,多以低浓度为宜,尤其在不定芽伸长生长阶段(刘永立等,2005;胡皓和张志东,2011;袁云香,2011)。
猕猴桃组培苗的生根研究表明,添加常规植物生长调节剂如IBA、NAA、IAA即可促进其生根(李桂君等,2010;王大平和杨玲,2008;谢志兵和鲁旭东,2003)。本研究结果表明‘东红’不定芽在接种于添加0.5 μg·mL-1 IBA的1/2 MS中,诱导生根率最高,单株生根数量达6条,效果最优。
外植体的筛选作为植物组织培养的第一步,其重要性直接影响培养后期的细胞再生与分化以至于芽的形成(陈洪国和熊月明,2001;姜维梅和李凤玉,2003;隆前进等,2010;周玲艳等,2007)。猕猴桃组织培养可供研究的外植体类型很多,带腋芽的茎段、不定芽、叶柄、叶片、花瓣、花萼、花粉、胚乳、根、形成层和原生质体均可成功诱导不定芽的再生(尚霄丽等,2010;刘长江等,2009;田新华等,2008;文国琴和何震,2004;Gonzalez et al.,1995;Adam,1995;毕静华等,2005;兰大伟等,2007)。本研究结果发现,叶片在诱导分化过程中容易形成致密的不易分化的愈伤组织,少量直接再生的不定芽畸形芽偏多,而叶柄不定芽直接再生率显著高于叶片,分化速度快,直接简化了从愈伤组织到不定芽分化的过程,缩短了育种进程,为产业化快速生产种苗提供了有力的保证。
参考文献:
ADAM M, 1995. Callus induction and plant regeneration in vitro in Actinidia [J]. Acta Soc Bot Pol, 64(2):131-138.
BI JH, LIU YL, SYED A, 2005. In vitro organogenesis and plant regeneration from leaf explants of Actinidia latifolia [J]. J Fruit Sci, 22(4):405-408. [毕静华,刘永立,ASGHAR SYED,2005. 阔叶猕猴桃叶片离体器官发生和植株再生(英文) [J]. 果树学报,22(4):405-408.]
CHEN HG, XIONG YM, 2001. Effects ofdifferent explants and growth regulators on the formation and regeneration of the callus of kiwifruit [J]. Fujian Fruit, (4):3-4. [陈洪国,熊月明,2001.不同外植体和生长调节剂对猕猴桃愈伤组织形成与再分化的影响 [J].
福建果树,(4):3-4.]
GONZALEZ MV, REY M, RODRIGUEZ R, 1995. Plant regeneration from petioles of kiwifruit microshoots [J]. Hortic Sci, 30(6):1302-1303.
HU H, ZHANG ZD, 2011. Study on micropropagation of Actinidia arguta ‘Kuilu’ [J] . Jilin Agric, (2):71-72. [胡皓,張志东,2011. 软枣猕猴桃“魁绿”品种组培微繁技术研究 [J]. 吉林农业,(2):71-72.]
HUANG HW, 2013. Actinidia germplasm resources in China [M]. Beijing:China Forestry Publishing House:115. [黄宏文,2013. 中国猕猴桃种质资源 [M]. 北京:中国林业出版社:115.]
HUANG HW, GONG JJ, WANG SM, et al., 2000. Geneticdiversity in the genus Actinidia [J]. Chin Biodivers, 8(1):1-12. [黄宏文,龚俊杰,王圣梅, 等, 2000. 猕猴桃属(Actinidia)植物的遗传多样性 [J]. 生物多样性,8(1):1-12.]
JIA HH, 2010. Callus induction and regeneration of Actinidia chinensis [J]. J Shandong For Sci Technol, (3):41-42. [贾海慧,2010. 中华猕猴桃愈伤组织的诱导与分化 [J]. 山东林业科技,(3):41-42.]
JIANG WM, LI FY, 2003. Establishment of plantlet regeneration system of Actinidia macrosperma [J]. J Zhejiang Univ (Agric Life Ed), 29(3):295-299. [姜维梅,李凤玉,2003. 大籽猕猴桃(Actinidia macrosperma)离体再生系统的建立 [J]. 浙江大学学报(农业与生命科学版),29(3):295-299.]
LANdW, LIU YL, YUAN TL, 2007. Organogenesis, somatic embryogenesis and plantlet regeneration from leaf explants of Actinidia kolomikta cultured in vitro [J]. J Fruit Sci, 24(2):218-222. [蘭大伟,刘永立,原田隆,2007. 狗枣猕猴桃叶片离体培养的器官、体细胞胚形成与植株再生(英文) [J]. 果树学报,24(2):218-222.]
LI GJ, SONG JL, WU J, 2010. Study on tissue culture in vitro of Actinidia polygama [J]. Chin New Technol Prod, (14):216-217. [李桂君,宋嘉隆,吴捷,2010. 葛枣猕猴桃组培繁殖的研究 [J]. 中国新技术新产品,(14):216-217.]
LIU CJ, LIU GC, ZHAOdY, et al., 2009. Study on shoot tip culture of Actinidia arguta [J]. Chin Fruit, (2):32-34. [刘长江,刘国成,赵德英,等,2009. 野生软枣猕猴桃茎尖培养研究 [J]. 中国果树,(2):32-34.]
LIU XG, JIAO J, ZHAO Y, et al., 2013. Efficiency plant regeneration and browning condiction of Actinidia arguta [J]. Chin Agric Sci Bull, 29(19):113-119. [刘小刚,焦晋,赵宇,等,2013. 野生软枣猕猴桃组织培养及褐变处理 [J]. 中国农学通报,29(19):113-119.]
LIU YL, LANdW, BI JH, et al., 2005. Organ formation and plant regeneration in vitro of Actinidia polygama [J]. J Fruit Sci, 22(3):220-223. [刘永立,兰大伟,毕静华,等,2005. 葛枣猕猴桃组织培养中的器官形成与植株再生 [J]. 果树学报,22(3):220-223.]
LIU Z, ZHANG TK, ZHANG HY, 2013. Research status and prospect of tissue culture of Actinidia chinensis [J]. J Fujian For Sci Technol, 40(4):231-235. [刘铮,张太奎,张汉尧,2013.猕猴桃组织培养研究现状与展望 [J].福建林业科技,40(4):231-235.]
LONG QJ, 2010. In vitro culture and rapid micro-propagation of kiwifruit (Actinidia eriantha ‘White’ and Actinidia chiensis ‘Hongyang’) [D]. Hangzhou:Zhejiang Normal University. [隆前进,2010. 猕猴桃组织培养和快繁技术研究 [D]. 杭州:浙江师范大学.]
LONG QJ, WU YJ, XIE M, 2010. Tissue culture and rapid micropropagation from leaves and stems of kiwifruit (Actinidia chinensis cv. Hongyang) [J]. J Zhejiang Agric Sci, 22(4):429-432. [隆前进,吴延军,谢鸣,2010. ‘红阳’猕猴桃叶片和带芽茎段的组织培养快繁技术 [J]. 浙江农业学报,22(4):429-432.]
MULEO, R , MORINI S, 1990. Effect of light quality on regeneration from callus of Actinidiadeliciosa [J]. Acta Hortic, (280):155-158.
QI XJ,XU SK, LIN MM,et al., 2015. Research advances on fruit coloring mechanism in red-fleshed kiwifruit [J]. J Fruit Sci, 32(6):1232-1240. [齐秀娟,徐善坤,林苗苗,等,2015. 红肉猕猴桃果实着色基质研究进展 []J]. 果树学报,32 (6):1232-1240.]
QIN YH, ZHANG SL, ZHUdY, 2004. Advances of research in tissue culture and genetic transformation on kiwifruit [J]. J Cell Biol, 26(1):57-61. [秦永华,张上隆,朱道玗,2004. 猕猴桃的组织培养和遗传转化研究进展 [J]. 细胞生物学杂志,26(1):57-61.]
SHANG XL, MA CH, FENG JC, et al., 2010. Establishment of regeneration system from leaves of Actiniadia chinensis [J]. J Jiangxi Agric Sci, 22(4):50-52. [尚霄丽,马春华,冯建灿,等,2010. 中华猕猴桃叶片再生体系的建立 [J]. 江西农业学报,22(4):50-52.]
TIAN N, XU ZQ, HE JG, 2007. Establishment of high frequency anddirect regeneration system of kiwifruit(Actinidiadeliciosa Qinmei) [J]. J Microbiol, 25(1):79-83. [田娜,徐子勤,何近刚,2007. 猕猴桃高频直接再生体系的建立(英文) [J]. 武汉植物学研究,25(1):79-83.]
TIAN XH, LU HY, WU J, 2008. Study on tissue culture in vitro of Actinidia arguta [J]. For Sci Technol, 33(6):56-58. [田新华,卢慧颖,吴捷,2008. 软枣猕猴桃组织培养的研究 [J]. 林业科技,33(6):56-58.]
WANGdP, 2007. The effect of hormone combination withdifferent concentrations on the callus induction and buddifferentiation of kiwifruit [J]. J Anhui Agric Sci, 35(36):11761, 11821. [王大平,2007. 不同浓度的激素组合对猕猴桃愈伤组织诱导及芽分化的影响 [J]. 安徽农业科学,35(36):11761,11821.]
WANGdP, YANG L, 2008. Study on rooting culture in tissue culture seedlings of Actinidiadeliciosa [J]. J Anhui Agric Sci, 36(21):8930-8931. [王大平,杨玲,2008. 猕猴桃组培苗生根培养的研究 [J]. 安徽农业科学,36(21):8930-8931.]
WEN GQ, HE Z, 2004. Multiplication plant technique of Actinidia chinensis stem section callus [J]. J Fujian For Sci Technol, 3(4):78-79. [文国琴,何震,2004. 红阳猕猴桃茎段愈伤组织诱导成苗技术 [J]. 福建林业科技,3(4):78-79.]
XIE ZB, LU XD, 2003. Effects ofdifferent concentrations of IBA on rooting of tissue cultured seedlings of kiwifruit [J].deciduous Fruit, (2):9-10. [謝志兵,鲁旭东,2003. 不同浓度的IBA 对猕猴桃组培苗生根的影响 [J]. 落叶果树,(2):9-10.]
XIE ZB, LU XD, 2003. Study on screening of appropriate hormone combinations in tissue culture of kiwifruit [J]. N Fruit, (3):7-8. [谢志兵,鲁旭东,2003. 猕猴桃组织培养中适宜激素组合的筛选 [J]. 北方果树, (3):7-8.]
YUAN YX, 2011. Study on regeneration system of high frequency genetic transformation kiwifruit(Qinmei) [J]. J Hubei Agric Coll, 50(14):2993-2994. [袁云香,2011. 秦美猕猴桃高频遗传转化再生体系的建立 [J]. 湖北农业科学,50(14):2993-2994.]
ZHANG JY, MO ZH, HUANG SN, et al., 2014.development of kiwifruit industry in the world and analysis of trade and international competitiveness in China entering 21st centry [J]. Chin Agric Sci Bull, 30(23):48-55. [张计育,莫正海,黄胜男,等,2014. 21世纪以来世界猕猴桃产业发展以及中国猕猴桃贸易与国际竞争力分析 [J]. 中国农学通报,30(23):48-55.]
ZHANG YJ, QIAN YQ,1996. Callus induction and plant regeneration from leaves and stem segments of in vitro shoots of Actinidia arguta [J]. Acta Bot Boreal-Occident Sin, (2):137-141. [张远记,钱迎倩,1996. 软枣猕猴桃试管苗叶片和茎段的愈伤组织诱导及植株再生 [J]. 西北植物学报,(2):137-141.]
ZHOU LY, QIN HM, LAI XY ,et al., 2007. Establishment of the regeneration system from the seedlings of kiwifruit [J]. N Hortic, (5):198-200. [周玲艳,秦华明,赖幸韵,等,2007. 猕猴桃实生苗再生体系的建立 [J]. 北方园艺,(5):198-200.]
ZHU XD, LIU YQ ZHAO RL,et al., 2012. Study on fast plant regeneration of Actinidia chinensis [J]. J Hubei Agric Coll, 51(11):2369-2371. [朱学栋,刘奕清,赵荣隆,等,2012. 红阳猕猴桃快速繁殖体系的建立 [J]. 湖北农业科学,51(11):2369-2371.]

