西花蓟马抗氧化酶基因FoCAT对寄主转换的响应
刘利 郅军锐 岳文波 谢文 张涛

摘 要:为明确西花蓟马体内抗氧化酶基因FoCAT在适应不同寄主植物中的作用,利用实时荧光定量PCR技术测定了西花蓟马从菜豆豆荚分别转换到菜豆植株和蚕豆植株后,F1、F2和F3代2龄若虫和成虫体内FoCAT表达量的异同。结果表明:西花蓟马从菜豆豆荚转换到菜豆植株和蚕豆植株后,除取食蚕豆植株的F2代成虫体内FoCAT表达量和取食豆荚的没有明显区别外,其余情况下都显著降低。同一世代下FoCAT表达量在2龄若虫与成虫间差异较大。取食蚕豆植株的西花蓟马体内FoCAT的表达量均显著高于取食菜豆植株的。结果说明西花蓟马转换到新的寄主后,FoCAT迅速产生响应,其表达量与寄主的嗜食性、自身的虫态及取食的世代相关。
关键词:西花蓟马;寄主转换;继代适应;过氧化氢酶;FoCAT
中图分类号:S43
文献标识码:A
文章编号:1008-0457(2019)03-0022-05 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.03.005
Abstract:To clarify the response of FoCAT gene in Frankliniella occidentalis adaptability to host plants,quantitative real-time PCR was used to determine the expression levels of FoCAT in F. occidentalis 2nd instar nymphs and adults at F1,F2,and F3 generations after shifting to kidney bean and broad bean plants from kidney bean pod,respectively. The results showed that the expression levels of FoCAT in F. occidentalis significantly decreased after shifting except those adults at F2 generation when feeding on the broad bean. There were variations in the expression differences of FoCAT between 2nd instar nymphs and adults at the same generation. The expression levels of FoCAT in broad bean plant were higher than those in kidney bean plant. Our results indicated that FoCAT could respond quickly to host shift when F. occidentalis shifted to the new host,and its expression level was relative to host preference,thrips’ stage,and feeding generations.
Key words:Frankliniella occidentalis; host shift; subsequent adaptation; catalase; FoCAT
過氧化氢酶(CAT)是生物体内重要的抗氧化酶之一,广泛存在于动物、植物及微生物中[1]。CAT是清除H2O2最主要的酶,在维持机体内氧化还原的平衡及保护机体免受伤害中起到重要的作用[2-3]。植食性昆虫在受到逆境胁迫时,会导致机体内活性氧大量积累,从而刺激抗氧化系统CAT等酶系的应答[4]。CAT被认为是植物次生物质和杀虫剂的新分子靶标[5],植食性昆虫取食寄主植物后,虫体内CAT活性发生明显的变化以适应植物的组成抗性和诱导抗性对昆虫的防御,维持机体内氧化还原的平衡。如杨玉婷等[6]研究发现韭菜迟眼蕈蚊Bradysia odoriphaga幼虫取食不同寄主后CAT的活性显著升高。李会平等[7]研究表明,与取食感虫杨树相比,桑天牛幼虫取食抗虫杨树后CAT活性明显升高。刘建业等[8]也发现寄主植物是影响西花蓟马体内CAT活性变化的主要原因。
西花蓟马Frankliniella occidentalis,是世界性的重要入侵害虫[9-10],通过取食、产卵和传毒进行危害,给蔬菜及花卉的生产带来重大损失[11]。西花蓟马寄主植物繁多,但对寄主的嗜食性不同,其在不同寄主上的生长发育、存活率及繁殖率均存在明显差异[12-13],且体内营养物质含量和CAT等抗氧化酶活性以及解毒酶活性也不同,并随适应代数发生变化[14-15]。菜豆和蚕豆均是西花蓟马的寄主,但西花蓟马对菜豆的嗜食性高于蚕豆,并且对菜豆豆荚的嗜食性高于菜豆叶片[16]。西花蓟马在寄主转换过程中的适应性对其种群增长至关重要,本文研究了西花蓟马从菜豆豆荚分别转换到菜豆植株和蚕豆植株继代适应过程中2龄若虫和成虫体内抗氧化酶基因FoCAT表达量的变化,以期阐明西花蓟马种群在不同嗜食寄主不同世代之间适应性的变化规律及不同虫态适应性的异同,为进一步揭示西花蓟马对寄主的适应机制奠定基础。
1 材料与方法
1.1 材料
供试昆虫:人工气候箱中长期继代饲养(20代以上)的西花蓟马菜豆豆荚种群。条件为温度(25±1)℃,湿度(75±5)%,光周期14 h∶10 h(L∶D)。
供试植株:矮生菜豆Phaseolus vulgaris 品种:金束鹿泰国地豆王(河北省辛集市盛农种子公司)。于人工气候室内种植菜豆植株,条件为温度(25±1)℃,湿度(75±5)%,光周期14 h∶10 h(L∶D),每营养钵(直径10 cm,高9 cm)培育两株清洁苗,待菜豆长至3~4真叶时期,取长势一致的菜豆植株作为供试寄主植物。蚕豆Vicia faba品种:临蚕五号(康乐县进忠农产品实业开发有限责任公司)。培育条件同上,每营养钵培育四株清洁苗,待蚕豆长至约15 cm,叶片8~10叶时,取长势一致的蚕豆植株作为供试寄主植物。生长期间均不施用任何农药。
1.2 方法
1.2.1 菜豆和蚕豆植株上不同世代西花蓟马的饲养及取样
取菜豆豆荚上饲养并羽化3 d后已交配的西花蓟马雌成虫转换到菜豆植株上并饲养于养虫笼(86 cm×45 cm×41 cm)中,24 h后剔除所接所有成虫,待西花蓟马若虫发育至2龄时,每个养虫笼取200头2龄若虫为一个样,放入1.5 mL离心管中,记为菜豆F1代2龄若虫。同时保留一定若虫继续在植株上饲养,至成虫阶段后取成虫150头放入1.5 mL离心管中,记为菜豆F1代成虫,取样后立即用液氮冷冻,然后置于-80℃冰箱中保存备用。
取F1代已交配的雌成虫,依照F1代相同的方法转换到新的菜豆植株上,待发育到2龄若虫和成虫后进行取样,分别记为菜豆F2代2龄若虫和菜豆F2代成虫。按照以上方法继续取菜豆F3代2龄若虫和菜豆F3代成虫。
蚕豆植株上饲养和取样方法同上。每一个养虫笼的蓟马为1个重复,设置5个重复。以菜豆豆荚上长期继代饲养的西花蓟马2龄若虫和成虫为对照,记为CK。
1.2.2 RNA的提取与第一链cDNA的合成
供试西花蓟马总RNA提取根据Eastep Super总RNA提取试剂盒(Promega公司)说明书进行。用1.0%的琼脂糖凝胶电泳检测RNA的质量,以NanoPhotometerTMP -Class分光光度仪测定RNA浓度。按照RevertAid First Strand cDNA Synthesis Kit試剂盒(Thermo公司)说明书合成第一链cDNA,-20℃保存。
1.2.3 实时荧光定量(Realtime qPCR)分析
以西花蓟马EF-1作为内参基因[17],根据西花蓟马已克隆的过氧化氢酶基因FoCAT(GeneBank登录号KX115435)设计引物,进行实时荧光定量PCR(RT-qPCR)。EF-1引物序列EF-1-F:TCAAGGAACTGCGTCGTGGAT;EF-1-R:ACAGGGGTGTAGCCGTTAGAG。FoCAT引物序列FoCAT-F:ACTTGGTTCCTGGTATTGAG;FoCAT-R:TGTTGGGATAGTAGTTGGGTG。引物由生工生物工程(上海)股份有限公司合成。
反应在CFX96
?偩e
实时荧光定量PCR仪(Bio-rad公司)上进行。反应体系10 μL:5.0 μL FastStart Essential DNA Green Master(Roche公司),正反向引物各0.5 μL,cDNA 1 μL,DEPC水3 μL。程序为:95℃预变性10 min,95℃变性30 s、60℃退火和延伸30 s,进行40个循环。每次生物重复进行3次重复。反应完成收集Ct值,分析溶解曲线。
1.3 数据分析
结果采用2-ΔΔCt法[18]进行基因相对表达量的计算。用Excel 2016和SPSS 19.0软件对实验数据进行统计和分析,不同世代间西花蓟马体内FoCAT的表达量差异性分析用Duncan氏多重比较,同一世代2龄若虫和成虫间、同一世代同一虫态不同植株间FoCAT表达量的差异均采用独立样本t检验。
2 结果与分析
2.1 转换到菜豆植株上西花蓟马FoCAT表达量的变化
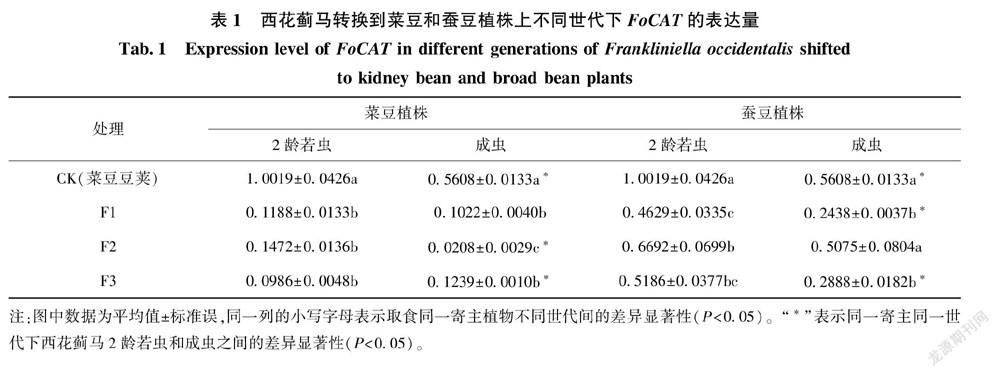
西花蓟马从菜豆豆荚转换到菜豆植株后,不论哪个世代下的西花蓟马2龄若虫和成虫体内FoCAT表达量都显著降低(表1),但2龄若虫和成虫在不同世代下的变化不同。西花蓟马2龄若虫体内FoCAT表达量在不同世代间无显著差异。对于成虫而言,F2代FoCAT表达量最低,只有对照的3.72%,且显著低于F1代和F3代。
同一世代下西花蓟马2龄若虫和成虫FoCAT表达量的差异不同。取食菜豆豆荚即对照下,2龄若虫体内FoCAT表达量显著高于成虫的,取食菜豆植株的F2代也如此。但在F1代两虫态间无显著差异,F3代2龄若虫表达量则显著低于成虫。
2.2 转换到蚕豆植株上西花蓟马FoCAT表达量的变化
西花蓟马转换到蚕豆植株后,西花蓟马2龄若虫体内FoCAT表达量明显下降,F1、F2和F3代的表达量只有对照的46.20%、66.80%和51.77%,且F1表达量最低。转换到蚕豆植株后成虫体内FoCAT表达量在F2代与对照无显著差异,F1和F3代均显著低于对照,分别为对照的43.47%和51.50%,且F1和F3代间差异不显著。
同一世代下,除F2代2龄若虫和成虫体内FoCAT表达量无显著差异外,对照、F1代和F3代均是2龄若虫体内FoCAT表达量显著高于成虫。
2.3 西花蓟马取食菜豆植株和蚕豆植株同一世代下FoCAT表达量的差异
同一世代下,不论西花蓟马的2龄若虫还是成虫,虫体内FoCAT的表达量在取食菜豆植株和蚕豆植株后明显不同。取食蚕豆植株的西花蓟马F1、F2和F3代2龄若虫体内的表达量均显著高于取食菜豆植株的(P<0.05),依次是取食菜豆植株的3.90倍、4.55倍和5.26倍。取食蚕豆植株后西花蓟马成虫体内FoCAT的表达量也显著高于取食菜豆植株的,F1、F2和F3代依次为取食菜豆植株的2.39倍、24.34倍和2.33倍(P<0.05)。
3 结论与讨论
昆虫在受到逆境胁迫后,体内活性氧大量积累,导致机体受到伤害。CAT作为昆虫抗氧化酶系的重要酶之一,在清除活性氧,维持体内氧化自由基的平衡起到重要作用。本研究表明西花蓟马从最嗜食的菜豆豆荚转换至菜豆植株和蚕豆植株后,无论哪个世代2龄若虫体内FoCAT的表达量均显著降低,且在同一世代中,取食蚕豆植株的表达量都显著高于取食菜豆植株的。说明菜豆植株和蚕豆植株两种寄主植物对西花蓟马FoCAT的表达量有了显著影响,且在嗜食度较高的菜豆植株上FoCAT表达量较低。这和刘建业等[8]研究相同CO2浓度下西花蓟马取食嗜食度较高的四季豆后CAT的活性较低,而取食嗜食性较差的茼蒿和辣椒活性较高的结果相似。但也有学者的结果与此相反,如杨玉婷等[6]研究发现韭菜迟眼蕈蚊在适应性较高的韭菜上虫体内保护酶的活性较高;张林林等[19]研究发现小地老虎取食最适宜寄主植物大豆后,虫体内CAT、超氧化物歧化酶(SOD)、过氧化物酶(POD)的活性高于取食不适宜寄主。不同学者的研究结果不同可能与寄主植物种类有关,也与害虫的种类有关。西花蓟马体内FoCAT表达水平的差异可能与受害蚕豆植株的应激反应使得植物次生物质和游离氨基酸等改变有关[20-21],非嗜食的蚕豆植株促使西花蓟马体内产生更多的活性氧,进而诱导FoCAT表达量升高以应对植物有毒次生物质。Zhang等[22]研究发现,飞蝗取食次生代谢物槲皮素后能显著诱导其体内CAT的转录水平升高。Agliassa和Maffei[23]也发现斜纹夜蛾Spodoptera littoralis可通过增加包括CAT在内的抗氧化酶活性和基因表达量以应对牛至的萜类化合物。这种基因水平的差异也可能与寄主植物携带的抗性基因有关。郭同斌等[24]研究表明,杨小舟蛾Micromelalopha troglodyta幼虫取食两种转基因杨树叶片后,中肠CAT活力被显著抑制。Mittapalli等[25]还表明,与易感小麦相比,抗性小麦上小麦黑森瘿蚊Mayetiola destructor幼虫的基因MdesCAT-1和MdesCAT-2的mRNA水平增加。本研究还发现,取食蚕豆植株和菜豆植株后西花蓟马体内FoCAT的表达量都显著降低,这可能由于西花蓟马与寄主植物长期进化的结果,相对于离体的豆荚,完整植株被取食后更能被诱导产生防御相关物质[26],从而抑制基因的表达。也可能因为菜豆豆荚中含有多胺类既能促进昆虫发育也能增强保护酶的物质[27]。
本研究还表明西花蓟马转换到菜豆植株和蚕豆植株后FoCAT的表达量在F1代便能迅速做出变化以适应不同寄主,周福才等[28]、朱经云[29]和陈瑞芬[15]在揭示昆虫适应寄主植物时都发现各种酶活性在F1代产生明显变化,但趋于稳定的时间不同。周福才等[28] 研究表明烟粉虱体内的A-NA羧酸酯酶和谷胱甘肽-S-转移酶活性一般在F2代基本稳定;朱经云[29]发现桃蚜在寄主转换的过程中P450上调基因CYP6a14在7代之后基本达到稳定水平,下调基因CYP6a13在6代之后稳定;陈瑞芬[15]研究表明西花蓟马解毒酶活性在寄主转换后在6代左右达到相对稳定[15]。本研究发现无论西花蓟马2龄若虫还是成虫体内FoCAT的表达量在F1与F3代间都无显著差异,但不能说明FoCAT的表达量在F3代回到F1代的表达水平,因为本实验只进行到F3代,以后世代的情况还不得而知,西花蓟马需要多少世代FoCAT的表达量才能达到稳定还需要进一步研究。
本研究只测定了植株转换过程中西花蓟马抗氧化酶基因FoCAT表达量的变化,然而昆虫与植物的相互作用是一个非常复杂的过程,昆虫体内多个基因参与寄主適应性,并且不同基因之间需要相互协调,所以西花蓟马对寄主植物的适应还需要进一步深入的研究。
参 考 文 献:
[1] Martindale JL,Holbrook NJ. Cellular response to oxidative stress:signaling for suicide and survival[J].Journal of Cellular Physiology,2002,192(1):1-15.
[2] Jena K,Kar PK,Kausar Z,et al. Effects of temperature on modulation of oxidative stress and antioxidant defenses in testes of tropical tasar silkworm Antheraea mylitta[J].Journal of Thermal Biology,2013,38(4):199-204.
[3] Yamamoto K,Banno Y,Fujii H,et al. Catalase from the silkworm,Bombyx mori:gene sequence,distribution,and overexpression[J].Insect Biochemistry and Molecular Biology,2005,35(4):277-283.
[4] 刘井兰,于建飞,吴进才,等.昆虫活性氧代谢[J].应用昆虫学报,2006,43(6):752-756.
[5] Zhao H,Yi X,Hu Z,et al. RNAi-mediated knockdown of catalase causes cell cycle arrest in SL-1 cells and results in low survival rate of Spodoptera litura(Fabricius)[J].PLoS ONE,2013,8(3):e59527.
[6] 杨玉婷,史彩华,程佳旭,等.不同寄主植物对韭菜迟眼蕈蚊生长发育、繁殖和保护酶活力的影响[J].植物保护,2017,43(5):119-123.
[7] 李会平,黄大庄,高 洁,等.保护酶在桑天牛与不同抗性杨树之间的互作过程[J].蚕业科学,2006,32(4):578-581.
[8] 刘建业,钱 蕾,可 芮,等.CO2浓度升高对取食不同寄主的西花蓟马和花蓟马生理酶活性的影响[J].植物保护学报,2017,44(1):45-53.
[9] 曾 广,尹显慧,廖启荣,等.4种新型杀虫剂对西花蓟马的室内毒力[J].山地农业生物学报,2015,34(1):24-27.
[10] Stuart RR,Gao YL,Lei ZR. Thrips:Pests of concern to China and the United States[J].Journal of Integrative Agriculture,2011,10(6):867-892.
[11] 谢永辉,张宏瑞,刘 佳,等.传毒蓟马种类研究进展(缨翅目,蓟马科)[J].应用昆虫学报,2013,50(6):1726-1736.
[12] 蒋兴川,桂富荣,李正跃,等.不同寄主植物对西花蓟马生长发育、存活率及繁殖力的影响研究[J].中国植保导刊,2011,31(7):5-9.
[13] 姜丽娜,钱 蕾,喜 超,等.CO2浓度升高对不同寄主植物上西花蓟马和花蓟马成虫体内消化酶活性的影响[J].昆虫学报,2017,60(3):237-246.
[14] 侯晓琳,郅军锐,叶 茂,等.西花蓟马取食菜豆植株后体内营养物质的变化[J].山地农业生物学报,2018,37(3):40-43.
[15] 陈锐芬. 西花蓟马对寄主植物的适应特性研究[D].福州:福建农林大学,2011.
[16] 袁成明,郅军锐,曹 宇,等.西花蓟马对蔬菜寄主的选择性[J].生态学报,2011,31(6):1720-1726.
[17] Zheng YT,Li HB,Lu MX, et al. Evaluation and validation of reference genes for qRT-PCR normalization in Frankliniella occidentalis(Thysanoptera:Thripidae)[J].PLoS ONE,2014,9(10):e111369.
[18] Livak KJ,Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt Method[J].Methods,2001,25(4):402-408.
[19] 张林林,李艳红,仵均祥. 不同寄主植物对小地老虎生长发育和保护酶活性的影响[J].应用昆虫学报,2013,50(4):1049-1054.
[20] 王海波,周紀纶. 蚕豆对蚕豆蚜刺吸胁迫的生理防御策略[J].生态学报,1988,8(3):195-200.
[21] 朱玉永. 豌豆蚜与寄主互作关系的研究[D].石河子:石河子大学,2014.
[22] Zhang X,Li Y,Wang J, et al. Identification and characteristic analysis of the catalase gene from Locusta migratoria[J].Pesticide Biochemistry and Physiology,2016,132:125-131.
[23] Agliassa C,Maffei ME. 2018. Origanum vulgare terpenoids induce oxidative stress and reduce the feeding activity of Spodoptera littoralis[J].International Journal of Molecular Sciences,2018,19(9):2805.
[24] 郭同斌,嵇保中,蒋继宏,等.转基因杨树对杨小舟蛾体内三种保护酶活力的影响[J].昆虫学报,2006,49(3):381-386.
[25] Mittapalli O,Neal JJ,Shukle RH. Antioxidant defense response in a galling insect[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(6):1889-1894.
[26] 吴国昭,尹能文,胡 林,等.大豆胰蛋白酶抑制剂和防御信号物质对斜纹夜蛾幼虫保护酶的影响[J].生态学杂志,2012,31(3):652-658.
[27] 王 楠,张志春,王满囷,等.亚精胺对小菜蛾幼虫生长及保护酶活力的影响[J].昆虫知识,2009,46(3):420-423.
[28] 周福才,李传明,周桂生,等.烟粉虱体内几种抗性酶对寄主转换的响应[J].生态学报,2010,30(7):1806-1811.
[29] 朱经云. 寄主转换对桃蚜适合度及生理代谢的影响[D].西安:西北农林科技大学,2017.

