钩藤生物碱的组织化学定位研究
阙云飞 王晓红 吕享 李雪 杨胜伟 徐佳瑜 张明生


摘 要:利用石蜡切片、组织化学定位及生物碱含量测定技术,研究了钩藤营养器官的组织结构、总生物碱分布及含量。结果表明,钩藤根的次生结构发达,韧皮射线呈明显的喇叭口状;茎中维管射线排列整齐;叶片叶肉细胞分化为栅栏组织和海绵组织,叶脉次生结构不发达;钩是由枝变态发育而来,解剖结构与茎相同。钩藤生物碱的组织化学定位显示,钩藤全株均有生物碱分布,根中主要分布在次生韧皮部及次生木质部,茎和钩中主要分布在韧皮部和木质部及皮层薄壁细胞,叶中主要分布在韧皮部和木质部及叶肉细胞。钩藤生物碱含量以茎最高,根、叶片及钩次之。钩藤营养器官总生物碱的组织化学定位研究,可为该资源的充分开发利用总生物碱奠定理论和技术基础。
关键词:钩藤;营养器官;生物碱;组织化学定位;含量测定
中图分类号:Q945.4
文献标识码:A
文章编号:1008-0457(2019)03-0027-06 国际DOI编码:10.15958/j.cnki.sdnyswxb.2019.03.006
Abstract:The structure of vegetative organs of Uncaria rhynchophylla,as well as total alkaloid content and distribution,were studied by paraffin sectioning,histochemical localization,and alkaloid content determination technique. The results showed that the secondary structure of U. rhynchophylla was well developed,and the phloem rays were obviously trumpet-like. The vascular ray in the stem was neatly arranged. The mesophyll cells of the leaves were differentiated into palisade tissue and sponge tissue,and the secondary veins were underdeveloped. The hook was metamorphosed from the branch and had the same anatomy as the stem. The histochemical localization of U. rhynchophylla alkaloids showed that alkaloids were distributed in the whole plant,and in the root,it was mainly distributed in the secondary phloem and secondary xylem. The alkaloids were distributed in the phloem,xylem and cortical parenchyma cells in the stems and hooks,while distributed in phloem,xylem and mesophyll cells in the leaves. The alkaloid content of U. rhynchophylla was the highest in stems,followed by roots,leaves and hooks. The histochemical localization of total alkaloids in the vegetative organs of U. rhynchophylla may lay a theoretical and technical foundation for the full development and utilization of this resource.
Key words:Uncaria rhynchophylla; vegetative organs; alkaloids; histochemistry localization; content determination
鉤藤(Uncaria rhynchophylla (Miq.)Miq. ex Havil.)为茜草科(Rubiaceae)钩藤属(Uncaria Schreber)多年生木质藤本植物,以干燥带钩茎枝入药。其味甘,性凉,归肝,心包径,有息风定惊、清热平肝等功效;用于肝风内动、惊痫抽搐、高热惊厥、感冒夹惊、小儿惊啼、妊娠子痫及头痛眩晕等症[1]。钩藤中主要药效成分为吲哚类生物碱,包括钩藤碱、异钩藤碱、去氢钩藤碱、柯诺辛碱、柯南因碱等百余种,其中以钩藤碱和异钩藤碱含量较高[2-4]。目前,有关钩藤的研究主要集中在种植技术、成分分析及药理作用等方面[5-10],而对其生物碱积累至关重要的营养器官结构及组织化学定位研究未见报道。本文以三年生钩藤为实验材料,采用石蜡切片、组织化学定位及生物碱含量测定技术,探究其营养器官的组织结构及总生物碱在不同器官中的分布情况,以期为该物种资源的综合利用提供参考依据。
1 材料与方法
1.1 材料来源
实验材料取自贵州省黔东南州钩藤种植基地的三年生钩藤植株,经贵州大学熊源新教授鉴定为钩藤Uncaria rhynchophylla (Miq.)Miq. ex Havil.。
1.2 研究方法
1.2.1 组织结构观察方法
参考杨吉刚等[11]的方法,略做改动。用蒸馏水将新鲜钩藤样品洗净,取大小为5 mm的根、茎、叶、钩,于FAA固定液(70%乙醇)中固定24 h,经梯度酒精脱水、二甲苯透明、石蜡包埋、切片(厚度8 μm)、番红及固绿染色、中性树胶封片后,置于OLYMPUS BX 51显微镜下观察并拍照。
1.2.2 组织化学定位
参考包英华等[12]的方法,略做改动。取钩藤根、茎、叶、钩进行徒手切片,用改良碘化铋钾(0.85 g 次硝酸铋溶于10 mL 冰醋酸和 40 mL 蒸馏水中,再与20 mL 40%的碘化钾混合)处理15 min,再用蒸馏水清洗3次,置于OLYMPUS BX 51显微镜下观察并拍照,改良碘化铋钾试剂与生物碱反应产生黄色至橘黄色沉淀。为保证染色结果的准确性,以浓硝酸作为生物碱染色剂对照,浓硝酸与生物碱产生橘黄色沉淀;用溴甲酚绿试剂(溴甲酚绿溶液与pH3.6邻苯二甲酸氢钾-盐酸缓冲液等量混合)作为生物碱染色剂对照,该试剂与生物碱产生蓝绿色沉淀反应。
1.2.3 生物碱含量测定方法
参考曾常青[13]的方法,略做改动。取钩藤茎、枝、叶片及钩55℃烘干,磨粉过40目筛备用;称取1.0 g钩藤粉末于锥形瓶中,加入氨溶液(氨水∶蒸馏水∶无水乙醇=9∶30∶16)润湿30 min,再加入50 mL甲醇,超声提取40 min,过滤后55℃水浴蒸干甲醇,加入30 mL pH 3.6邻苯二甲酸氢钾-盐酸缓冲液(0.2 mol/L邻苯二甲酸氢钾溶液25 mL与0.1 mol/L盐酸6 mL混合,加蒸馏水稀释至100 mL),摇匀并过滤,缓冲剂定容到50 mL即为供试液;取供试液4 mL,酸性染料比色法显色条件为10 mL pH 3.6邻苯二甲酸氢钾-盐酸缓冲液,10 mL溴甲酚绿溶液(0.1g溴甲酚绿溶于2.8 mL 0.05 mol/L NaOH溶液中,蒸馏水定容至200 mL),三氯甲烷萃取3次,每次4 mL,定容至25 mL,加入1.0 g无水硫酸钠,紫外分光光度计413 nm下测定OD值(表示为A413=Abs);以钩藤碱为对照品,用甲醇制成43.2 μg/mL的标准品溶液,其在43.2~259.2 μg范围内呈线性关系,回归方程为:C=0.0431A+0.0199,R2=0.998;根据标准曲线计算出样品中钩藤生物碱含量(以钩藤碱计)。数据分析和绘图利用Excel 2016与SPSS 22.0软件进行处理。
2 结果与分析
2.1 钩藤营养器官解剖结构
2.1.1 根的结构
钩藤根横切面结构由外向内分别为:周皮及维管柱(图1-1)。周皮最外层为木栓层,细胞壁栓质化程度高,呈规则长方形;周皮细胞不透气、不透水、排列紧密,为钩藤根的次生保护结构。次生韧皮部位于初生韧皮部的内侧,且次生韧皮部的生长将初生韧皮部挤碎,此时同化产物的运输主要由次生韧皮部承担,次生韧皮部中韧皮射线呈明显的喇叭口状;次生木质部位于初生木质部外侧,初生木质部被挤到根中心,次生木质部中包含木射线及导管,无髓部。
2.1.2 茎的结构
钩藤茎横切面结构由外向内分别为:表皮、皮层和维管柱(图1-2)。表皮由一层排列整齐、紧密的细胞构成,细胞形状为规则方形。皮层由数层薄壁细胞构成,细胞间隙较大、细胞体积大。维管形成层中纺锤状原始细胞向外分裂分化形成了次生韧皮部,射线原始细胞向外分裂分化形成了韧皮射线,此时初生韧皮部被不断生长的次生韧皮部挤碎,难以辨别;同时纺锤状原始细胞向内分裂分化形成次生木质部导管和管胞,位于初生木质部内侧,射线原始细胞向内分裂分化形成木射線;维管柱中还包含髓射线,它是连接皮层与髓的薄壁组织;茎中央为薄壁细胞,其细胞体积大,主要起储藏作用。
2.1.3 叶的结构
钩藤叶片横切面结构主要由表皮、叶肉细胞和叶脉组成(图1-3)。表皮为上下叶面最外一层,由排列整齐、紧密的方形细胞构成。栅栏组织紧贴上表皮,由两层长圆柱状薄壁细胞构成,细胞间隙较小,含有大量叶绿体,为叶片中主要的光合区域;海绵组织位于下表皮内侧,海绵组织细胞间隙大,同时含有少量叶绿体。叶脉由厚角组织、薄壁组织和维管束组成;厚角组织和薄壁组织位于表皮内侧,薄壁组织包围在维管束外形成维管束鞘;叶脉中维管束主要由木质部、韧皮部和束中形成层构成,木质部近上表皮,韧皮部近下表皮,属于无限维管束类型,可看作茎中维管束的延伸,束中形成层分裂能力弱、分裂时间短,只形成极少的次生结构。
2.1.4 钩的结构
钩藤的钩是由枝变态发育而来(图1-4)。钩的解剖结构与茎相同,主要由表皮、皮层和维管柱构成。
2.2 钩藤生物碱组织化学定位
2.2.1 根中生物碱的分布
钩藤根徒手切片经改良碘化铋钾试剂处理后,在次生韧皮部及次生木质部出现了橘黄色沉淀,次生韧皮部橘黄色沉淀较多,周皮未出现橘黄色沉淀(图2-1)。用溴甲酚绿试剂处理钩藤根部切片,在次生韧皮部及次生木质部中出现蓝绿色沉淀,在次生木质部中产生的蓝绿色沉淀较少(图2-5)。切片经浓硝酸处理后,次生韧皮部及次生木质部出现了橘黄色沉淀(图2-9)。改良碘化铋钾试剂、溴甲酚绿试剂与浓硝酸的染色结果基本一致,说明次生韧皮部与次生木质部为总生物碱在钩藤根中的主要分布部位。
2.2.2 茎中生物碱的分布
钩藤茎徒手切片经改良碘化铋钾试剂处理后,在韧皮部和木质部及皮层出现了大量橘黄色沉淀,靠近形成层部分的橘黄色沉淀较多、颜色较深,靠近薄壁细胞的部分橘黄色沉淀较少、颜色较浅(图2-2)。用溴甲酚绿试剂处理切片,韧皮部和木质部以及皮层中出现大量蓝绿色沉淀(图2-6)。浓硝酸处理切片后,在韧皮部和木质部,以及皮层细胞出现了橘黄色沉淀(图2-10)。
(Sx-次生木质部;Vc-形成层;Sp-次生韧皮部;E-表皮;Pa-薄壁组织;St-海绵组织;Pt-栅栏组织;P-韧皮部;X-木质部;C-皮层;Pe-周皮;Pc-维管柱鞘;Pr-韧皮射线;Xr-木射线;Px-初生木质部;Pp-初生韧皮部;V-导管; Py-髓射线;Ch-叶绿体;Co-厚角组织;1:根结构×100;2:茎结构×100;3:叶结构×200;4:钩结构×100)
2.2.3 叶片中生物碱的分布
钩藤叶片徒手切片经改良碘化铋钾试剂处理后,韧皮部和木质部出现大量橘黄色沉淀,靠近形成层部分的橘黄色沉淀较多、颜色较深;在栅栏组织中有大量叶绿体存在,增强显微镜光源亮度后,能观察到栅栏组织有橘黄色沉淀产生;连接栅栏组织与维管束的部分薄壁细胞也产生了橘黄色沉淀,该部分的薄壁细胞是韧皮部装载的重要组成部分(图2-3)。溴甲酚绿试剂处理切片后,在叶肉细胞及韧皮部和木质部都产生了大量蓝绿色沉淀(图2-7);切片经浓硝酸处理后,在韧皮部和木质部及叶肉细胞出现了橘黄色沉淀(图2-11)。改良碘化铋钾试剂、溴甲酚绿试剂与浓硝酸的染色结果基本一致,说明韧皮部和木质部以及叶肉细胞是叶片中总生物碱的分布部位。
2.2.4 钩中生物碱的分布
钩藤钩徒手切片经改良碘化铋钾试剂处理后,在韧皮部和木质部以及皮层细胞出现了大量的橘黄色沉淀,部分髓部薄壁细胞出现少量蓝紫色淀粉粒;钩的组织结构与茎相同,但维管组织没有茎发达,尤其是产生橘黄色沉淀后,对韧皮部结构的观察增加了难度(图2-4)。溴甲酚绿试剂处理切片后,韧皮部和木质部以及皮层细胞出现蓝绿色沉淀(图2-8);切片经浓硝酸处理后,在韧皮部和木质部出现了橘黄色沉淀,皮层也出现的橘黄色(图2-12)。改良碘化铋钾试剂、溴甲酚绿试剂与浓硝酸的染色结果基本一致,说明韧皮部和木质部以及皮层细胞是钩中生物碱的主要分布部位。
(A:生物碱沉淀;SG:淀粉粒;1:根内橘黄色沉淀×100;2:茎内橘黄色沉淀×100;3:叶内橘黄色沉淀×100;4:钩内橘黄色沉淀×200;5:根内蓝绿色沉淀×100;6:茎内蓝绿色沉淀×100;7:叶内蓝绿色沉淀×100;8:钩内蓝绿色沉淀×100;9:根内橘黄色沉淀×50;10:茎内橘黄色沉淀×100;11:叶内橘黄色沉淀×100;12:钩内橘黄色沉淀×100)
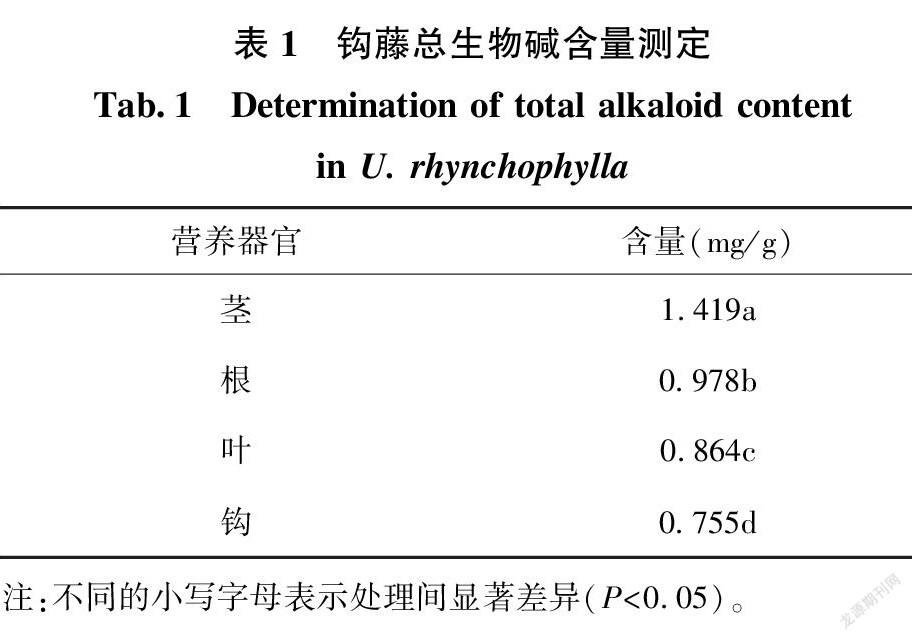
2.3 钩藤生物碱含量测定
3 结论与讨论
改良碘化铋钾是生物碱染色的通用试剂,与生物碱反应产生橘黄色到黄色的沉淀,且颜色深浅可作为生物碱含量高低的判断依据[14]。本试验结果表明,钩藤中生物碱在根、茎、叶及钩中均有分布,主要分布在韧皮部、木质部、皮层薄壁细胞及叶肉细胞有生物碱积累,且其总生物碱含量韧皮部>叶肉细胞>木质部>皮层薄壁细胞。阮俊等[15]利用生物碱测定方法,检测了广西钩藤属植物的总生物碱含量,结果表明:钩藤嫩枝、叶片中总生物碱含量呈周期性变化,且6、7、8月份含量最高,随着生长环境的改变,钩藤中总生物碱含量变化较大,钩藤属植物总生物碱含量以大叶钩藤为最高。罗晓铮等[16]对菘蓝(Isatis indigotica Fort.)叶和根中生物碱进行组织化学定位,其生物碱分布在栅栏组织、海绵组织及根中韧皮部和部分薄壁细胞,结果与本研究相近。包英华等[12]对金钗石斛(Dendrobium nobile)生物碱进行组织化学定位,茎中分布在基本组织中,根中分布在皮层薄壁细胞,叶片中分布在上下表皮细胞,结果与本研究有差异,在不同的植物中,生物碱种类及分布都不尽相同。钩藤不同营养器官生物碱染色结果均显示,靠近形成层部分的橘黄色较深,靠近薄壁细胞的部分橘黄色较浅,并推测钩藤生物碱合成与形成层有关,与李玉萍等[17]对蛇根木(Rauvolfia serpentine)根部生物堿分布的研究结果相似。闫晋晋等[18]利用组织化学定位、荧光观察及生物碱提取方法,研究乌头(Aconitum carmichaeli)营养器官中生物碱分布及含量变化,结果表明,乌头中生物碱主要分布在韧皮部薄壁细胞、形成层外侧及茎基部皮层内侧,各营养器官生物碱含量峰值出现在不同月份;不同生物碱种类,其合成部位也不同,烟草(Nicotiana tobacum L.)根部能合成烟碱及莨菪碱;金鸡纳(Cinchona sp.)种子萌发过程中,喹啉类生物碱大量合成,最后积累在幼苗根细胞中;生物碱是植物抵抗逆境所产生的重要的次生代谢物质,当烟草叶片损伤后,烟碱通过木质部从根部运送到叶片中积累[19-20]。
改良碘化铋钾与生物碱反应产生橘黄色不溶性盐或络合物,但与植物细胞内某些成分也能发生沉淀反应,所以在生物碱组织化学试验中通常会使用多种显色沉淀试剂。本试验中利用溴甲酚绿试剂在酸性条件下能与生物碱形成蓝绿色络合物,以此对钩藤各营养器官进行染色,结果与改良碘化铋钾染色基本一致,同时溴甲酚绿也作为钩藤总生物碱含量测定方法中的重要试剂。在浓硝酸染色中,叶绿体被破坏而产生橘黄色,影响对生物碱的观察,通过增加总生物碱含量测定对染色结果进行佐证,推测其是否含有生物碱,本实验结果中可知叶肉细胞中有生物碱积累。利用常规石蜡切片技术对钩藤各营养器官进行结构解剖及分析,再结合徒手切片进行生物碱染色,能够更加准确定位生物碱在营养器官中的分布。作者拟通过对不同生长时期的钩藤营养器官进行生物碱组织化学定位以及总生物碱含量测定,观测生物碱在钩藤营养器官中的积累规律,进一步推测钩藤中生物碱合成及运输途径。
目前,钩藤主要以带钩茎枝入药,其主茎、叶片均未得到有效利用。虽然有研究表明[21-22],钩藤全株均有生物碱分布,但药材市场一直未打破固有收购传统,致使叶片及主茎一直未得到有效利用,造成资源浪费。本研究采用生物碱组织化学定位的实验方法,初步探明了钩藤中生物碱在各营养器官中的分布情况,更加直观的表明了生物碱在钩藤全株均有分布,为今后钩藤资源综合利用提供了有效的证据。
参 考 文 献:
[1] 中华人民共和国国家药典委员会. 中华人民共和国药典(2015版,一部)[M].北京:中国医药科技出版社,2015.
[2] 严愉妙. 广东钩藤属植物的活性成分含量测定及其药理作用的研究[D].广州:南方医科大学,2012.
[3] 王义祥,侍媛媛,解双陆,等.钩藤吲哚类生物碱分析方法研究进展[J].药学进展,2013,(6):257-264.
[4] 汪 运. 华钩藤叶生物碱提取分离及降压活性研究[D].重庆:西南大学,2011.
[5] 张明生. 贵州主要中药材规范化种植技术[M].北京:科学出版社,2013.
[6] 罗 鸣,宋智琴,杨平飞,等.钩藤3种不同育苗方式对比试验[J].农技服务,2016,(11):104-105.
[7] Hou Jin-Jun,Feng Rui Hong,Zhang Yi-Bei,et al. Characteristic Chromatogram:A Method of Discriminate and Quantitative Analysis for Quality Evaluation of Uncaria Stem with Hooks [J].P Medica,2018,84(06/07):449-456.
[8] 季晓娟,刘 杰,赵泳波. 钩藤茎枝不同药用部位总生物碱的含量分析[J].临床合理用药杂志,2018,11(7):50-51.
[9] Yang Yang,Ji Wei-Gang,Zhu Zhi-Ru,et al. Rhynchophylline suppresses soluble Aβ 1-42 -induced impairment of spatial cognition function via inhibiting excessive activation of extrasynaptic NR2B-containing NMDA receptors [J].Neuropharmacology,2018,135:100-112.
[10] Li Chao,Jiang Feng,Li Yun-Lun,et al. Rhynchophylla total alkaloid rescues autophagy,decreases oxidative stress and improves endothelial vasodilation in spontaneous hypertensive rats [J].ACTA Pharmacologica Sinica,2018,39(3):345-356.
[11] 杨吉刚,高凯悦,吉志超,等.杠板归营养器官的解剖结构[J].山地农业生物学报,2015,34(2):40-42.
[12] 包英华,白 音,陈珺霞. 金钗石斛生物碱的组织化学定位研究[J].广西植物,2013,33(2):199-202.
[13] 曾常青,罗北亮. 酸性染料比色法测定钩藤的总生物碱含量[J].中药材,2007,30(8):1021-1024.
[14] 彭斯文,张明生,王玉芳. 杜鹃兰生物碱组织化学定位初步研究[J].世界科学技术(中医药现代化),2009,(5):728-730.
[15] 阮 俊,黄永林. 广西钩藤属植物中总生物碱含量变化研究[J].广西植物. 2004,(2):158-160.
[16] 罗晓铮,代丽萍,刘孟奇,等.菘蓝叶和根的解剖及生物碱的组织化学定位研究[J].河南农业科学,2016,(10):119-122.
[17] 李玉萍,龙绛雪,曹福祥,等.蛇根木根部生物碱积累的组织化学定位研究[J].中南林业科技大学学报,2010,(9):157- 161.
[18] 闫晋晋,慕小倩,崔宏安,等.乌头营养器官中生物碱组织化学与积累动态研究[J].西北植物学报,2008,28(1):85-89.
[19] I T Baldwin,E A Schmelz,T E Ohnmeiss. Wound-induced changes in root and shoot jasmonic acid pools correlate with induced nicotine synthesis in Nicotiana sylvestris spegazzini and comes[J].Journal of chemical ecology,1994,20(8):2139-57.
[20] Wink M,Roberts M F. Compartmentation of alkaloid synthesis,transport and storage. Alkaloids:Biochemistry,Ecology and Medicinal Applications[M].New York and London:Plenum Press,1998.
[21] 黃瑞松,张 鹏,覃冬杰,等.钩藤植物不同药用部位中钩藤碱的含量分析[J].华西药学杂志,2013,(2):183-185.
[22] 黄永林,阮 俊,沈晓琳,等.大孔吸附树脂分离提取大叶钩藤总生物碱[J].广西科学,2006,(2):127-129.

