两步法制备菜粕肽及提高蛋白溶解度工艺
帖余,刘军,李丽*,王景峰,王国强,赵琦锴,周鹏松
1(四川轻化工大学 生物工程学院,四川 自贡,643000)2(乐山恒峰华邦生物科技有限公司,四川 乐山,614000)
菜粕是菜籽经榨油后的副产物,其中含粗蛋白质量分数为35%~42%,氨基酸含量丰富,是一种重要的植物蛋白资源[1-2]。但由于含有多种抗营养因子且蛋白品质不佳,降低了其在食品和饲料行业中的应用价值[3-4]。为了改善菜粕的品质,国内外许多学者已对其进行了大量研究,虽然早期的物理法、化学法能有效降低有毒物质,但存在试剂残留、营养损失等问题[5-6]。近年来,微生物发酵法因具有经济高效、重现性好等优点受到广泛关注[7]。
目前大多数提高菜粕营养价值的研究仅侧重于通过微生物发酵脱毒,而对蛋白品质提升改良关注相对较少。即使菜粕中抗营养因子能被有效的降解,但其中大部分蛋白仍为大分子蛋白,且小肽含量少、蛋白溶解度低[8],因此其品质不如豆粕鱼粉等蛋白原料,仍然导致其使用价值受到限制。小肽是由2~20个氨基酸组成的寡肽[9],不仅具有易分解、吸收的特点,更具有抗氧化性等功能[10-11]。蛋白溶解性是衡量蛋白质食品加工属性的重要指标,是具有其他优良功能性质的先决条件[12]。因此,提高菜粕中小肽含量及蛋白溶解度将有利于其在食品、饲料行业的应用。基于霉菌在发酵过程中会分泌多种蛋白酶系的特点[13-14],本实验主要先通过霉菌固态发酵菜粕产酶,后在发酵的基础上利用酶解进一步处理菜粕提高小肽含量和蛋白溶解度。同时考察不同条件对菜粕中小肽含量和蛋白溶解度的影响,为进一步提高菜粕应用价值奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种
黑曲霉(H1, H2, H3, H4)、米曲霉(M1, M2)、白地霉(J1)、产朊假丝酵母(J2)、热带假丝酵母(J3)、解脂假丝酵母(J4, J5):均购于中国工业菌种保藏中心(CICC)。
1.1.2 原料
菜粕、麸皮:由乐山恒峰华邦科技有限公司提供。菜粕中含粗蛋白,小肽质量分数为38%、2.86%,蛋白质溶解度为 10.17%,水分含量为 10.09%(质量分数);麸皮中水分含量为9.87%(质量分数)。
1.1.3 培养基
保藏培养基:黑曲霉、米曲霉采用马铃薯葡萄糖琼脂培养基(PDA),酵母菌采用麦芽汁琼脂培养基。
霉菌麸皮种子培养基:麸皮∶水=2∶1 (g∶mL);酵母麸皮种子培养基:麸皮∶水=6∶5 (g∶mL);混匀后分别取30 g装入500 mL三角瓶,121 ℃灭菌15 min。
发酵培养基:菜粕∶麸皮∶水=7∶3∶15 (g∶g∶mL);混匀取 60 g装于500 mL三角瓶,121 ℃灭菌15 min。
1.2 仪器与设备
T-114型分析天平,北京赛多利斯仪器系统有限公司;T6紫外-可见分光光度计,北京普析通用仪器有限公司;QYC-2102C型恒温培养摇床,上海福马实验设备有限公司;MF 80BSH-2型霉菌培养箱,上海新苗医疗器械制造有限公司;LS-75HD立式高压蒸汽灭菌器,江阴滨江医疗设备有限公司;SW-CJ-2F 型超级洁净工作台,苏州安泰空气技术有限公司;K9840自动凯氏定氮仪,山东海能科学仪器有限公司。
1.3 试验方法
1.3.1 种子制备
将保藏的菌种勾取5~7环分别接种于种子培养基中,霉菌30 ℃恒温培养72 h,酵母30 ℃恒温培养48 h。
1.3.2 固态发酵
将霉菌和酵母的麸皮种子分别按1∶20(g∶g)接种于发酵培养基中,混匀,30 ℃发酵36 h;之后取30 g发酵菜粕于70 ℃烘干至恒重,粉碎过40目筛网测定指标。
1.3.3 酶解
取固态发酵结束后的30 g发酵菜粕装入自封袋,45 ℃密闭恒温酶解24 h;之后将菜粕于70 ℃烘干至恒重,粉碎过40目筛网测定指标。
1.3.4 不同工艺条件对小肽含量和蛋白溶解度的影响
固态发酵阶段,分别考察不同发酵时间(12、24、36、48、60、72 h)对小肽和蛋白溶解度变化影响;酶解阶段,分别考察不同酶解时间(6、12、18、24、30、36 h)、酶解温度(40,45,50,55,60 ℃)对小肽和蛋白溶解度变化影响。
1.3.5 理化指标测定
小肽根据GB/T 22492—2008测定[15];蛋白溶解度根据文献[16]测定;酸性蛋白酶活根据文献[17]测定;蛋白分子质量分布采用Tricine-SDS-PAGE测定[18]。
1.3.6 数据分析
采用SPSS 22.0进行单因素方差分析,并用Duncan检验法进行多重比较,试验结果采用平均值±标准误差表示,以P<0.05作为差异性显著判断标准。采用Origin 2018 进行图形绘制。
2 结果与分析
2.1 固态发酵
所有单一试验菌株发酵36 h后对小肽含量和蛋白溶解度均有一定影响(图1)。结果表明,经霉菌发酵后,小肽含量及蛋白溶解度显著提高(P<0.05)。经H4发酵后,菜粕中小肽质量分数及蛋白溶解度均最高,分别为7.86%、25.23%,相比于未发酵菜粕分别提高了148.08%和174.83%。这与吴正可等[19]通过多菌种发酵菜粕将小肽含量从0.84%提高至2.62%的研究结果相似。

图1 单菌固态发酵对小肽含量及蛋白溶解度的影响Fig.1 Changes of small peptide content and protein solubility of rapeseed meal after fermentation
2.2 酶解
图2表明,进一步将霉菌发酵的菜粕酶解,小肽含量和蛋白溶解度在发酵后的基础上进一步提高。

图2 酶解发酵菜粕后小肽含量及蛋白溶解度变化Fig.2 Changes of small peptide content and protein solubility of rapeseed meal after enzymatic hydrolysis
尤其经H4发酵酶解后,小肽质量分数及蛋白溶解度提高到13.05%和44.37%。相比于单步固态发酵分别提高了66.03%和75.86%,相比于空白,小肽含量提高了3.6倍。这与姚晓红等[20]采用外加中性蛋白酶与微生物协同固态发酵菜粕96 h后小肽含量提高了3.7倍的研究结果相似。在发酵过程中,蛋白酶将菜粕中大分子蛋白分解为小分子肽,同时由于菌体的生长代谢,分解培养基中部分碳水化合物,最终导致干物质损失,因此使得小肽含量提高[21]。当发酵结束后,将菜粕置于适当温度下进行酶解,H4分泌的相关的酶系进一步将大分子蛋白降解为小分子肽,因此使得小肽含量及蛋白溶解度进一步显著提高。将酵母菌发酵的菜粕进一步酶解后,相比单步固态发酵,小肽含量及蛋白溶解度提高不明显,可能由于酵母菌分泌蛋白酶系能力较弱导致,因此推测此过程中小肽含量增加的主要原因是菜粕中碳水化合物被消耗而使得小肽含量相对富集。由于菜粕经H4发酵酶解后,小肽含量及蛋白溶解度最高,因此选择H4用于后续试验研究最佳酶解条件。
2.3 不同发酵酶解时间对小肽含量、蛋白溶解度的影响
经H4发酵不同时间后酶解24 h的结果如图3所示。发酵48 h后酶解,小肽质量分数及蛋白溶解度最高,分别为13.96%,42.98%。在发酵48 h前酶解,小肽含量及蛋白溶解度随蛋白酶活增加而增加,但当发酵超过48 h后酶解,小肽含量和蛋白溶解度不随酶活增加而增加。结果表明,在酶解过程中,小肽含量及蛋白溶解度与蛋白酶活变化趋势不同,可能存在其他酶系影响小肽含量及蛋白溶解度。此结果与ZHAO等[22]的研究结果相似,在酶解豆粕生产氨基酸过程中,氨基酸含量不完全随中性蛋白酶的变化趋势变化。

图3 发酵时间对小肽含量、蛋白溶解度、蛋白酶活的影响Fig.3 Effect of fermentation time on small peptide content, protein solubility and protease activity
图4表明,通过固态发酵后,菜粕中含小肽质量分数及蛋白溶解度分别为7.74%、27.40%,再经过45 ℃酶解30 h后,小肽质量分数及蛋白溶解度分别提高至14.12%、 44.95%,相比于单步固态发酵分别提高了82.43%和64.05%。同时结果也表明,酶解前12 h, 小肽含量及蛋白溶解度增长较快,12 h后增长速率下降,可能是酶解12 h后蛋白酶酶活力大幅下降所致;当经过30 h酶解后,小肽含量及蛋白溶解度不随酶解时间增加而改变(P>0.05),可能是酶解后期底物浓度不足和蛋白酶活较低导致。因此,选择48、30 h分别为最佳发酵、酶解时间。
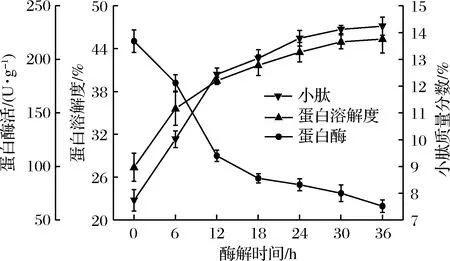
图4 酶解时间对小肽含量、蛋白溶解度、蛋白酶活的影响Fig.4 Effect of enzymatic hydrolysis time on small peptide content, protein solubility and protease activity
2.4 酶解温度对小肽含量、蛋白溶解度的影响
如图5所示, 45~50 ℃为最适酶解温度范围,当酶解温度超过50 ℃时,小肽含量及蛋白溶解度明显下降(P<0.05)。这可能因为H4产生的蛋白酶最适作用温度为45~50 ℃,当酶解温度超过酶最适温度范围时,酶稳定性下降,易在酶解过程中失活,最终导致酶解后小肽含量及蛋白溶解度低。由于发酵的菜粕在45~50 ℃酶解后,小肽含量及蛋白溶解度没有显著变化(P>0.05),同时为降低酶解能耗,选择45 ℃作为最佳酶解温度。

图5 酶解温度小肽含量、蛋白溶解度、蛋白酶活的影响Fig.5 Effect of enzymatic hydrolysis temperature on small peptide content, protein solubility and protease activity
2.5 发酵酶解后菜粕蛋白质分子组成变化
如图6所示,未发酵的菜粕蛋白质分子质量在4.6~42 kDa分布较少,经过H4发酵后,10~42 kDa的蛋白质含量增加,少量10 kDa的蛋白质被分解。经过酶解后,4.6~97.2 kDa的蛋白质含量明显减少,特别是10 kDa的蛋白质几乎完全降解。由于菜粕中的蛋白质分子质量主要约为300 kDa[23],经H4发酵后,其中部分大分子蛋白被H4或分泌的酶分解利用,使得42~97.2 kDa的蛋白质含量增加,且部分10 kDa的蛋白质被分解为小分子蛋白。结果表明,经过酶解后大部分10~97.2 kDa的蛋白质进一步被相关酶系分解为小分子蛋白(<4.6 kDa),使得小肽含量及蛋白溶解度在酶解后显著增加。
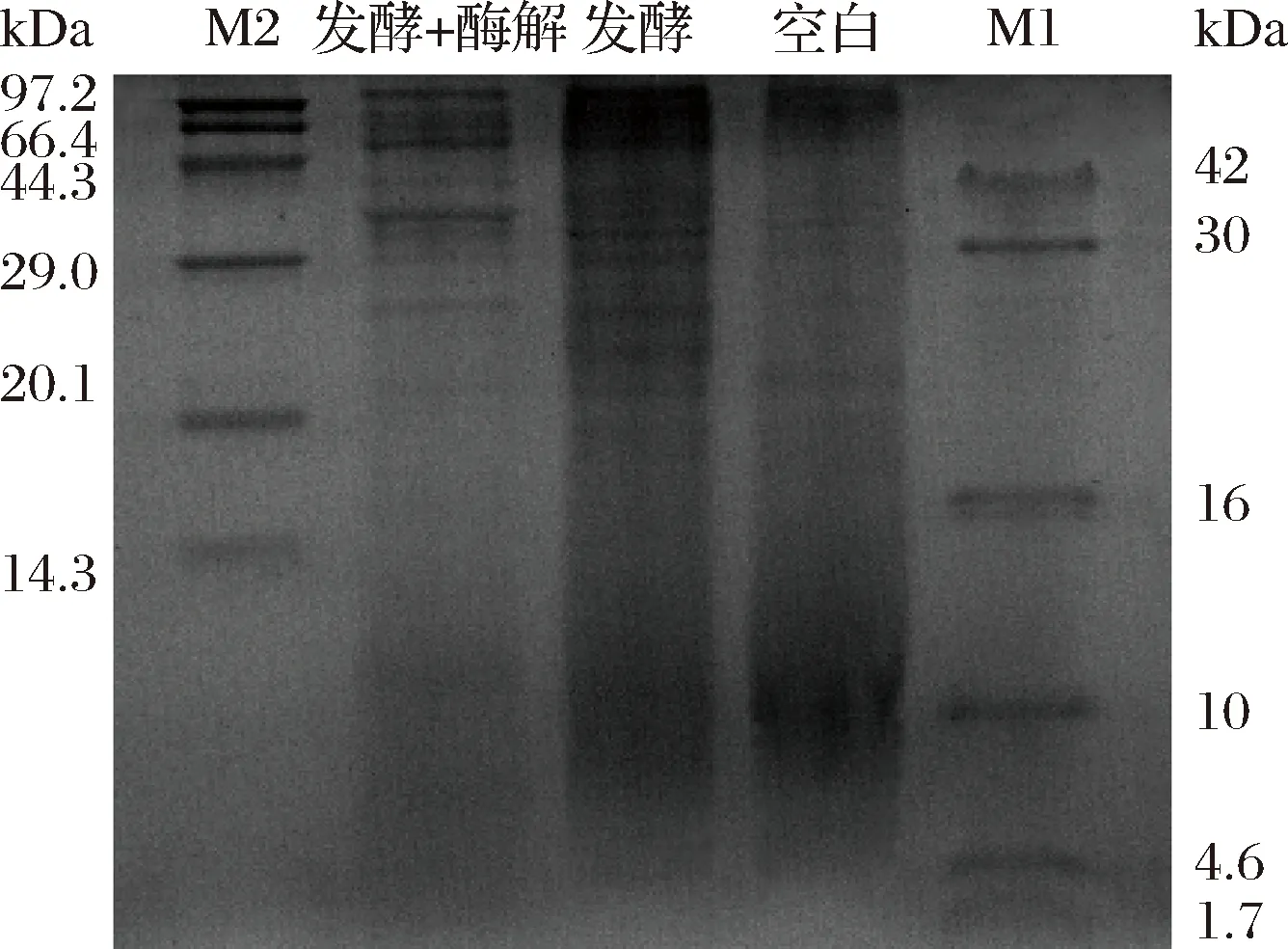
M1、M2-蛋白分子质量标准图6 菜籽粕发酵、酶解后蛋白分子组成变化Fig.6 Changes of protein molecular composition of fermented and enzymatic hydrolysis rapeseed meal
3 结论
通过不同工艺条件比较,确定最优固态发酵时间、酶解时间和酶解温度分别为48、30 h和45 ℃。与空白对照相比,经过发酵酶解两步法处理的菜粕,其小肽含量和蛋白溶解度分别提高了393.71%和341.99%;与单步固态发酵相比,其小肽质量分数和蛋白溶解度分别提高了79.64%和78.16%。酶解后,菜粕中大部分大分子蛋白降解为小分子蛋白(<4.6 kDa),有效改善了菜粕蛋白的品质,提高了菜粕的应用价值。

