叶下珠提取物对DPPH和亚硝酸盐的清除作用研究
李红念, 戴卫波, 梅全喜, 郭文贤
(广州中医药大学附属中山医院,广东中山 528400)
叶下珠来源于大戟科植物叶下珠(Phyllanthus urinaria L.),干燥全草入药,性微苦、甘,凉,有平肝清热、利水解毒的功效。现代研究表明,叶下珠具有抗乙型肝炎病毒、保肝护肝、抗肿瘤、抗病原微生物、抗氧化、抗血栓等作用[1,2]。其所含的没食子酸、柯里拉京、鞣花酸等多酚成分在抗乙型肝炎、肝保护等方面具有较好的药理作用[3],可能是该药发挥肝保护作用的主要药效物质基础。因此,探讨叶下珠提取物的制备工艺和生物活性具有重要的研究意义。本研究通过液液萃取的方法获得总多酚得率更高的叶下珠提取物,操作简单方便,并对所制备的叶下珠提取物进行体外抗氧化活性检测,为简便高效地制备叶下珠总多酚工艺提供依据,并为叶下珠资源的合理开发应用提供参考,现将研究结果报道如下。
1 材料
1.1药物叶下珠药材,购自广东省梅州市药材市场,经广州中医药大学附属中山中医院曾聪彦主任中药师鉴定为大戟科植物叶下珠Phyllanthus urinaria L.干燥全草。
1.2试剂正丁醇(天津富宇精细化工有限公司,批号:20170315);福林酚试剂(美国Sigma-Aldrichi公司,批号:101891292);没食子酸对照样品(成都曼思特生物科技有限公司,批号:MUUST-17022801);2,2-二苯基-1-苦肼基自由基(DPPH,上海梯希爱化成工业发展有限公司,批号:BFQNI-SL);维生素C(美国Amresco公司,批号:2626C211);无水乙醇(广东西陇科学股份有限公司,批号:1708011);亚硝酸钠(国药集团化学试剂有限公司,批号:20170109);对氨基苯磺酸(国药集团化学试剂有限公司,批号:20170921);N-(1-萘基)乙二胺盐酸盐(国药集团化学试剂有限公司,批号:20160503)。
1.3仪器JJ2000型精密电子天平(常熟双杰测试仪器厂);HS-4恒温水浴锅(太仓市华利达实验设备有限公司);H1850型医用离心机(湖南湘仪实验室仪器开发有限公司);N-1300型旋转蒸发仪(上海爱朗仪器有限公司);多功能打粉机;UV-2550紫外可见分光光度计(日本Shimadzu公司);BS224S型电子天平(北京赛多利斯仪器系统有限公司)。
2 方法
2.1叶下珠提取物的制备和含量测定
2.1.1 叶下珠提取物制备 将药材用多功能打粉机粉碎成20目粗粉,然后用电子天平称取粗粉700 g。按照液料比8∶1(V/mL∶m/g)加入体积分数70%乙醇,水浴加热,回流提取3次,每次2 h[4]。每次提取后过滤出提取液,全部提取完成后混合提取液,待完全冷却后置4℃冰箱保存12 h。12 h后取出提取液,分离上清液,下层液体进行离心4 000 r/min离心10 min。离心后,把2次上清液混匀,进行浓缩蒸发,得到约1∶1(m/g∶V/mL)的浓提取液,留样100 mL,置4℃冰箱保存待用。其余浓提取液用1∶1体积的正丁醇进行萃取,萃取后倒出正丁醇部分,剩余液留样待用。最后,用旋转蒸发仪蒸干正丁醇萃取液,得提取物浸膏。
2.1.2 试液的制备 用电子天平精确称量没食子酸对照品5.0 mg,蒸馏水溶解,于50 mL容量瓶定容,配成0.1 mg/mL母液。然后取5只10 mL容量瓶,用微量移液枪分别精确取上述母液1、2、3、4、5 mL于各容量瓶中,加蒸馏水定容。配成10、20、30、40、50 mg/L没食子酸对照品溶液备用[5]。精密称量正丁醇萃取物浸膏0.3 g,用蒸馏水溶解,配制成30 mg/L供试品溶液备用。
2.1.3 标准曲线制定 取10 mL刻度试管,用微量移液枪分别精密取上述系列没食子酸对照品溶液1 mL于各试管中,加入0.5 mL的福林酚试剂,充分摇匀。反应1 min后加7.5%Na2CO3溶液1.5 mL,混匀后蒸馏水定容。室温下反应2 h后,以未加试剂的溶液为对照,于波长765 nm处测定各浓度对照品溶液的吸光度。结果如表1所示。分别以没食子酸质量浓度和吸光度为横、纵坐标建立标准曲线。标准曲线方程为Y=0.009 6X-0.082 8,R2=0.995 3,见图1。
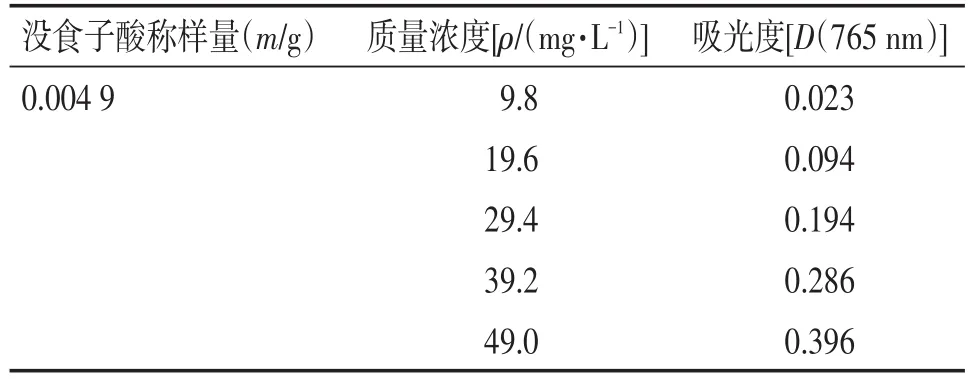
表1 没食子酸对照品吸光度Table 1 The absorbance of gallic acid reference samples
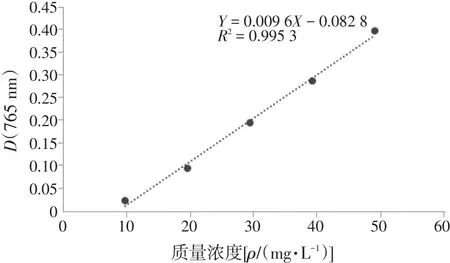
图1 没食子酸标准曲线Figure 1 The standard curve of gallic acid
2.1.4 供试品的测定 用移液枪分别取上述供试品溶液1 mL于10 mL刻度试管中,再加入0.5 mL的福林酚试剂,充分摇匀。1 min后,加入7.5%Na2CO3溶液1 mL,混匀后蒸馏水定容。室温下反应2 h,在波长765 nm处测定吸光度[6]。
2.2清除DPPH自由基实验
2.2.1 试剂的配制 供试品溶液制备:电子天平精确称取叶下珠提取物浸膏10 mg,用蒸馏水溶解,于100 mL容量瓶中用蒸馏水定容,得0.1 mg/mL供试品溶液。维生素C溶液的配制:电子天平精确称取维生素C对照品粉末20 mg,用蒸馏水溶解,于200 mL容量瓶中用蒸馏水定容,得0.1 mg/mL溶液。DPPH试剂的配制:电子天平精确称取DPPH粉末20 mg,用无水乙醇溶解配制成2 mg/mL DPPH试剂[7]。
2.2.2 清除DPPH自由基的测定 取8只试管,分别加入上述DPPH试剂4 mL,然后按顺序加入叶下 珠 供 试 品 溶 液 0、 0.4、 0.8、 1.2、 1.6、 2.0、2.4、2.8 mL配成系列浓度溶液。以4 mL无水乙醇加等量的蒸馏水作对照,在波长517 nm处测定吸光度[8]。维生素C对照品采取同种方法测定吸光度,维生素C对照品溶液加入量为0、0.3、0.6、0.9、1.2、1.5、1.8、2.1 mL。清除率=(D0-Di)/D0×100%,D0为未加入样品溶液的吸光度,Di为加入各剂量样品溶液后的吸光度。
2.3清除亚硝酸盐实验
2.3.1 试剂的配制 配制0.4%对氨基苯磺酸溶液:准确称取对氨基苯磺酸0.4 g,以20%盐酸溶解,于100 mL容量瓶定容,混匀即得,避光保存,待用。配制0.2%N-(1-萘基)乙二胺盐酸盐溶液:准确称取N-(1-萘基)乙二胺盐酸盐0.2 g,蒸馏水溶解,于100 mL容量瓶定容,混匀即得,避光保存,待用。配制20 mg/L亚硝酸钠标准液:精确称取亚硝酸钠2 mg,蒸馏水溶解定容至100 mL,保存待用。
2.3.2 清除亚硝酸盐的测定[9]取8只试管,分别精密移取“2.2.1”项下供试品溶液0、0.4、0.8、1.2、1.6、2.0、2.4、2.8 mL,加入2.0 mL pH 3.0的柠檬酸钠盐酸缓冲液、1.0 mL 20 μg/mL亚硝酸钠溶液,混匀后,加入2.0 mL 0.4%对氨基苯磺酸溶液,摇匀;并于5 min后加入1.0 mL 0.2%N-(1-萘基)乙二胺盐酸盐,用蒸馏水定容,摇匀,静置15 min,在波长538 nm处测定吸光度。平行3次,计算清除率。维生素C对照品采取同种方法测定吸光度,维生素C对照品溶液加入量为0、0.3、0.6、0.9、1.2、1.5、1.8、2.1 mL。清除率=(D0-Di)/D0×100%,D0为未加入样品溶液的吸光度,Di为加入各剂量样品溶液后的吸光度。
3 结果
3.1 提取物制备及总多酚含量测定结果 乙醇提取、正丁醇萃取后蒸发得浸膏约40.10 g,各供试样品的浓度、该浓度下的吸光度以及根据标准曲线计算出的含量如表2。以正丁醇萃取的最终产物中叶下珠总多酚类占51.60%。

表2 供试品样品总多酚含量测定结果Table 2 The results for determination of the content of total polyphenols from test samples
3.2清除DPPH自由基实验结果选取维生素C作为参照物,研究不同浓度的叶下珠提取物对DPPH自由基的清除能力,测定出吸光度后,根据清除率公式计算出各浓度下的清除率,结果如表3、4所示,清除率曲线如图2所示。由图2可知,叶下珠提取物抗氧化活性比维生素C略低。在实验质量浓度范围内(0~0.3 mg/mL),叶下珠提取物和维生素C均对DPPH自由基的清除率随浓度增加而增大,当浓度增大至0.2 mg/mL以后,随溶液浓度增加清除率变化较小。采用SPSS 22.0软件计算出叶下珠供试品的IC50为0.089 mg/mL,维生素C对照品的IC50为0.076 mg/mL。1 mg叶下珠提取物对DPPH自由基的清除能力相当于0.85 mg维生素C。
3.3亚硝酸盐实验结果叶下珠提取物及维生素C对亚硝酸盐清除作用结果见表5、6,清除率曲线如图3所示。在实验质量浓度范围内(0~0.3 mg/mL),叶下珠提取物和维生素C对亚硝酸钠的清除率均随浓度增加而增大,当浓度增大至0.2mg/mL以后,随溶液浓度增加清除率变化不大。用SPSS 22.0软件计算出叶下珠供试品的IC50为0.093 mg/mL,维生素C对照品的IC50为0.076 mg/mL。1 mg叶下珠提取物对亚硝酸盐的清除能力相当于0.82 mg维生素C。
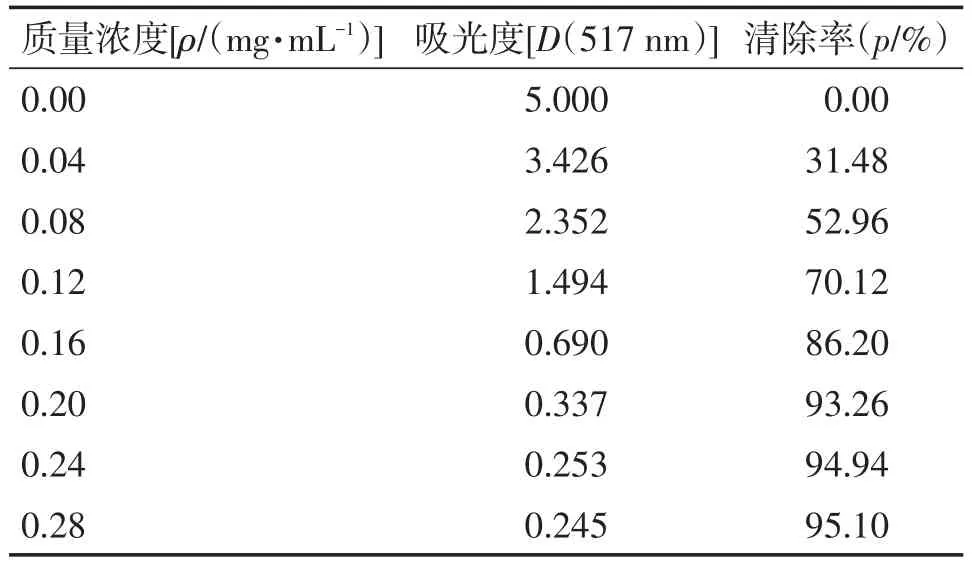
表3 叶下珠提取物溶液样品清除DPPH自由基结果Table 3 The results for the solutions of sample Herba Phyllanthi Urinariae extracts in scavenging DPPH free radical
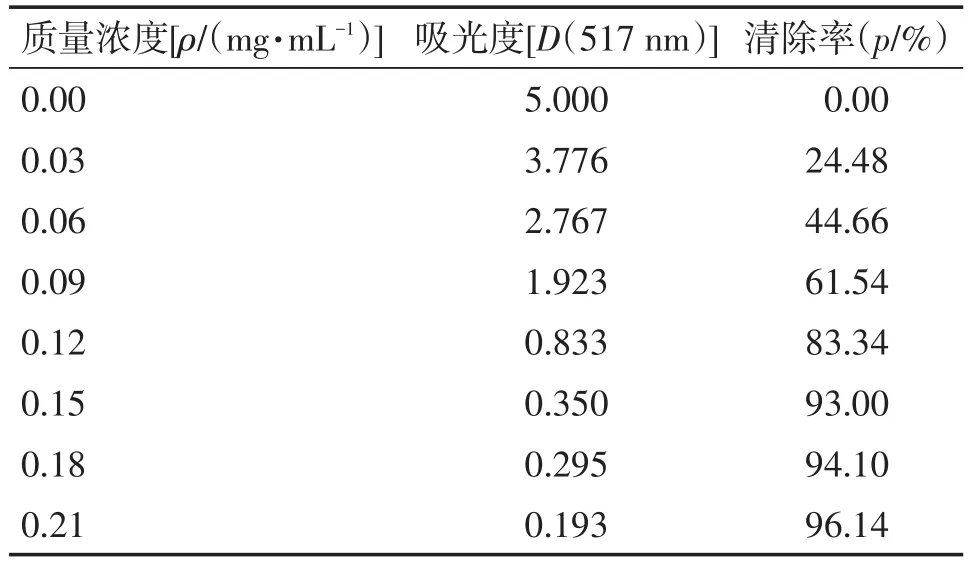
表4 维生素C对照样品清除DPPH自由基结果Table 4 The results for vitamin C control samples in scavenging DPPH free radical
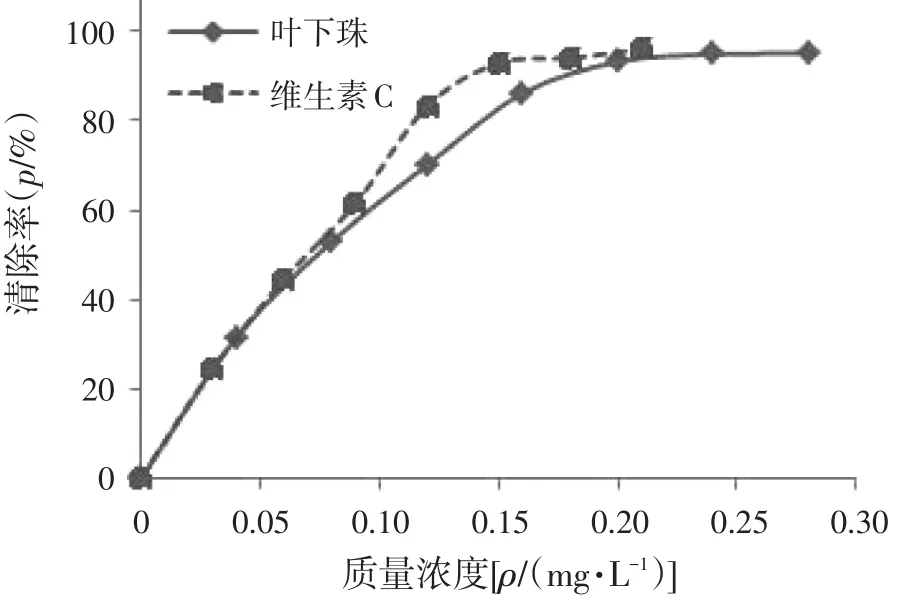
图2 DPPH自由基清除率曲线Figure 2 The curve of scavenging rate for DPPH free radical
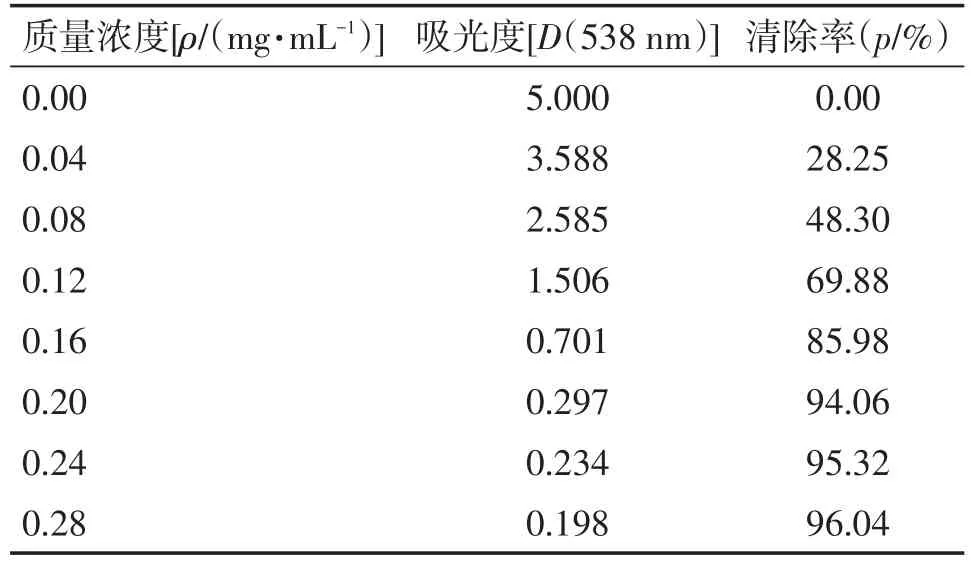
表5 叶下珠提取物溶液样品清除亚硝酸盐结果Table 5 The results for the solutions of sample Herba Phyllanthi Urinariae extracts in scavenging nitrite
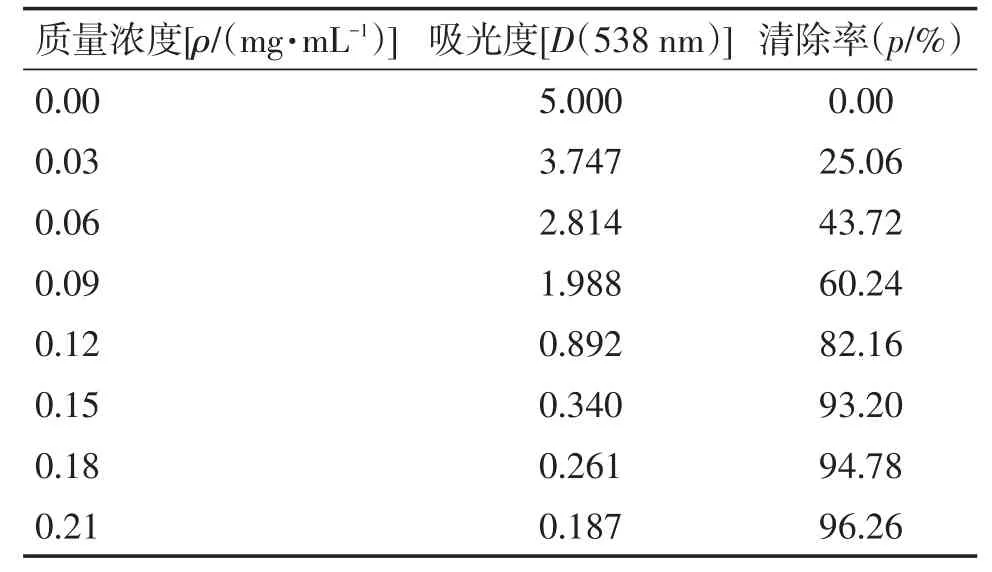
表6 维生素C对照样品清除亚硝酸盐结果Table 6 The results for vitamin C control samples in scavenging nitrite
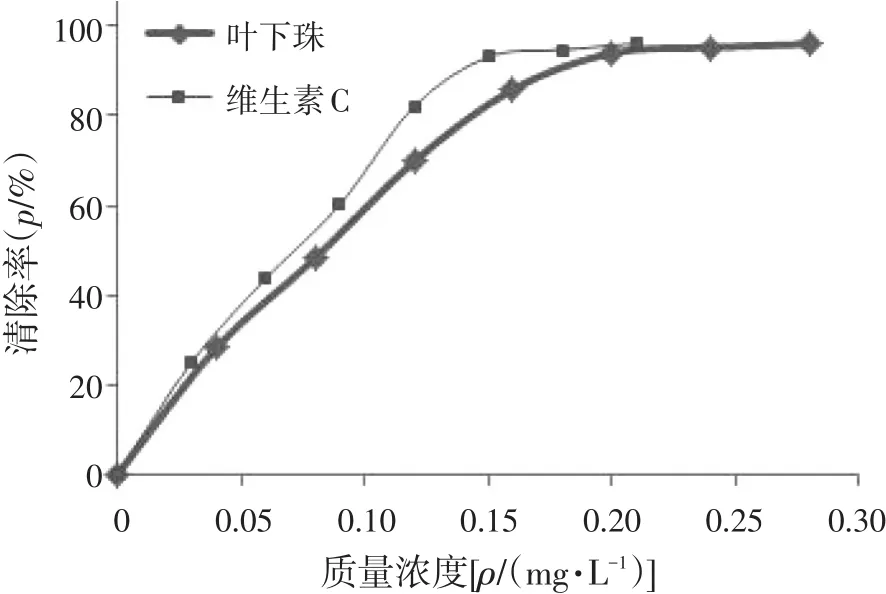
图3 亚硝酸盐清除率曲线Figure 3 The curve of scavenging rate for nitrite
4 讨论
本研究以体积分数70%乙醇为提取剂,液料比8∶1(V/mL∶m/g)回流提取3次,每次2 h,提取液用正丁醇萃取来制备叶下珠提取物。Folin-Ciocaileu比色法是目前常用的测定多酚含量的方法。本实验通过该方法测定制备的叶下珠提取物浸膏中多酚含量达51.60%。与目前文献资料对比,本次实验提取结果较好,提取率较高,达到了最佳提取工艺的水平,且测定方法准确,操作相对简单。
维生素C是公认的强抗氧化活性药物,本实验测定一系列相似浓度下维生素C溶液和叶下珠提取物溶液对DPPH自由基和亚硝酸盐的清除能力,以质量浓度为横坐标,清除率为纵坐标,在同一坐标系中作出清除率曲线。通过曲线比较可知,低浓度时,抗氧化活性随质量浓度增加而增高,当浓度增大至0.2 mg/mL以后,随溶液质量浓度增大清除率变化较小,叶下珠提取物抗氧化活性比维生素C略低,1 mg叶下珠提取物抗氧化能力相当于0.82~0.85 mg维生素C。
亚硝酸盐主要指亚硝酸钠,是常用的一种食品添加剂,被限量使用于食品加工及生产中。体内高含量的亚硝酸盐能使人体血液中低铁血红蛋白氧化成高铁血红蛋白,引起组织缺氧,呼吸中枢麻痹。食物中的亚硝酸盐与胺类化合物在酸性条件下极易形成亚硝胺,而亚硝胺是一类具有显著致癌性的化学物质。大量医学研究证明胃癌、食道癌、肝癌等癌症发病率与亚硝酸盐摄入量密切相关[10]。本研究结果表明,叶下珠提取物有较强的清除亚硝酸盐能力。据此,我们推测其对亚硝酸盐的清除作用可能对于叶下珠的抗肿瘤作用有一定的贡献,亦可能是其抗肿瘤作用的机制之一,对此,有待下一步深入研究。
综上所述,采用液液萃取的方法可有效得到叶下珠提取物,操作简单方便,总多酚得率较高。叶下珠提取物对DPPH自由基和亚硝酸盐有较强的清除作用。本研究结果可为深入研究叶下珠抗氧化及抗肿瘤作用机制奠定基础,为叶下珠资源开发应用于临床提供参考,且提示叶下珠具有被开发成为抗氧化抗癌新药的潜力。

