一种山桐子高质量DNA提取方法
徐阳,龚榜初*,吴开云,白杰健
(1.中国林业科学研究院 亚热带林业研究所,浙江 杭州 311400;2.浙江省林木育种技术研究重点实验室,浙江 杭州 311400;3.青川县林业和园林局,四川 广元 628100)
山桐子(IdesiapolycarpaMaxim),又称“油葡萄”[1],适应性强、耐旱、耐贫瘠[2-5],单株产果量高,全果含油,油脂品质高[6-7],兼具多种保健功能[8],是重要的木本油料物种,被誉为树上油仓[1]。同时山桐子树形优美,秋日果实深红色,圆锥状下垂,也是优良的园艺观赏树种[5,9-10]。山桐子产业目前在我国大有星火燎原之势,在全国各地正迅猛发展[10]。但山桐子童期长[11]、雌雄异株、雄株多的生物学特点[4],不利于山桐子产业的快速发展,急需开展山桐子雌雄分化、油脂形成等方面的分子生物学研究,在此基础上,建立山桐子分子辅助育种体系,以加速山桐子产业发展。从生物体中提取DNA是进行分子生物学研究的基础,山桐子叶片和其他组织中富含大量的多糖、多酚、类菇烯等多种初生与次生代谢产物[12],提取高质量的DNA比较困难[13],属于一种顽拗植物[14]。受限于此,山桐子相关分子生物学研究进展缓慢,现有试剂盒等提取方法所提山桐子DNA浓度较低。李娜等[15]以山桐子转录组为材料,开发了19条简单重复序列(SSR)标记,为山桐子群体遗传学提供了较好的基础。在此基础上,初步展开的SSR等标记分型条带清晰度也有待提高。据此,本文在植物DNA常用提取方法CTAB法的基础上进行改良,以期提供一种山桐子高质量基因组DNA提取方法,为山桐子分子生物学研究提供技术基础。
1 材料与方法
1.1 材料
2018年4月初,分别采集6份山桐子种质资源的嫩叶,每份种质视为1份生物学重复,然后装于冻存管立即存于液氮中,转移至-80 ℃冰箱保存。其中70、71、72号材料用于比较不同DNA提取方法的提取效果,70、71、72、73、74、75号共6份材料用于SSR分型与简化基因组测序。
1.2 方法
1.2.1 山桐子DNA提取
采用SDS法[16]、CTAB法[17]、试剂盒法(参照北京天根生化科技有限公司的植物基因组提取试剂盒)、改良CTAB法提取山桐子总DNA。
其中改良CTAB法具体方法:
首先,将嫩叶放入研钵中,加入液氮充分研磨,取粉末加入2 mL离心管中,加至1/2或2/5处为佳,加入PEG漂洗液,翻转混匀,离心收集沉淀,重复洗涤3次。PEG漂洗液[18-19]:5 mmol·L-1EDTA (pH=8.0)、50 mmol·L-1Tris-HCl (pH值8.0)、350 mmol·L-1山梨醇、10% PEG 8000、1% β-巯基乙醇(用前加入)。然后,向经PEG漂洗液漂洗的材料中加入1 mL裂解液,65 ℃裂解45 min后离心取上清。CTAB裂解液:1.4 mol·L-1NaCl (pH值8.0),0.1 mol·L-1Tris-HCl (pH值8.0),20 mmol·L-1Na·EDTA,2% CTAB,2%PVP。再加入同体积的氯仿∶异戊醇(体积比24∶1)混合液,翻转混匀,静置5 min,10 000g离心10 min,将上清转入新的2 mL离心管中;重复该步骤2~3次,直至分离相中间层无杂质(杂质较少),上清液清澈。再次将上清液转入新的2 mL离心管中,加等体积的预冷异丙醇与0.1倍体积的3 mol·L-1醋酸钠(pH值5.2),翻转,置于-20 ℃放置2 h,10 000g离心20 min,弃上清液,加1 mL 70%乙醇清洗DNA沉淀,转入1.5 mL离心管,10 000g离心5 min,倒掉上清,通风干燥约40 min,保证DNA充分干燥。最后加100 mL ddH2O溶解DNA,完全溶解后,进行检测或-20 ℃保存。
1.2.2 DNA检测与相关分子生物学试验
利用Nanodrop微量分光光度计检测各方法所提DNA的质量和浓度,利用1%琼脂糖凝胶电泳检测改良CTAB法的DNA完整度。
SSR引物选用李娜等[15]的8号SSR引物(F:TCTCCATCGTACTATTTGAATCTCAT,R:ATCAAT CAAATCAATCACAAGCC))。PCR扩增程序:94 ℃ 5 min;94 ℃ 1 min,37 ℃ 1 min,72 ℃ 1 min,5个循环;94 ℃ 1 min,Tm 1 min,72 ℃ 1 min,35个循环;最后72 ℃ 8 min。利用8%的非变性聚丙烯酰胺凝胶在垂直板电泳仪(美国Bio-Rad)进行SSR分型条带的电泳分离,250 V电压下电泳50~60 min,电泳后用AgNO3银染10 min,用生物电泳图像分析系统(美国Bio-Rad)进行观察、拍照。
利用内切酶组合RsaⅠ+HaeⅢ对山桐子基因组DNA进行酶切,酶切文库质检合格后用IlluminaHiSeqTM 进行PE125 bp测序[20]。
2 结果与分析
2.1 各方法所提DNA浓度与质量
山桐子叶片中含有较多的杂质,提取DNA较为困难。利用SDS法进行山桐子叶片DNA提取,3个样本均能提取到一定量的DNA(32.1~80.6 ng·μL-1),平均为57.73 ng·μL-1,浓度变异幅度较大,为42.21%(表1);D260/D280为1.35~1.65,均小于1.8,所提DNA中含有较高蛋白质污染;D260/D230为1.01~1.20,均小于2,所提DNA中存在严重的糖类与盐污染。综合表明,利用SDS方法提取的3个样本DNA质量均较低,其中72号样本浓度仅为32.1 ng·μL-1,D260/D280为1.35,D260/D230为1.20,严重不合格,无法用于后续的分子生物学研究。
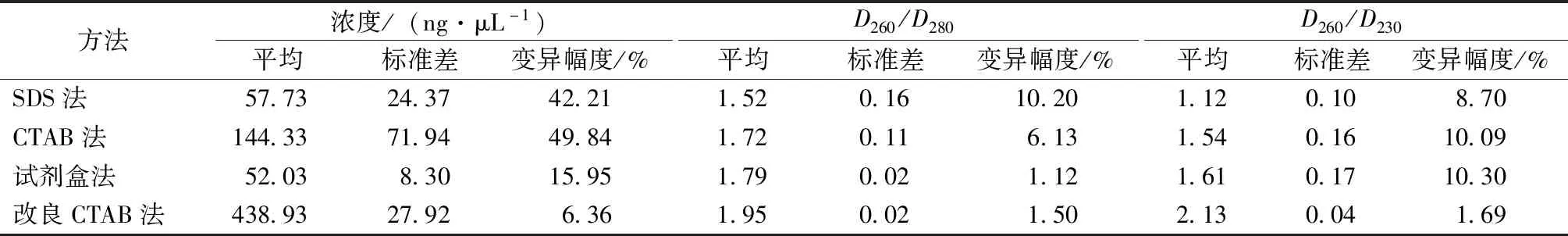
表1 不同DNA提取方法所得山桐子DNA质量比较
利用试剂盒法提取的山桐子DNA,相对于SDS法,纯度有较大提升,D260/D280为1.77~1.81,所提DNA中少量蛋白质污染,D260/D230为1.46~1.79,糖类与盐污染得到一定的控制。CTAB法提取的山桐子DNA浓度显著高于试剂盒法和SDS法,平均浓度达144.33 ng·μL-1,其中70号样本DNA浓度可达223.2 ng·μL-1。但CTAB法所提DNA样本间浓度变异幅度较大,达49.84%,不利于后续分子生物学对样本浓度的标准化要求;D260/D280比值与试剂盒法相当,为1.62~1.83,DNA样本中可能存在蛋白质与酚类物质污染,D260/D230低于试剂盒法,高于SDS法,表明所提DNA中也存在较高的糖类与盐污染。
利用改良的CTAB法提取的3个山桐子样本DNA浓度可高达417.5~470.5 ng·μL-1,平均为438.93 ng·μL-1,为试剂盒法的8.5倍。D260/D280为1.94~1.97,均高于1.8,D260/D230为2.10~2.17,均高于2,表明各样本DNA浓度高、纯度高,蛋白质、糖类与盐污染得到极好的控制。电泳结果(图1)显示,改良CTAB法提取的DNA条带稍有拖尾,整齐明亮,说明DNA得率较高且完整。同时样本浓度与纯度各指标变异幅度最少,能够满足分子生物学对样本标准化的要求。
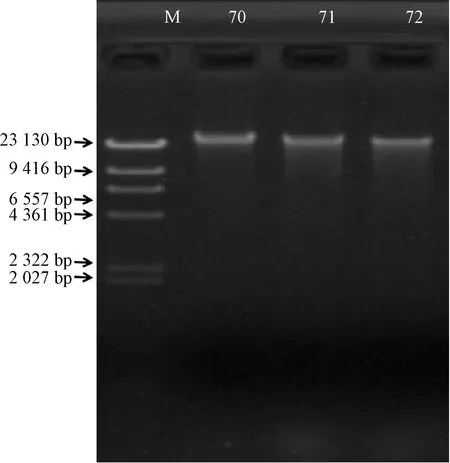
M,DNA maker;70、71、72分别为70、71、72号样本DNA。图1 改良CTAB法所提山桐子DNA电泳图谱
2.2 利用改良CTAB法提山桐子DNA的SSR标记结果
SSR标记具有共显性、高度重复性等优点,在分子群体遗传进化、辅助育种等方面应用广泛。本文利用改良的CTAB法提取6个山桐子样本DNA,采用李娜等[15]的8号引物进行SSR标记分型。图2显示,6个样本的SSR标记条带均比较清晰,表明改良的CTAB法所提取的DNA可以满足SSR标记相关分子试验所需。

M,DNA maker;左侧为maker各条带大小;70~75分别为70、71、72、73、74、75号山桐子样本。图2 利用改良CTAB法所提6个山桐子样本的SSR标记聚丙烯凝胶电泳结果
扩增片段长度多态性(AFLP)技术、简化基因组测序等技术可提供较高通量的标记数,在群体分析中具有较高的效率,但此类研究往往依赖于酶切效果,而基因组DNA样品纯度较低等因素可能影响限制性内切酶的活性,导致部分酶切位点未被酶切开,因此对DNA要求较高。酶切效率是评价简化基因组实验是否成功的一个关键指标。本文采用RsaⅠ+HaeⅢ组合对改良CTAB法所提的山桐子DNA进行酶切,进行酶切文库的质量评估,并利用IlluminaHiSeqTM 进行PE125 bp测序。本试验的酶切效率为90.32%,表明酶切效率正常。同时,测序reads插入片段长度主要为364~444 bp(图3),表明所提DNA可以满足基因组测序等试验要求。

图3 Reads插入片段分布
3 小结与讨论
常用的提取植物核酸的方法如SDS法、CTAB法等只适用于部分植物,用于山桐子DNA提取存在较大局限性。SDS法操作简单、温和,如本文数据显示,通过该方法可提取到一定量的山桐子DNA,但所得到的产物质量与纯度不高,糖类、蛋白质、盐类杂质较多。通过CTAB法,可提取纯度较高的山桐子DNA,且对蛋白质污染有较好的控制,DNA纯度有所提高。但酚类污染仍较严重,且山桐子样本DNA浓度与纯度变异幅度较大,试验中多次抽提试验周期较长。随着提取技术的发展,基于高效核酸吸附柱的核酸提取试剂盒出现,大大提高了核酸提取效率[15]。但本文数据显示,尽管试剂盒法提取的山桐子DNA纯度得以提升,但提升幅度较小,各山桐子样本DNA浓度仍较低。
Kobayashi等[19]研究发现,PEG洗脱液可有效洗脱植物代谢产物,在鹅掌楸高质量DNA提取中应用效果较好。在此基础上,本文以CTAB法为基础,裂解前进行PEG洗脱,并优化与简化后续CTAB法操作步骤,形成适宜山桐子高质量DNA提取的改良CTAB法。通过本文方法提取的山桐子DNA,DNA浓度可高达417.5~470.5 ng·μL-1,平均为438.93 ng·μL-1,为试剂盒法的8.5倍,所提各样本DNA蛋白质、糖类与盐污染得到极好的控制,DNA得率较高且完整,同时各样本浓度与纯度各指标变异幅度最少,可以满足分子生物学对样本DNA质量标准化的要求。采用本文改良CTAB法提取的山桐子DNA,可以满足SSR标记分型、简化基因组测序等相关分子试验所需,为山桐子分子生物学的开展提供了基础。

