基于新一代高通量测序技术分析拮抗酵母Cryptoccocus laurentii诱 导处理樱桃番茄果实后转录组学的变化
唐 琼,郑晓冬*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
樱桃番茄是世界范围内最重要的果蔬作物与模式植物之一[1],造成其采后病害的主要微生物是灰葡萄孢(Botrytis cinerea)和链格孢(Alternaria alternata),它们可能会长时间潜伏在果实表面,直到果实成熟、衰老或通过果实的机械伤口侵染果实组织,一般情况下,病原菌孢子进入果实伤口后会迅速萌发,同时启动相关致病机制,最终导致果实的腐烂变质[2-3]。长期以来,樱桃番茄果实采后真菌病害的控制主要依赖于化学杀菌剂,化学杀菌剂的普遍使用使得病原菌逐渐对其产生抗药性,此外,长期使用化学杀菌剂造成的毒性残留对环境、食品和人体存在潜在风险[4]。因此,寻找新型、绿色、安全的用于防治樱桃番茄采后病害的方法尤为必要。
在国内外研究报道的非杀菌剂方法中,利用安全有效的微生物,特别是生防酵母对病原菌的拮抗作用开展果实采后病害的生物防治手段在近10年来成为研究热点,并被认为是最有可能替代化学杀菌剂的方法之一[5-6]。罗伦隐球酵母(Cryptococcus laurentii)是目前国内外广泛研究的1 株采后生物防治微生物菌株,研究表明它不仅能有效直接地抑制苹果、梨、桃、葡萄、樱桃番茄、柑橘、杨梅、樱桃、草莓等果实的多种真菌病害[3,7-9],还能显著地在梨、枣、桃、葡萄和樱桃番茄果实中诱导抗性以增强其防御病害能力[10]。罗伦隐球酵母抑制病原菌的主要作用机制是营养和生存空间的竞争,而关于其增强果实抗病性机制的研究主要集中于:罗伦隐球酵母激发了果实中抗性相关关键酶如几丁质酶、β-1,3-葡聚糖酶等的活性,诱导相关抗性基因的表达,促进相关次级代谢产物的积累等[8,10-11],而其通过哪些抗性信号分子或信号通路激发果实内部响应机制的研究仍需要进行深入的探索。
转录组是连接基因组遗传信息与生物功能的蛋白质组的必然纽带,通过基于Illumina高通量测序平台的新一代转录组测序技术,在不需要物种基因组详细信息的情况下能够全面快速地获得某一物种特定组织或器官在特定状态下的几乎所有转录本序列信息[12-13],因而其可成为研究樱桃番茄果实响应拮抗酵母罗伦隐球酵母处理后差异表达基因变化的重要手段。罗伦隐球酵母处理后,果实体内被激发出复杂的抗性信号分子诱导果实内部抗性响应,此时通过转录组测序所获得的信息能如实反映出果实抗性响应调控网络。因此,本研究利用转录组测序技术对罗伦隐球酵母处理后的樱桃番茄果实进行转录组测序,获得樱桃番茄果实响应罗伦隐球酵母诱导的基因,并对差异表达基因进行GO(Gene Ontology)功能注释和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析,期望从RNA水平揭示罗伦隐球酵母的诱导机制和樱桃番茄果实的响应网络,为全面挖掘罗伦隐球酵母增强果实抗病性的作用机制提供基因组学的研究基础和依据。
1 材料与方法
1.1 材料与试剂
罗伦隐球酵母C. laurentii(Kufferath) Skinner(CGMCC No. 3590)为本实验保藏的1 株菌株。
PrimeScriptTM1stStrand cDNA Synthesis Kit、逆转录酶、PrimeScriptTMDouble Strand cDNA Synthesis、cDNA Library Construction、3’-Full RACE Core Set with PrimeScriptTMRTase、RNAiso Plus动物/植物/微生物/培养细胞总RNA提取试剂盒、PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒、SYBR®Premix ExTaqTM宝生物工程(大连)有限公司。
1.2 仪器与设备
光学显微镜 日本Olympus公司;血球计数板 上海医用光学仪器厂;QYC-211全温空气摇床 上海福玛实验设备有限公司;MLS-3750全自动灭菌锅 日本Sanyo有限公司;LRH-250生化培养箱 上海一恒科技有限公司;VS-840K-U超净工作台 苏净集团;3K-15离心机德国Sigma公司;电子天平 北京赛多利斯天平有限公司;移液枪 德国Eppendorf公司;旋涡振荡器 海门市其林贝尔仪器制造有限公司;StepOne Real-Time聚合酶链式反应(polymerase chain reaction,PCR)仪美国ABI公司;NanoDrop ND1000分光光度计美国Thermo公司;PTC-225型Thermal Cycler PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 番茄的选择和预处理
实验所用番茄(Solanum lycopersiconvar.cerasiforme)均为正常成熟度的新鲜(采摘当天送回实验室)果实。选择无机械损伤、未感染、大小和成熟度等外观品质均匀一致的番茄果实进行实验,用0.1%次氯酸钠溶液浸泡消毒1~2 min,用自来水冲洗并在室温下放干备用[9,14]。
1.3.2 罗伦隐球酵母的培养和收集
罗伦隐球酵母的培养、活化及收集参照Guo Jun等[15]的方法。
1.3.3 番茄果实组织样品制备
将番茄分别浸泡于1×108cells/mL的拮抗酵母细胞悬浮液和无菌蒸馏水10 min后取出,室温晾干后用PE塑料膜密封做保湿处理,并在恒温恒湿贮藏室(25 ℃,相对湿度95%)内贮藏,48 h后取样。取样时先用无菌手术刀将果皮切去,然后切下番茄赤道上接近表皮处薄薄一层果肉组织于研钵,马上用液氮冷冻后置于-80 ℃低温冰箱贮藏,以用于果肉组织RNA提取。每个处理3 个重复,每个重复包含20 个果实,整个实验重复2 次。
1.3.4 番茄果实伤口组织中总RNA的提取及cDNA文库的构建
将超低温冻结的番茄果实迅速转移到用液氮预冷的研钵中,用液氮研磨后按照RNAiso Plus试剂盒说明书提取其总RNA,然后用NanoDrop ND1000分光光度计检测RNA样品的浓度和质量,达到标准的RNA用于cDNA的合成。使用Oligod(T)的磁珠试剂盒富集mRNA,并在94 ℃条件下将mRNA断裂为约150~170 nt大小的片段,以打断后的mRNA为模板根据反转录酶试剂盒说明书合成一链cDNA,随后以第1链为模板合成二链cDNA,并使用试剂盒对合成的双链cDNA纯化、黏性末端修复、3’末端加上碱基“A”、连接接头以及纯化回收。
1.3.5 测序及数据过滤
采用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System分别对构建好的文库进行平均长度的测定和定量分析,cDNA文库质量检验合格后,使用高通量测序平台Illumina HiSeqTM4000进行测序,得到原始测序序列(raw reads),所有测序工作在深圳华大基因科技有限公司完成。数据分析之前需先去除包含接头的reads、去除未知碱基N含量大于5%的reads以及长度过大过小等低质量的reads,以得到高质量序列(clean reads)。
1.3.6 Unigene表达量计算和差异表达基因检测
使用短阅读子组装软件Trinity v2.0.6对clean reads进行组装,对组装后的转录本进行聚类去冗余,得到Unigene。Unigene表达量的计算使用RSEM软件(v2.2.5),该软件采用FPKM(fragment per kilo bases per million reads)方法计算基因表达量,以FPKM数值0.1作为判断基因是否表达的阈值。差异表达基因定义为差异基因筛选阈值错误发现率(false discovery rate,FDR)≤0.001且差异表达倍数≥2或≤0.5的基因,采用PossionDis方法进行检测。
1.3.7 差异表达基因GO功能注释和Pathway富集分析
根据GO及KEGG注释结果以及官方分类首先将差异基因进行GO功能注释和Pathway分类,接着使用R软件中的phyper函数进行Pathway富集分析。对P-value进行FDR校正,FDR≤0.01的Pathway视为显著富集。P-value计算如下:

式中:N为全基因组中的基因总数;M为功能基因集中的基因个数;n为目标基因个数;P-value为n个目标基因中至少有m个被功能基因注释的概率。
1.3.8 实时荧光定量聚合酶链式反应(real timequantitative polymerase chain reaction,RT-qPCR)对转录组结果的验证
cDNA第1链的合成步骤参照PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒说明书,用无菌水对反转录样品进行梯度(2、4、6、8、10 倍)稀释,并以梯度浓度cDNA为模板进行qPCR(每个浓度3 个重复),选取Ct值在15~25间的cDNA浓度进行后续实验,整个实验重复2 次及以上直至两次实验结果一致,qPCR实验详细步骤参照SYBR®Premix ExTaqTM试剂盒说明书。qPCR条件如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃复性30 s,上述过程往复循环35 次,溶解曲线条件如下:95 ℃变性15 s,以0.3 ℃为步阶从60 ℃升温至95 ℃,95 ℃保温15 s。利用StepOne Real-Time PCR(Applied Biosystem)仪检测反应体系荧光变化,相对定量计算采用2-ΔΔCt方法[16]。
目的基因的引物设计和合成均由生工生物工程(上海)股份有限公司完成,引物序列如表1所示。

表1 实时荧光RT-qPCR扩增目的基因的引物序列Table 1 Primers used for validation of microarray data by RT-qPCR
1.4 数据统计分析
实验数据采用SPSS/PC ver. II. x软件进行分析。组内比较个数为2 个,采用独立样品t检验进行平均数分离,每个实验设3 个以上重复并按照完全随机区组原则进行设计,P<0.05,差异显著,采用Origin 8.5软件进行作图。
2 结果与分析
2.1 测序数据的统计和质控报告
采用Illumina HiSeqTM4000高通量测序技术对无菌水对照组及罗伦隐球酵母处理组进行转录组测序,共测了8.93 Gb数据,经检测,样品各项检测参数达到质量要求。在未接种病原菌条件下,对照组和罗伦隐球酵母处理组测序后都得到34.58 Mb raw reads,其中过滤后的clean reads分别占86.57%和86.67%。数据过滤后,使用Trinity对clean reads进行组装得到转录本,对转录本进行聚类去冗余得到48 695 个Unigene,将Unigene比对到七大功能数据库进行注释,最终分别有31 952(NR:65.62%)、42 189(NT:86.64%)、20 098(Swissprot:41.27%)、12 065(COG:24.78%)、22 926(KEGG:47.08%)、5 778(GO:11.87%)、22 412(Interpro:6.03%)个Unigene获得功能注释,注释结果说明本次测序情况较为理想,适合之后的深度分析。
2.2 罗伦隐球酵母处理后的差异表达基因检测结果
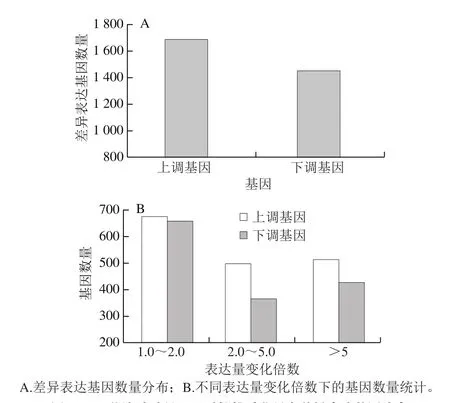
图1 罗伦隐球酵母处理后樱桃番茄果实差异表达基因分布Fig. 1 Distribution of differentially expressed genes in cherry tomato treated with C. laurentii
利用RSEM法计算各个样品的基因表达水平,并以FDR≤0.001且差异表达倍数≥2的条件用PossionDis方法进行差异表达基因的筛选和检测,发现1×108cells/mL罗伦隐球酵母处理番茄果肉组织后,3 141 个基因的表达量发生了变化,54%(1 689 个基因)的基因呈现上调表达趋势,46%(1 452 个基因)的基因呈现下调表达趋势(图1A)。5 倍以内表达量变化的基因占差异表达基因总数的69.98%,其中,表达量变化1.0~2.0 倍的基因占总数的42.44%,上调基因占21.49%,下调基因占20.95%;表达量变化2.0~5.0 倍的基因占总数的27.54%,上调基因占15.89%,下调基因占11.65%;5 倍以上表达量的基因共有943 个,其中上调表达515 个,下调表达428 个(图1B)。相较而言,罗伦隐球酵母处理番茄果肉组织后,表达量变化在2 倍以内的上调基因和下调基因的数量相当,而表达量变化在2 倍以上的基因中上调基因数量明显高于下调基因数量。
2.3 差异表达基因的GO功能注释和富集分析

图2 罗伦隐球酵母处理后差异表达基因的GO功能注释Fig. 2 GO annotation of differentially expressed genes treated with C. laurentii
GO旨在开发一个计算方法描述基因在分子、细胞和组织水平的功能体现,它有3 个本体,分别指基因的分子功能、所在的细胞位置和参与的生物过程,本实验根据GO注释结果和官方分类对差异表达基因进行功能注释(图2)。其中,催化活性相关基因占据12.79%,代谢过程占据相关基因12.42%,细胞过程相关基因占据10.59%。细胞杀伤进程、细胞外基质和细胞外区域、细胞核相关基因均显示上调表达趋势,而受体活性相关和再合成过程基因则呈现下调表达趋势。代谢过程、胁迫响应与催化活性相关基因较多呈现上调趋势,而细胞成分相关基因较多显示下调趋势。GO功能富集分析结果显示:差异基因所涉及的细胞位置中显著变化的GO terms是细胞外区域(GO:0005576),所参与的生物过程中显著变化的GO terms与植物系统防御通路相关,分别是防御反应(GO:0006952)和离子转运(GO:0006820)。
2.4 差异表达基因的Pathway富集分析
KEGG是处理生物通路、基因组、药物、疾病和化学物质之间联系的集成数据库,差异基因的Pathway富集分析结果表明差异表达基因分布在132 个通路中,其中排名前10的显著性富集通路如表2所示,这些差异表达基因主要涉及的通路如下:次生代谢产物的生物合成、植物-病原体相互作用、植物激素信号转导等路径。
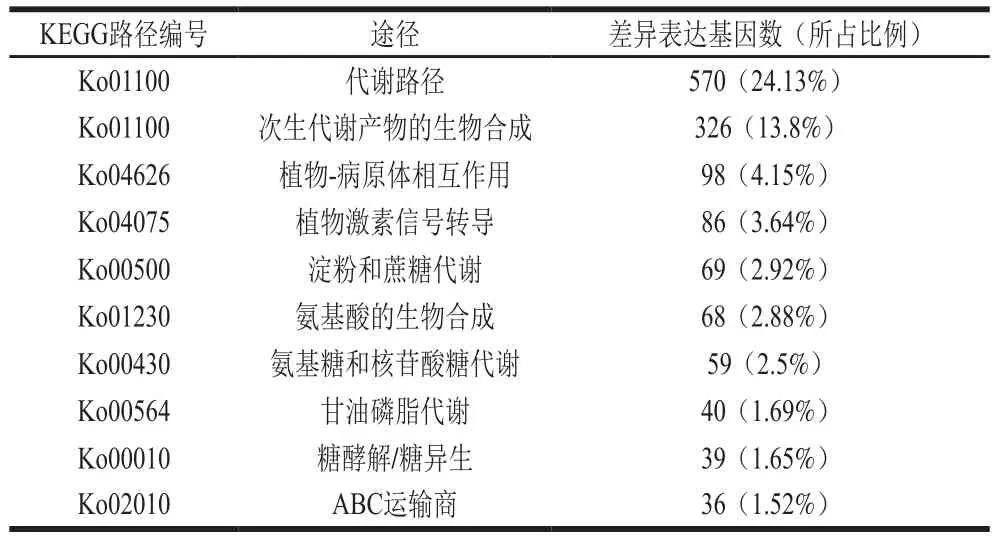
表2 罗伦隐球酵母处理后樱桃番茄果实中差异表达基因显著富集的10 条Pathway条目Table 2 Top 10 enrichment degree pathways of differentially expressed genes after treatment with C. laurentii
2.4.1 罗伦隐球酵母对番茄果肉组织中植物激素信号通路的影响
罗伦隐球酵母处理樱桃番茄果实引起果肉组织中大量植物激素代谢相关编码基因的差异表达,尤其是乙烯与茉莉酸代谢通路上的相关基因(表3)。例如,乙烯合成通路中1-氨基环丙烷-1-羧酸合酶基因(ACS)与1-氨基环丙烷-1-甲酸氧化酶基因(ACO)2 组关键基因,均发生不同程度上调表达(上调倍数1.13~6.32不等),茉莉酸合成通路中的关键酶基因AOS2均发生不同程度上调表达(上调倍数2.43~6.32不等)。乙烯信号通路中的乙烯响应因子Pti5基因的转录表达显著上调,上调表达倍数为4.89;茉莉酸信号通路上的转录因子基因MYC2、水杨酸信号通路上的受体蛋白基因NPR1及MAPK家族成员MAPK3、MAPK9均显著上调表达(上调倍数2.07~9.29不等)。经罗伦隐球酵母处理后的番茄果实组织中GH3类似蛋白(与生长素合成相关)编码基因(GH3.6)的转录也出现显著上调变化。但是,乙烯信号通路中的乙烯受体基因ETR、丝/苏氨酸蛋白激酶基因CTR1、茉莉酸代谢途径中负调控因子基因JAZ及水杨酸信号通路上的转录因子基因TGA7-like的转录表达显著下调。

表3 拮抗酵母对番茄果实组织中植物激素相关基因转录表达的影响Table 3 Effect of C. laurentii on cherry tomato genes related to phytohormone metabolism
2.4.2 罗伦隐球酵母对番茄果肉组织中次级代谢路径的影响

表4 拮抗酵母对番茄果实组织中次级代谢相关基因转录表达的影响Table 4 Effect of C. laurentii on cherry tomato genes related to secondary metabolism
罗伦隐球酵母诱导番茄果实抗病的过程中还引起了植物抗性相关的次级代谢路径的变化,大部分与生物碱、类黄酮、萜类化合物、氨基酸代谢有关,尤其是苯丙氨酸路径,如苯丙氨酸代谢中,苯丙氨酸解氨酶基因(PAL3和PAL5)、香豆素辅酶A基因(4CL3)和咖啡酰辅酶A-O-甲基转移酶基因(ATOMT)的转录水平均有不同程度的上调表达(表4)。
2.4.3 罗伦隐球酵母对番茄果肉组织中抗病相关路径的影响
在本实验中罗伦隐球酵母处理番茄果实后引起了大量病程相关蛋白(pathogen-related proteins,PRs)和转录因子编码基因转录的变化(表5)。其中,PRs基因(PR1、STH-2、TSI-1、PR1A1、PR10、PR06、PR-P2、PR5)发生不同程度的上调表达(上调倍数3.55~10.57)。

表5 拮抗酵母对番茄果实组织中抗病相关基因转录表达的影响Table 5 Effect of C. laurentii on defense-related genes in cherry tomato fruit
2.5 差异表达基因的RT-qPCR验证
本实验随机选取了12 个与植物抗性相关的转录因子基因(ERF1A-like、ERF2-like、Pti5、ERF018-like、TEM1-like、ABR1-like isoform2、Pti6、ABR1-like isoform1、ERF114-like、ERF054-like、CBF2、CBF1)进行qPCR分析,以验证转录组测序结果的可靠性,Actin为内参,结果如图3所示。经过罗伦隐球酵母处理后,番茄果肉组织中上述12 个转录因子基因中5 个基因显著上调表达(差异表达倍数>2),3 个基因显著下调表达。RT-qPCR分析显示,RT-qPCR验证结果与转录组测序结果中差异表达基因的变化趋势一致。

图3 基于RT-qPCR的樱桃番茄果肉组织基因转录表达分析Fig. 3 Differentially expressed genes detected by RT-qPCR
3 讨 论
罗伦隐球酵母作为生物激发子可以通过激活寄主内部复杂的抗性信号因子及其交互作用诱导果实内部抗性响应[17],前期研究结果表明,罗伦隐球酵母能显著诱导樱桃番茄果实对腐生营养型病原菌的抗性响应[10],为进一步探究罗伦隐球酵母诱导樱桃番茄果实抗病机理,采用高通量测序平台Illumina HiSeqTM4000对罗伦隐球酵母处理及对照处理的樱桃番茄果实进行转录组测序和功能分析,结果以差异表达倍数≥2或≤0.5为标准挑选差异表达基因,得到上调表达基因1 689 个,下调表达基因1 452 个。
3.1 植物激素信号通路参与罗伦隐球酵母诱导番茄果实抗病过程
植物激素在植物生物和非生物胁迫中起着重要的作用,目前大量研究报道表明乙烯、水杨酸、茉莉酸、脱落酸、生长素和细胞分裂素等是植物抗病信号转导途径中的关键调控因子[18]。其中,乙烯和茉莉酸是诱导系统抗性的关键信号分子,而水杨酸在其介导的系统获得性抗性中,通过与其下游的正调控因子NPR1互作,激活转录因子WRKY和TGA家族及PRs等抗性基因的表达,增强植物对营养型病原菌的抗性[19]。本实验中,罗伦隐球酵母诱导处理后,乙烯生物合成中的关键酶1-氨基环丙烷-1-羧酸合成酶基因(ACS)和1-氨基环丙烷-1-甲酸氧化酶基因(ACO)显著上调表达,而在乙烯信号转导途径中,乙烯反应负调控因子乙烯受体基因ETR显著下调表达,其下游的乙烯响应因子基因Pti5/6显著上调表达。研究报道显示,乙烯响应因子ERFs可通过GCC-box这一结构元调控PRs编码基因PR1、PR2、PR3、PR5等基因的表达,以作出相应的抗病响应[20],Guo Jun等[21]研究表明Pti5作为PRs基因的转录调控因子,在罗伦隐球酵母诱导条件下上调表达并直接调控PR5基因的上调表达,参与果实抗性反应,这与本实验的测序结果是一致的。其次,水杨酸代谢通路上的NPR1转录因子和PR1抗性蛋白基因分别上调表达7.51 倍和4.51 倍,同时水杨酸合成关键酶基因苯丙氨酸解氨酶编码及原因PAL也显著上调表达。在茉莉酸信号通路中,负调控因子JAZ蛋白家族可以与茉莉酸应答正调控转录因子MYC2结合,抑制茉莉酸早期应答基因的表达[22],本实验结果表明,罗伦隐球酵母处理后,JAZ基因显著下调表达8.32 倍,同时正转录因子MYC2基因显著上调表达9.29 倍,这暗示罗伦隐球酵母处理激活了茉莉酸诱导的信号传导路径。GH3类生长素参与植物诱导抗病过程,罗伦隐球酵母处理后的番茄果实组织中GH3类蛋白编码基因显著上调表达。综上所述,植物激素乙烯、茉莉酸、水杨酸、生长素信号通路参与了罗伦隐球酵母诱导激活樱桃番茄果实对灰霉的防御调控机制。
3.2 罗伦隐球酵母激活樱桃番茄果实次级代谢通路关键酶基因的转录表达和对能量代谢的影响
次级代谢由初生代谢衍生而来,是植物在长期进化过程中与环境相互作用而适应环境的结果,植物在受到病原菌侵染后,体内会产生并积累大量的次生代谢产物,其中,苯丙烷类、萜类、类固醇类等是主要的类型[23]。本实验结果显示,罗伦隐球酵母激活樱桃番茄果实次级代谢的相关基因主要有:苯丙氨酸解氨酶PAL、ATOMT1和香豆素辅酶A(4CL3)基因,这表明从整体基因转录水平上看,植物次级代谢尤其是苯丙烷类合成代谢过程在罗伦隐球酵母诱导樱桃番茄果实采后抗病性过程中发挥着重要作用。
植物抗病反应的激活是一个需要消耗能量的过程,植物体内防御机制的激活使能量代谢集中于逆境响应,因而会影响植物正常的生长、发育和繁殖功能[24]。本实验结果表明,罗伦隐球酵母处理后,樱桃番茄果实组织中与能量代谢相关的信号通路上的编码基因也发生了显著的差异表达,其中,次生代谢物质合成、淀粉和蔗糖代谢与糖酵解/糖异生代谢4 组代谢通路差异显著。在罗伦隐球酵母下调的番茄果实差异基因中,有35 个涉及淀粉和蔗糖代谢和16 个涉及糖酵解/糖异生代谢通路,分别占该代谢通路总蛋白的50.7%和41.1%,这揭示了罗伦隐球酵母处理部分抑制了番茄果实的能量代谢。
3.3 罗伦隐球酵母诱导樱桃番茄果实PRs的转录表达
PRs是植物抵御生物和非生物胁迫时产生和积累的一类蛋白质总称,在植物防卫体系中发挥着重要作用[25-26]。PRs蛋白可被划分为17 个家族,具有广泛而重要的生物学功能,采后果实PRs的研究主要集中于以下几类:PR-1是病原菌诱导的具有抗真菌活性的PRs,也是系统性获得抗性增强的标志[27-28];PR-2蛋白家族编码的β-1,3-葡聚糖酶能水解真菌的细胞壁的葡聚糖,因而具有抗真菌活性;PR-3、PR-4、PR-8和PR-11蛋白具有几丁质酶活性,它们能直接降解真菌细胞壁中的β-1,3-葡聚糖和几丁质,因而在植物防御反应中起非常重要的作用,苹果中的PR-8基因能被假丝酵母(Candida oleophila)和灰葡萄孢菌(Botrytis cinerea)诱导上调表达[25-26];PR-5具有增强膜透性、水解葡聚糖链、促进凋亡的作用[29],有报道表明,1×108cells/mL罗伦隐球酵母能显著诱导柑橘皮中PR-5的上调表达[15];PR-10因具有核糖核酸酶活性而成为17 种PRs中唯一具有抗病毒功能蛋白[30]。本实验结果表明,PR-1、PR-5、PR-10、PR-P2、PR-P6、PR-1A1等多组PRs基因参与了罗伦隐球酵母诱导樱桃番茄果实抗病过程,这表明罗伦隐球酵母诱导番茄果实抗病响应过程中,PRs发挥着重要作用,其作用机制主要包括促进细胞凋亡、降解病原真菌细胞壁组成成分、强化植物细胞壁等多种生理过程。
综上所述,本研究通过对罗伦隐球酵母处理组和无菌水对照组两个样本进行高通量转录组测序,在未接种病原菌条件下,对照组和罗伦隐球酵母处理组测序后的clean reads均有85%以上能够与参考序列匹配并且检测到3 141 个差异表达基因,随后采用GO、KEGG等数据库对处理组的差异表达基因进行功能注释和通路富集分析,结果表明这些差异表达基因涉及植物激素代谢、次级代谢和氨基酸代谢等多种与果实抗性密切相关的代谢路径和信号通路,此外,对随机选取的差异表达基因的RT-qPCR验证结果与转录组测序结果趋势一致。这些结果为全面揭示罗伦隐球酵母诱导果实抗病的分子作用机制提供了基础理论依据。

