红提和糯米复合发酵葡萄酒工艺优化及香气成分分析
叶林林,杨 娟,陈 通,李圆圆,吴峰华,刘兴泉*,何志平*
(浙江农林大学农业与食品科学学院,浙江 杭州 311300)
红提(Vitis vinifera ‘Red Globe')是我国鲜食葡萄的主要品种之一,含有较丰富的维生素、矿物质、氨基酸等,味道甜美、口感优良,是一种具有代表性的鲜食葡萄[1]。鲜食葡萄具有不耐贮运、易受机械损伤和杂菌污染等特点,严重影响商品价值,特别是我国南方地区,葡萄多在高温多雨的夏季集中上市,除了贮运问题,还有销售难题[2]。2016年我国鲜食葡萄产量为1 080万 t,占我国葡萄总产量的78.6%[3],而每年约有27%的鲜食葡萄采后腐烂[4]。因此,将鲜食葡萄酿成葡萄酒可以较好的解决这一问题,同时能提升鲜食葡萄经济价值。但鲜食葡萄含糖量相较于酿酒葡萄偏低,直接酿制的鲜食葡萄酒存在口感欠佳、口味偏淡等缺陷,依据鲜食葡萄自身特点,开发一种适合鲜食葡萄酒的酿造工艺具有较好的实际意义。
糖是酵母进行乙醇发酵的主要基质,适宜的糖度有利于乙醇发酵的进行[5]。葡萄中的含糖量常会受自然因素、地域因素、采收等影响而发生变化,当葡萄含糖量较低时,发酵前往往需要通过人工手段调整葡萄汁中的糖分来提升葡萄酒的乙醇体积分数及风味。过高的糖分会造成发酵环境渗透压过高,引起酵母菌体积萎缩,细胞膜及菌体内的酶受到破坏,从而抑制酵母菌的生长和代谢[6],而糖分过低会令酿成的葡萄酒口味淡薄,口感不佳[7]。红提葡萄的糖度在16°Brix左右,专业酿酒葡萄的糖度通常可以达到22°Brix以上[8]。因此,控制适当的初始糖度对于葡萄酒的发酵具有重要的意义。
糯米糖化液由糯米熟化后接种微生物糖化制得,富含多种氨基酸、糖类以及适量的有机酸、维生素和多种矿物质,是一种优良的发酵基质[9]。本研究以红提为原料,利用糯米糖化液作为红提葡萄酒的发酵外源糖提高红提葡萄酒品质。以响应面法优化复合发酵红提葡萄酒的发酵工艺,并采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术结合香气活性值(odor activity value,OAV)法分析葡萄酒中关键香气成分,为复合发酵红提葡萄酒品质提升提供借鉴。
1 材料与方法
1.1 材料与试剂
红提(品种为克伦生) 浙江省杭州市临安区浙皖农贸城;复兴糯米 南陵县复兴米业有限公司。
甜味型甜酒曲(主成分为米根霉)、葡萄酒酵母BV818 安琪酵母股份有限公司;焦亚硫酸钾(食品级) 淄博长城化工有限公司;4-甲基-2-戊醇(≥99%) 美国Sigma公司;其他试剂为实验室常用AR级试剂。
1.2 仪器与设备
QP-2010GC/MS GC-MS联用仪(配RTX-WAX毛细管色谱柱(30 m×0.25 mm,0.25 μm))、UV-1800紫外-可见分光光度计 日本岛津公司;50/30/μm DVB/CAR/PDMS萃取头 美国Supelco公司;0~32°Brix手持折光仪 上海精密科学仪器有限公司。
1.3 方法
1.3.1 复合发酵红提葡萄酒酿造工艺流程
红提→破碎↓糯米→浸泡→蒸熟→接种→糖化→过滤→灭菌→糯米糖化液→添加SO2→接种酵母→恒温发酵7 d→过滤→陈酿→成品酒。
具体步骤:糯米25 ℃浸泡8 h,至沸水锅内蒸20 min,淋饭法冷却后接入干糯米质量0.4%的安琪甜酒曲于发酵罐中30 ℃恒温糖化3 d,待糖化完成后过8 层绵纱布,并在85 ℃灭菌30 min得糯米糖化液。新鲜红提去坏果、去柄后漂洗,沥干后破碎得红提果浆。取红提果浆与糖化液按一定比例混匀后分装于发酵罐中,每个发酵瓶总体积为1 L。添加SO2(本研究中用焦亚硫酸钾替代,SO2当量为50%,下同),静置8 h后接入活化酵母于发酵罐中密封恒温发酵7 d,用8 层纱布过滤,静置48 h后取上清液陈酿。此工艺中红提和糖化液的初始糖度分别为:16°Brix和45°Brix,体积比1∶1、1∶2、1∶4、1∶6的初始糖度分别为30.5、25.7、21.8、20.1°Brix。
1.3.2 单因素试验
1.3.2.1 发酵菌种的确定
取糖化液与红提果浆按体积比1∶4混匀,添加80 mg/L的SO2,分别接种1 g/L的BV818、RW和SY酵母,在20 ℃温度条件下发酵7 d,比较其乙醇体积分数和花色苷含量。
1.3.2.2 发酵温度的确定
取糖化液与红提果浆按体积比1∶4混匀,添加80 mg/L的SO2、1 g/L的葡萄酒酵母BV818,分别在15、20、25、30 ℃温度条件下发酵7 d,比较其乙醇体积分数和花色苷含量。
1.3.2.3 体积比的确定
取糖化液和红提果浆分别按体积比1∶1、1∶2、1∶4、1∶6混匀,加入80 mg/L的SO2、1 g/L的选定酵母,在20 ℃温度条件下发酵7 d,比较其乙醇体积分数和花色苷含量。
1.3.2.4 酵母接种量的确定
取糖化液与红提果浆按体积比1∶4混匀,添加80 mg/L的SO2,分别添加0.5、1.0、1.5、2.0 g/L的选定酵母,在20 ℃温度条件下发酵7 d,比较其乙醇体积分数和花色苷含量。
1.3.2.5 SO2添加量的确定
取糖化液与红提果浆按体积比1∶4混匀,分别添加40、80、120、160 mg/L的SO2、1 g/L的选定酵母,在20 ℃温度条件下发酵7 d,比较其乙醇体积分数和花色苷含量。
1.3.2.6 复合发酵红提葡萄酒响应面优化试验
在单因素试验基础上,根据Box-Behnken响应面设计原理[10-11],选择SO2添加量、酵母接种量和发酵温度3 个因素进行响应面试验,以乙醇体积分数为响应值进行优化,所有试验均重复3 次。
1.3.3 乙醇体积分数和花色苷含量测定
乙醇体积分数测定方法参考GB/T 15038—2006《葡萄酒、葡萄酒通用分析方法》[12]测定。
花色苷含量采用pH示差法[13]。分别用pH 1.0的缓冲液(0.2 mol/L KCl-HCl(25∶67,V/V))和pH 4.5的缓冲液(0.2 mol/L NaAc·3H2O-0.2 mol/L HAc(1∶1,V/V))将1 mL样品液稀释至10 mL,混匀,在520 nm波长处测定吸光度。以1 mL蒸馏水加9 mL相应缓冲液作为空白对照组,总花色苷含量(以矢车菊色素-3-葡萄糖苷计)如下:

式中:A为吸光度;26 900为矢车菊色素-3-葡萄糖苷的摩尔消光系数/(L/(mol·cm));449.12为矢车菊色素-3-葡萄糖苷的摩尔质量/(g/mol)。
1.3.4 复合发酵红提葡萄酒香气成分分析
香气萃取:采用顶空固相微萃取法[14-15]。取酒样5 mL于20 mL顶空瓶中,加入1 g NaCl,加入10 μL由色谱级无水乙醇稀释1 000 倍的4-甲基-2-戊醇为内标,放入磁力转子,设置转速800 r/min,45 ℃平衡10 min。插入经老化的萃取头(250 ℃老化30 min),45 ℃顶空萃取30 min,将萃取头插入GC-MS进样口,解吸5 min。
色谱条件:进样口温度250 ℃;升温程序:40 ℃保持2 min,以8 ℃/min升至160 ℃,保持1 min,以10 ℃/min升至230 ℃,保持5 min;载气:高纯He(99.999%);载气流速:1.00 mL/min;不分流进样。
质谱条件:电子电离源;电子能量:70 eV;离子源温度:230 ℃;接口温度:250 ℃;扫描模式:Scan;扫描范围:m/z35~500。
香气成分分析:对GC-MS采集的数据结合谱库NIST 08进行定性,以各香气物质相对于内标物4-甲基-2-戊醇含量进行定量。主要香气成分由OAV法确定,当香气物质的OAV大于1时能对葡萄酒香气产生贡献,OAV越大,对葡萄酒香气的贡献就越大[16]。
1.4 数据处理
应用Graphpad Prism 6和SPSS 22软件进行数据处理,Design Expert 8软件进行响应面优化处理。所有实验均重复3 次。
2 结果与分析
2.1 酵母菌的确定

表1 酵母菌对复合发酵红提葡萄酒的乙醇体积分数和花色苷质量浓度的影响Table 1 Effect of yeast type on concentration of alcohol and anthocyanins in wine
由表1可知,利用BV818酵母发酵的红提葡萄酒具有较高的乙醇体积分数和花色苷含量,因此选定BV818酵母为发酵菌种进行下一步实验。
2.2 复合发酵红提葡萄酒单因素试验
2.2.1 发酵温度对葡萄酒乙醇体积分数及花色苷含量的影响
由图1可知,当发酵温度为20 ℃时,葡萄酒的乙醇体积分数最高,为(12.4±0.2)%。在低温下,酵母代谢活动受抑制,产酒能力下降;而温度过高时,酵母代谢增强,衰老过快,成品酒的乙醇体积分数偏低、酒体粗糙、口感不佳[17]。当温度升高时,葡萄酒中的花色苷含量随着温度升高呈下降趋势,发酵温度越高花色苷降解越多。综合考虑,选择发酵温度20 ℃进行下一步实验。

图1 发酵温度对红提葡萄酒乙醇体积分数和花色苷质量浓度的影响Fig.1 Effect of fermentation temperature on concentrations of alcohol and anthocyanins in wine
2.2.2 体积比对葡萄酒乙醇体积分数及花色苷的影响

图2 体积比对红提葡萄酒乙醇体积分数和花色苷质量浓度的影响Fig. 2 Effect of substrate ratio on concentrations of alcohol and anthocyanins in wine
由图2可知,花色苷随着体系中红提比例的增加而增加,发酵体系中红提占比越多花色苷含量越高,体积比为1∶1和1∶2的花色苷含量显著低于体积比为1∶4和1∶6的(P<0.05),因此,体系中糖化液比例过高不利于酒体外观形成。乙醇体积分数随着料液比中红提比例的增加而减少,其比例大于1∶4时减少的趋势变缓。在一定范围内,糖化液占比越高,发酵体系的乙醇体积分数越高,过高浓度的糖分会引起发酵体系的渗透压偏高,不利于酵母菌生长,导致发酵体系乙醇转化率偏低[17]。按照每生产1 g乙醇需要消耗糖分1.7 g的理论值计算[18],体积比为1∶1、1∶2、1∶4、1∶6分别对应的理论乙醇体积分数应为17.94%、15.18%、12.80%、11.84%。实际中,其乙醇体积分数分别达到理论值的93.10%、96.25%、98.57%、98.14%,可见在1∶1和1∶2的体积比时体系内乙醇转化率偏低。体系内糖化液占比过高还会导致米酒味较重,不利于红提葡萄酒的感官效果。此外,对于葡萄酒而言,在一定范围内较高的乙醇体积分数有利于酒体后期的贮藏,综合考虑,选择体积比为1∶4进行下一步实验。
2.2.3 酵母菌接种量对葡萄酒乙醇体积分数及花色苷的影响
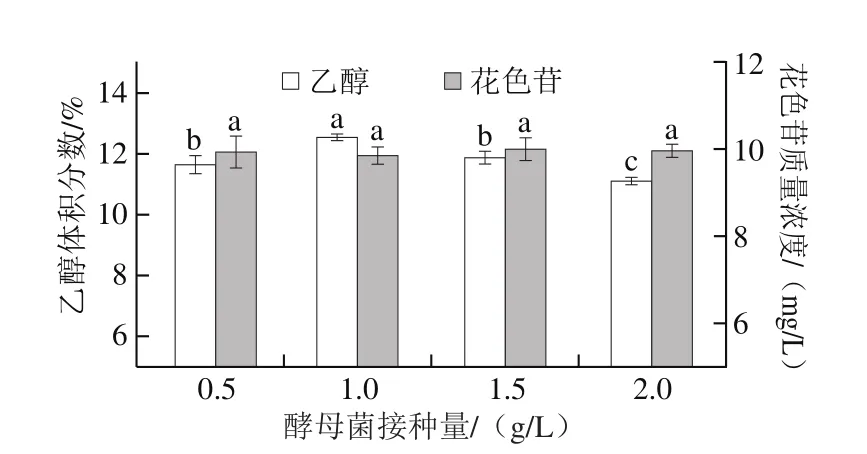
图3 酵母菌接种量对红提葡萄酒乙醇体积分数和花色苷质量浓度的影响Fig. 3 Effect of yeast inoculum size on concentrations of alcohol and anthocyanins in wine
由图3可知,随着酵母接种量的增加,乙醇体积分数呈先上升后下降的趋势,当接种量为1 g/L时乙醇体积分数最高,达到(12.6±0.1)%。接种量过低时发酵启动时间推迟,同时也增大了发酵体系感染杂菌的机会。而接种量过大时,会消耗发酵体系中的养分用于自身增殖扩代,用于生产乙醇的底物就会相应减少,不利于葡萄酒的形成,并且接种量过多还会引起酒体的酵母味过重,导致葡萄酒品质降低[19]。酵母的接种量对葡萄酒花色苷含量的影响变化不显著(P<0.05)。综合考虑,选择酵母接种量为1 g/L进行下一步实验。
2.2.4 SO2添加量对葡萄酒乙醇体积分数及花色苷质量浓度的影响

图4 SO2添加量对乙醇体积分数和花色苷质量浓度的影响Fig. 4 Effect of yeast inoculum amount on concentrations of alcohol and anthocyanins in wine
葡萄酒生产过程中,需加入适量的SO2达到抑制有害微生物、抗氧化、护色、灭酶等作用[20]。由图4可知,随着SO2添加量的增加,葡萄酒的乙醇体积分数先增加后减少,当SO2添加量为80 mg/L时乙醇体积分数最高,达到(12.6±0.1)%。发酵体系中的SO2浓度过低则酒体易受杂菌污染,此时杂菌会与酵母菌进行发酵基质的竞争,不利于酵母菌产酒,而过高的SO2浓度在抑制杂菌的同时也令酵母菌活性大大降低,不利于酵母菌产酒。葡萄酒中花色苷的2号位碳容易受到HSO3-的亲核攻击,形成亚硫酸氢盐加成物[21],导致其花色苷含量下降,SO2添加量越多葡萄酒花色苷含量越少。综合考虑,选择SO2添加量为80 mg/L进行下一步实验。
2.3 复合发酵葡萄酒发酵条件的响应面优化试验
2.3.1 响应面试验结果与分析
根据Box-Behnken试验设计原理,在单因素试验结果的基础上,进行响应面分析试验,试验设计与结果见表2。

表2 响应面试验设计与结果Table 2 Experimental design with results for response surface analysis
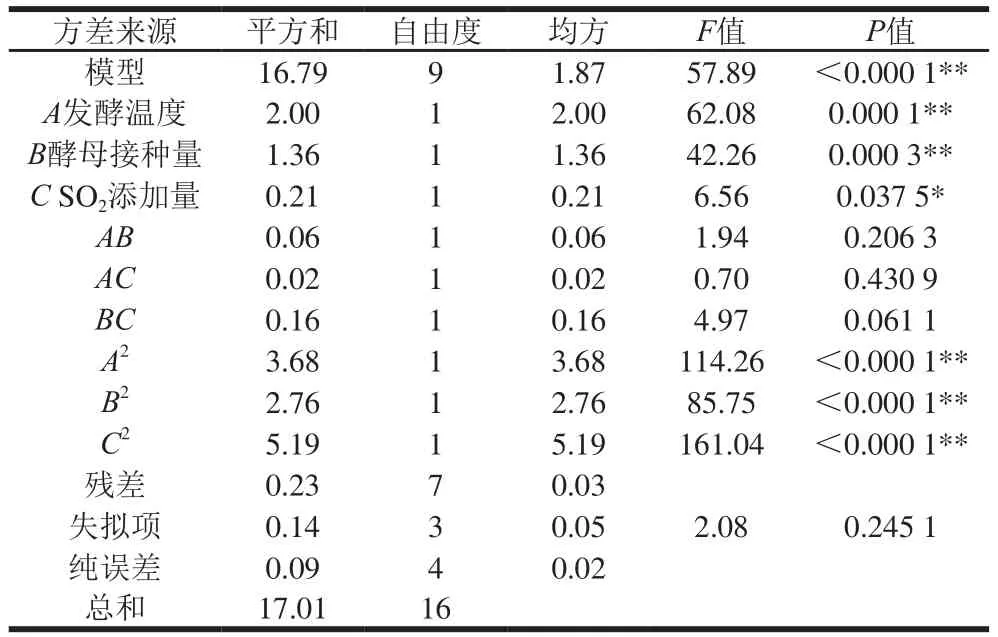
表3 回归方程方差分析Table 3 Analysis of variance for each term of the fi tted regression model
利用DXP 8.0软件对表2据进行分析,建立如下回归模型:Y=12.62+0.50A+0.41B+0.16C+0.12AB+0.075AC+0.20BC-0.94A2-0.81B2-1.11C2。将表2中的数据进行多元回归分析(表3)。由表3可知,模型P<0.000 1,说明该模型极显著性,失拟项P>0.05,不显著,同时模型的决定系数R2=0.986 7,表明试验结果与模型拟合度相对良好,可以使用该模型推测试验结果。在因素作用中A发酵温度、B酵母接种量以及二次项A2、B2、C2对乙醇体积分数的影响极显著(P<0.01);SO2添加量对乙醇体积分数的影响显著(P<0.05);交互作用AB、BC、AC对乙醇体积分数的影响不显著(P>0.05)。交互作用响应面图见图5。

图5 各因素交互作用对复合发酵红提葡萄酒乙醇体积分数影响的响应面图Fig. 5 Response surface and contour plots showing the interactive effects of operating parameters on alcohol concentration of wine
2.3.2 回归模型验证实验
经回归方程优化后得到最佳工艺参数为发酵温度21.46 ℃、酵母接种量1.15 g/L、SO2添加量84.39 mg/L,此条件下复合发酵葡萄酒的乙醇体积分数预测值可达12.76%。将此工艺条件进行适当调整,参数为发酵温度21 ℃、酵母接种量1.2 g/L、SO2添加量84 mg/L,对该工艺进行3 次重复性验证,测得复合发酵葡萄酒的乙醇体积分数为(12.7±0.1)%,与预测值相近,说明该模型能很好的预测复合发酵葡萄酒发酵条件与乙醇体积分数的关系。对优化后的复合发酵红提葡萄酒理化指标进行分析(表4)可知,该葡萄酒符合GB 15037—2006《葡萄酒》中关于乙醇体积分数不小于7%的标准;表观颜色为桃红色、酒体澄清透明;总糖含量达到干型酒标准,发酵完全,酸度适宜;酒体具有纯正的果香及酒香、无酸败,葡萄酒风格良好。

表4 复合发酵红提葡萄酒理化指标Table 4 Physicochemical indexes of red globe wine
2.4 复合发酵葡萄酒香气成分GC-MS分析
图6 复合发酵红提葡萄酒GC-MS总离子流图Fig. 6 GC-MS chromatogram of red globe wine
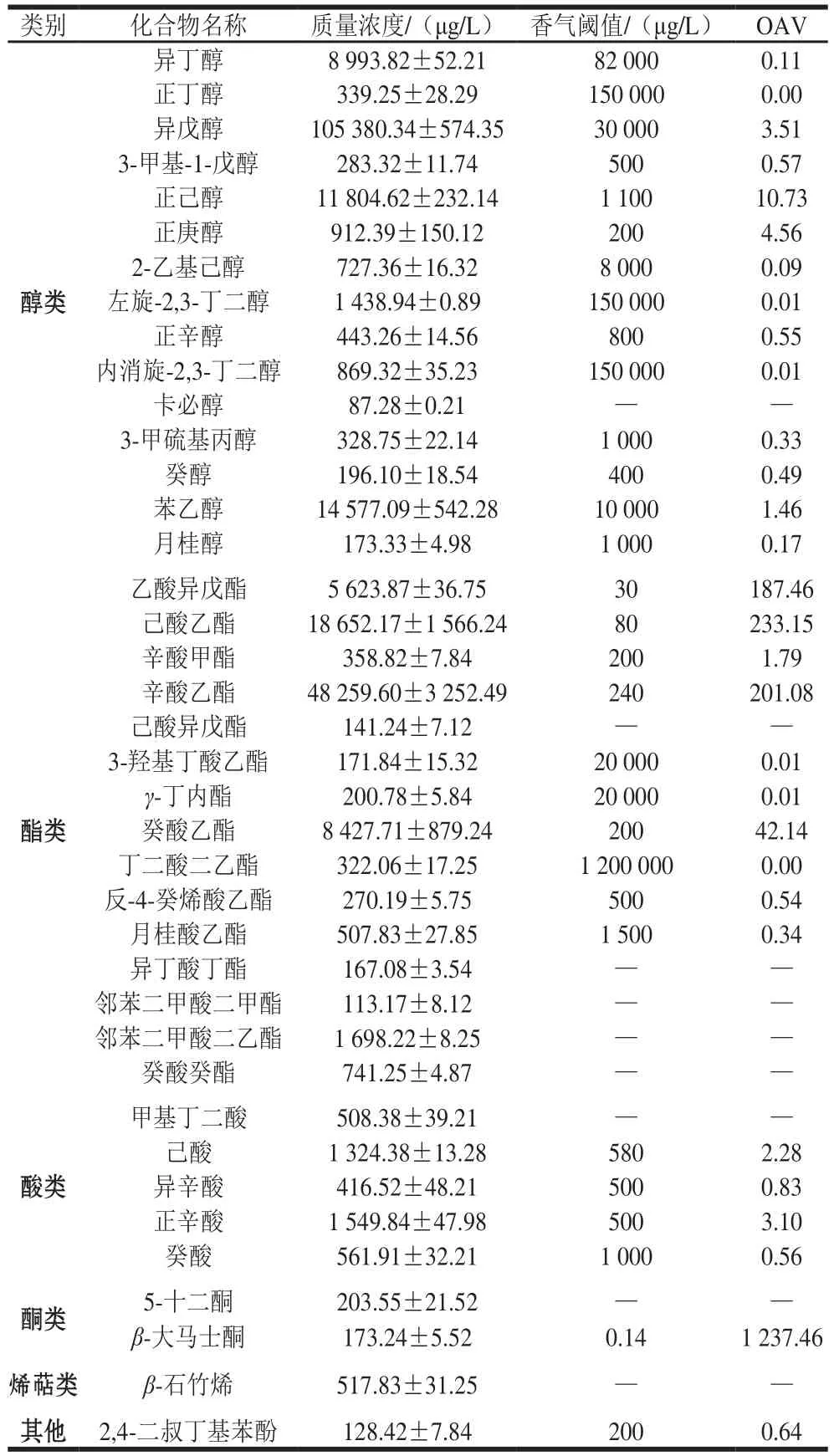
表5 复合发酵红提葡萄酒香气成分鉴定结果Table 5 Aroma composition of red globe wine
复合发酵红提葡萄酒香气成分的总离子流图见图6,分析鉴定结果见表5。通过GC-MS分析复合发酵红提葡萄酒香气成分共鉴定出香气物质39 种,包括醇类15 种、酯类15 种、酸类5 种、酮类1 种、烯萜类2 种以及苯酚类1 种。其中大于香气阈值的有12 种,包括醇类4 种、酯类5 种、酸类2 种、烯萜类1 种。
OAV法是目前评价葡萄酒挥发性香气成分较为客观的方法[26]。醇类物质是葡萄酒中挥发性物质中含量最高的一类,其中的高级醇对酒体的复杂性具有重要作用。高级醇又称为杂醇,是指含有3 个及以上碳原子的一元醇[27],当其质量浓度不超过300 mg/L时,对酒体香气复杂性具有积极作用[25]。本研究中红提葡萄酒高级醇总量为128.44 mg/L,这对酒体香气具有较积极的作用。本研究中OAV大于1的高级醇有正己醇、正庚醇、异戊醇、苯乙醇,这些醇为红提酒带来了玫瑰香、甜香、草木香等香味特征。
酯类是葡萄酒中的第二大挥发性成分,长期以来被认为是葡萄酒香气的重要贡献者,它们是葡萄酒中果香的主要来源之一[28]。复合发酵红提葡萄酒中共检测出酯类16 种,超过香气阈值的有5 种,其中作为发酵酒主体香气物质的4 种酯类(乙酸异戊酯、己酸乙酯、辛酸乙酯与乙酸乙酯)中有3 种被检出,分别是己酸乙酯、辛酸乙酯、乙酸异戊酯[17],三者的OAV分别达到了223.15、201.08、187.46,可认为是复合发酵红提葡萄酒的酯香代表,为葡萄酒带来了香蕉香、花香、菠萝香、脂香等香气特征。
葡萄酒中挥发酸含量过高会产生一些腐败味、脂肪味等[29]。有研究发现C6~C10的脂肪酸对葡萄酒具有较大影响,当其质量浓度在4~10 mg/L时,酒体具有愉快的香气,大于20 mg/L时则对酒体香气不利[30]。复合发酵红提葡萄酒中共检测出5 种酸类物质,其中OAV大于1的有正己酸和正辛酸,其含量为1.32 mg/L和1.55 mg/L,对酒体的香气具有一定的积极作用。
β-大马士酮属于C13-降异戊二烯类的化合物,其香气阈值非常低,当其质量浓度达到0.14 μg/L就可达到人体嗅觉阈值,其对葡萄酒的香气贡献具有重大作用,是很多葡萄酒诸如霞多丽、西拉、品丽珠等的重要香气物质[31]。本研究中复合发酵红提葡萄酒中的β-大马士酮的含量虽然仅为173.24 μg/L,但其OAV达到1 237.46,是该酒的主体香气物质之一。β-大马士酮的存在可以增强己酸乙酯果香并掩盖葡萄酒的生青味[32],同时给葡萄酒带来甜香、异域花香、炖苹果的香味,对酒体香气特征起重要的贡献作用。
3 结 论
本研究通过单因素试验和Box-Behnken响应面试验优化复合发酵红提葡萄酒,确定最优发酵工艺条件为发酵温度21 ℃、酵母接种量1.2 g/L、SO2添加量84 mg/L、体积比1∶4,在此条件下发酵7 d得到了乙醇体积分数为12.7%的红提葡萄酒。
采用HS-SPME萃取葡萄酒挥发性香气成分,通过GC-MS结合OAV法分析复合发酵红提葡萄酒的香气成分共鉴定出39 种香气物质。其中OAV较高的有12 种物质,主要为β-大马士酮、己酸乙酯、辛酸乙酯、乙酸异戊酯、癸酸乙酯,同时产品具有典型的葡萄酒酯香与果香。
本研究以糯米糖化液作为外源糖,进行红提葡萄酒的复合发酵。该法可提高红提葡萄酒的乙醇体积分数,同时保证葡萄酒的特征风味。为鲜食葡萄酒新工艺提供一定借鉴与参考。

