黏管藻的分子鉴定与生长特性研究
王昊林 卞 瑶 王永宇 李佳俊 王宏伟
(辽宁师范大学生命科学学院, 大连 116081)
黏管藻[Gloiosiphonia capillaris(Hudson) Carmichael]隶属于红藻门(Rhodophyta), 杉藻目(Gigartinales), 黏管藻科(Gloiosiphoniaceae), 黏管藻属(GloiosiphoniaCarmichael)。广泛分布于大西洋和太平洋, 国内主要分布于辽宁、山东、福建, 生长在潮间带的石沼中[1]。目前黏管藻属在全世界共报道了3个种, 模式种为黏管藻[G. capillaris(Hudson)Carmichael], 另外2个种为加利福尼亚黏管藻[G.californica(Farlow) J. Agardh]和轮生黏管藻(G.verticillarisFarlo)。对于黏管藻的研究源于18世纪70年代。Hudson[2]在英国发现了该种, 并将其命名为Fucus capillarisHudson。Berkeley[3]发现F. capillarisHudson的形态结构明显区别于墨角藻属(Fucus)的其他种, 依据该种建立了黏管藻属并将该种作为黏管藻属的模式种。Edelstein[4]对黏管藻的生活史进行了研究, 发现黏管藻生活史为异型世代交替, 其四分孢子体为壳状。夏邦美[1]与曾呈奎[5]对黏管藻的外部形态和内部结构进行了研究。Saunders等[6]对产自加拿大的黏管藻的核酮糖1,5-二磷酸羧化酶/氧化酶大亚基(rbcL)基因序列进行了分析, 从分子水平明确了其分类地位。
随着近几年大连海域海洋资源的过度开发以及围填海等行为, 在谋求社会发展和经济效益的同时也导致了近海岸海洋生态系统功能退化以及海水富营养化形势加剧[7]。环境的剧烈变化导致大连海域潮间带大型底栖海藻的物种组成以及群落结构发生了改变, 如大连獐子岛沿岸叉节藻(Amphiroa zonata)、柔质仙菜(Ceramium tenerrimum)等海藻分布范围越来越小甚至消失, 石莼(Ulva lactuca)、浒苔(Ulva prolifera)等海藻大量繁殖, 绿潮现象越来越严重[8]。藻类的大量繁殖会带来严重的危害,如强壮硬毛藻(Chaetomorpha valida)的大量繁殖给大连瓦房店和复州湾的海参养殖业带来了巨大的经济损失[9], 浒苔(U. prolifera)的大规模暴发引发绿潮灾害, 给黄海近岸海域造成了严重的社会影响[10],同时藻类的大量死亡会消耗水体中的溶解氧, 导致水体表层和底层的物理、化学性质产生不利变化[11]。笔者在标本的采集调查时发现大连海域刺松藻(Codium fragile)、海萝(Gloiopeltis furcate)、亮管藻(Hyalosiphonia caespitosa)等常见海藻的分布范围由于海洋生态环境的恶化而变得越来越小, 甚至消失。因此有必要对大连海域海藻的种类、分布及生物量等进行详细调查与评估, 达到物种保护和灾害预防的目的。黏管藻作为大型经济海藻, 在大连沿岸广泛分布, 其含有的生物活性物质具有抗炎、抗肿瘤、抗氧化和免疫抑制的作用[12]。但关于其生长状态、资源现状、生长周期与繁殖盛期、温度性质等研究未见报道。本研究将对分布在大连沿岸的黏管藻的外部形态、营养与生殖结构、生物量、成熟个体比例与成熟个体生物量/总生物量(R/T指数)的变化、温度性质等进行详细研究, 并通过rbcL和COⅠ基因序列分析结合形态结构对其进行准确的鉴定。研究结果将明确大连沿岸黏管藻的资源现状; 确定其生长周期与繁殖盛期, 为其物种的保护和繁育提供理论依据; 确定黏管藻在海洋水体污染的监测中的作用和地位, 为海洋生态环境的监测提供理论依据, 为分布于全国其他海域的黏管藻的研究提供参考。
1 材料与方法
1.1 采集地点
本研究样本均采自辽宁省大连海域礁石较多、生态环境保护较好的区域。采集地点的布设如图 1所示, 共布设了6个采集地点, 分别位于黑石礁(121°34′7.91″E, 38°52′40.5″N)、付家庄(121°37′58.3″E, 38°52′8.77″N)、石槽(121°41′51.0″E,38°52′24.7″N)、金石滩(122°1′54.8″E, 39°5′6.15″N)、獐子岛(122°43′25.9″E, 39°1′32.6″N)和海洋岛(123°9′56.4″E, 39°4′27.7″N)。
1.2 样本的采集与处理
根据海洋生物调查规范[13], 在2016年3月至2018年2月每个月大潮期间进行样本采集, 包括定性采集和定量采集。
定性采集: 黏管藻生长在潮间带的岩石上或石沼中(图 2A)。参照王永宇等[14]的方法, 选择结构完整的藻体进行采集, 将藻体在解剖镜下清理干净。部分新鲜藻体用于制作冰冻切片, 使用光学显微镜(Olympus BH2)观察藻体的内部结构, 用照相机(Nikon HFX-ⅡA)拍摄照片并记录结果, 另一部分制成硅胶干燥标本, 用于分子分析。选择结构完整的藻体制成腊叶标本并编号, 保存于辽宁师范大学生命科学学院植物标本馆(LNU)。
定量采集: 参照王永宇等[14]的方法, 在每个采集地点黏管藻生长旺盛的区域布设2个25 cm×25 cm的样方(图 2B), 采集样方内的黏管藻, 用吸水纸吸干藻体表面水分, 放置在65℃的烘干箱中干燥24h,称重并记录每个样方内黏管藻的生物量。统计每个样方内成熟藻体的数目, 并计算成熟个体比例与R/T指数(成熟个体的生物量/总生物量)[15]。
1.3 DNA提取与PCR扩增
使用植物基因组DNA提取试剂盒(北京天根公司)进行藻体DNA的提取, 将提取到的DNA进行PCR扩增。引物设计参照姜朋[16]的方法, 引物组合如表 1所示, 均由上海生工生物公司合成。rbcL与COⅠ基因的PCR反应程序参照王永宇等[14]的方法,检测后的样品均由上海生工生物公司纯化和测序。
1.4 rbcL、COⅠ基因序列分析
从每个采集地点选取2个黏管藻样本, 获得12条rbcL序列与12条COⅠ序列。从GenBank中获取了5个种的rbcL序列、3个种的COⅠ序列(表 2)。获取rbcL序列的物种包括产自加拿大的黏管藻、产自美国的黏管藻属的轮生黏管藻、产自加拿大黏管藻科的Plagiospora gracilis, 而产自加拿大的亮管藻(H. caespitosa)和Schimmelmannia plumosa则作为外群种。获取COⅠ序列的物种包括产自加拿大的黏管藻属的轮生黏管藻, 产自山东青岛的亮管藻和产自加拿大的S. plumosa则作为外群种。应用软件Clustalx (1.83)进行序列比对, MEGA6.0进行碱基差异度分析及构建系统树, 使用最大似然法Maximum likelihood (ML)法、临近法Neighbor joining(NJ)法和最大简约法Maximum parsimony (MP)法构建系统发育树。计算遗传距离模型为Number of differences和Kimura 2-Parameter, Substitutions Type为d:Transitions+Transversions, Bootstrap重复1000次[13]。
2 结果
2.1 黏管藻配子体个体形态的变化
六个采集地点的黏管藻配子体均直立, 单生或丛生, 质地胶质, 红色或紫红色, 固着器呈圆盘状。主轴明显, 线形圆柱状或亚圆柱状。分枝较密, 以对生、互生的方式排列在轴的所有面, 所有分枝又密被有与它们相似的较短的次分枝。但不同采集地点的配子体长度和宽度存在差异, 采自獐子岛与海洋岛的配子体在长度和宽度上明显高于其他4个采集地点(表 3)。四分孢子体壳状, 很难确定所采集的壳状海藻是否为黏管藻, 故不做研究。
3月初, 配子体幼苗开始出现, 藻体长度小于1 cm(图 3A)。3月中旬, 藻体出现分枝, 藻体长度达到2—2.6 cm (图 3B)。3月末, 藻体长度达到3.7—4.2 cm(图 3C)。4月下旬, 藻体长度达到3.8—6.3 cm, 部分藻体上可发现成熟的囊果(图 3D)。5月, 藻体快速生长, 藻体长度达到5.2—9.1 cm, 囊果集中成熟(图 3E)。6月, 藻体长度达到6—15 cm (图 3F), 其中最大长度可达20 cm (图3G), 囊果全部发育成熟。7月, 当黏管藻的果孢子释放完成后, 藻体颜色逐渐变浅, 腐烂消失。8月至次年2月未采集到黏管藻配子体。
2.2 黏管藻配子体的营养结构与生殖结构
营养结构: 从次分枝顶端的横切面观中可以观察到一个近圆形的中轴细胞以及四个围轴细胞, 围轴细胞和中轴细胞呈十字形排列, 在中轴细胞和围轴细胞间可观察到假根丝细胞(图 4A)。围轴细胞逐渐衍生成排列紧密的皮层细胞, 在衍生完毕后,围轴细胞消失。在次分枝中端只能观察到皮层细胞、中轴细胞和假根丝细胞(图 4B)。在次分枝末端中轴细胞消失, 只能观察到皮层细胞以及假根丝细胞(图 4C)。分枝与次分枝营养结构一致。从主枝上端的横切中可以观察到髓部从中间开始分裂(图4D)。主枝上端至末端内部中空呈管状, 藻体横切呈椭圆形(图 4E)。皮层由6—10层细胞组成, 厚度为45—80 μm, 外皮层由2—3层排列紧密的圆形或椭圆形细胞构成, 内皮层由4—7层不规则的近方形或卵形细胞构成。髓部充满疏松排列的髓丝, 长15—50 μm, 宽2—3 μm, 在髓部可以观察到假根丝细胞(图 4F)。

图 2 黏管藻的野外生境与样方设置Fig. 2 The wild habitat and setting of the quadrat (25 cm×25 cm) for G. capillaris sampling
生殖结构: 黏管藻配子体雌雄同体, 囊果突出藻体表面, 呈球形或半球形, 通常2—4个囊果聚集在一起。果胞枝生殖枝丛与辅助细胞生殖枝丛均由内皮层细胞产生。果胞枝生殖枝丛主枝较短包含3个细胞, 生长于一个较大的颜色较深的支持细胞上, 最上面是一个带有一条细长受精丝的较小的果胞, 其下有一个下位细胞, 受精丝伸直或弯曲指向藻体表面(图 4G)。辅助细胞生殖枝丛主枝较长,包含6个细胞, 辅助细胞枝末端细胞为辅助细胞。辅助细胞带有3—4个由2—5个细胞组成的侧枝(图 4H)。在受精后, 果胞产生联络丝, 进而与辅助细胞相连, 辅助细胞与枝丛主枝上的其他细胞融合并逐渐形成一个延伸的融合复合体。该复合体末端产生产孢丝, 产孢丝末端形成果孢子, 辅助细胞生殖枝丛的侧枝与周围的髓丝相互连接和缠绕, 形成嚢果被包围果孢子(图 4I)。果孢子不断增多, 可以观察到融合完毕的融合复合体(图 5J)。成熟囊果近球形, 直径100—140 μm。果孢子卵圆形, 直径6—9 μm (图 5K)。囊果成熟后果孢子通过囊孔释放。精子囊未见。

表 1 rbcL与COⅠ序列扩增所需引物Tab. 1 Primers used in the study
2.3 黏管藻配子体的生物量、成熟个体比例与R/T指数的变化
通过统计3—7月每个采集地点每个样方内的数据发现, 3—6月, 黏管藻的平均生物量一直增大,6月平均生物量达到顶峰, 平均生物量为3.628 g/m2(表 4), 其中獐子岛和海洋岛采集点的黏管藻的生物量最高, 分别为4.023和4.132 g/m2。7月随着海水温度升高, 平均生物量减小, 8月至次年2月未采集到黏管藻个体。
当黏管藻配子体上出现生殖器官果胞与精子囊时, 藻体即成熟。4月下旬黏管藻配子体开始出现生殖器官, 样方内成熟个体比例为10% (表 5),R/T指数为9% (表 6)。5月囊果集中成熟, 成熟个体比例为61%,R/T指数为60%。6月份藻体全部成熟,成熟个体比例及R/T指数均为100%。
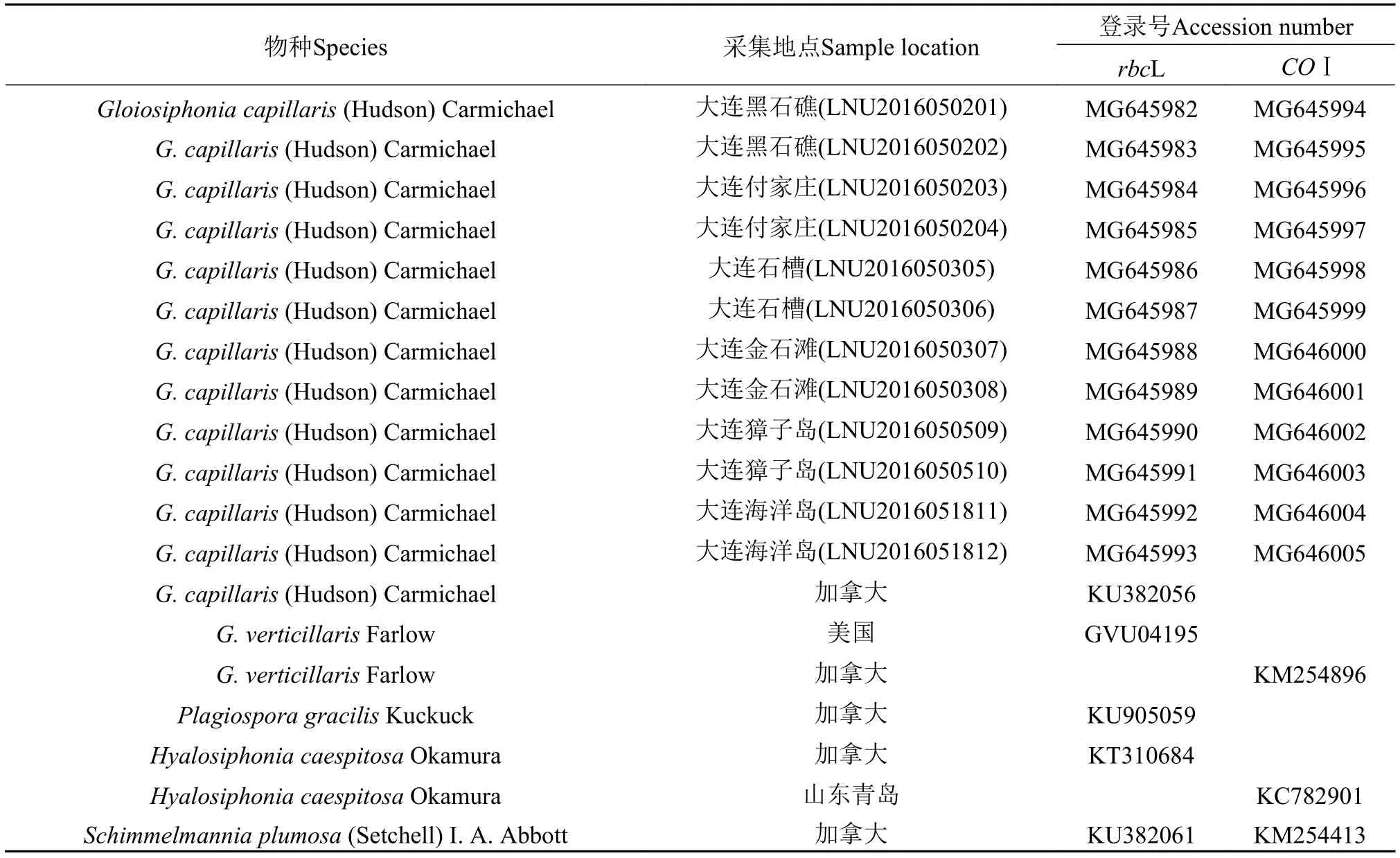
表 2 rbcL、COⅠ基因序列分析所用物种、采集地点及基因库登录号列表Tab. 2 List of species for rbcL and COⅠ gene sequence analysis with the sample location and the accession numbers of GenBank
2.4 黏管藻配子体的温度性质分析
海藻的温度性质是海藻区系性质中最主要的一项[13]。关于海藻的区系的温度性质, 可分为寒带区系(<0—5℃)、亚寒带区系(5—10℃)、温带区系(10—20℃)、亚热带区系(20—30℃)和热带区系(25—30℃或以上)[17]。黏管藻主要分布在黄海、渤海、东海沿岸, 黏管藻配子体的生长周期为3—7月,以大连市为例, 根据大连市3—7月海水温度变化分析黏管藻配子体的温度性质。3—6月, 海水温度从5.9℃升至15.3℃, 这段时间黏管藻配子体逐渐生长,其中5—6月藻体生长速度最快, 平均生物量迅速增大, 海水温度范围为10.6—15.3℃。6—7月, 海水温度从15.3℃ 升至20.7℃, 黏管藻配子体逐渐减少,8月至次年2月未采集到黏管藻配子体。综上所述,黏管藻配子体的适宜生长温度在10.6—15.3℃, 故黏管藻配子体的温度性质属于温带性。
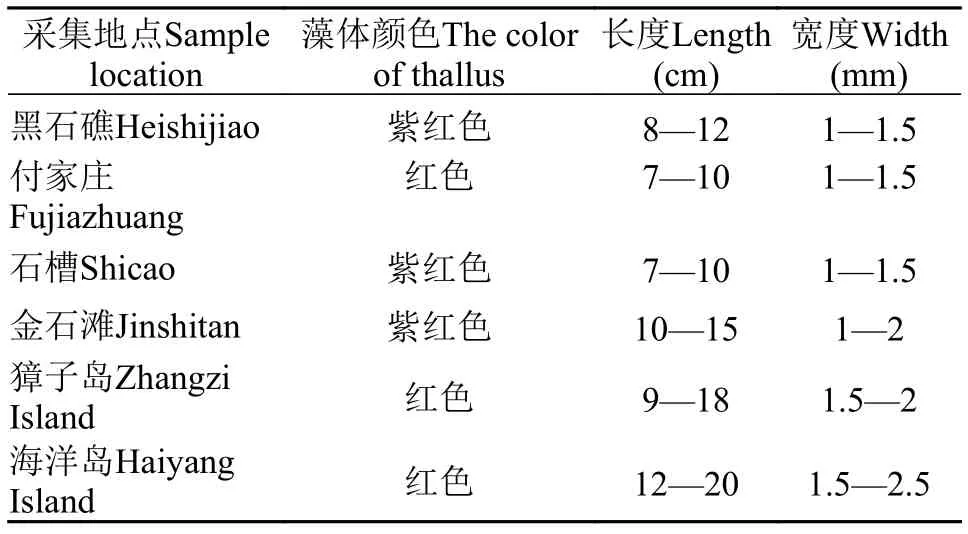
表 3 不同采集点的黏管藻配子体外部形态的比较Tab. 3 The morphological characteristics of G. capillaris gametophyte from different localities
2.5 rbcL和COⅠ基因序列分析
rbcL基因序列分析本研究从6个地点各获得2条总共12条黏管藻的rbcL序列并提交到Gen-Bank中, 所获得登录号为: MG645982、MG645983、MG645984、MG645985、MG645986、MG645987、MG645988、MG645989、MG645990、MG645991、MG645992和MG645993。共比对17条序列, 对比矫正后序列矩阵长度为1226 bp。基于ML法、NJ法和MP法构建了rbcL序列的系统发育树, 3种方法所构建的发育树具有相似的拓扑结构, 故以ML法所构建系统发育树的拓扑结构显示。结果如图 5所示, 本研究的12个样本之间无碱基差异, 与产自加拿大的黏管藻在系统树中聚在一个分支中, 无碱基差异, 确定为黏管藻。与黏管藻属的轮生黏管藻碱基差异为64 bp (7.97%)。与黏管藻科Plagiospora属的P. gracilis碱基差异为157 bp (12.56%)。与外群种亮管藻属的亮管藻碱基差异为170 bp (13.07%)以及与Schimmelmannia属的S. plumosa碱基差异为185 bp (12.83%)。
COⅠ基因序列分析本研究从6个地点各获得2条总共12条黏管藻的COⅠ序列并提交到GenBank中, 所获得登录号为: MG645994、MG 645995、MG645996、MG645997、MG645998、MG645999、MG646000、MG646001、MG646002、MG646003、MG646004和MG646005。共比对15条序列, 对比矫正后序列矩阵长度为664 bp。基于ML法、NJ法和MP法构建了COⅠ序列的系统发育树, 3种方法所构建的发育树具有相似的拓扑结构, 故以ML法所构建系统发育树的拓扑结构显示。结果如图 6所示, 本研究的12个样本之间无碱基差异。而与黏管藻属的轮生黏管藻碱基差异为44 bp (6.35%), 与外群种亮管藻属的亮管藻碱基差异为109 bp (8.83%), 与Schimmelmannia属的S.plumosa碱基差异为110 bp (8.98%)。

图 3 黏管藻配子体个体形态的变化Fig. 3 Different morphology of G. capillaris gametophyte at different stages
3 讨论
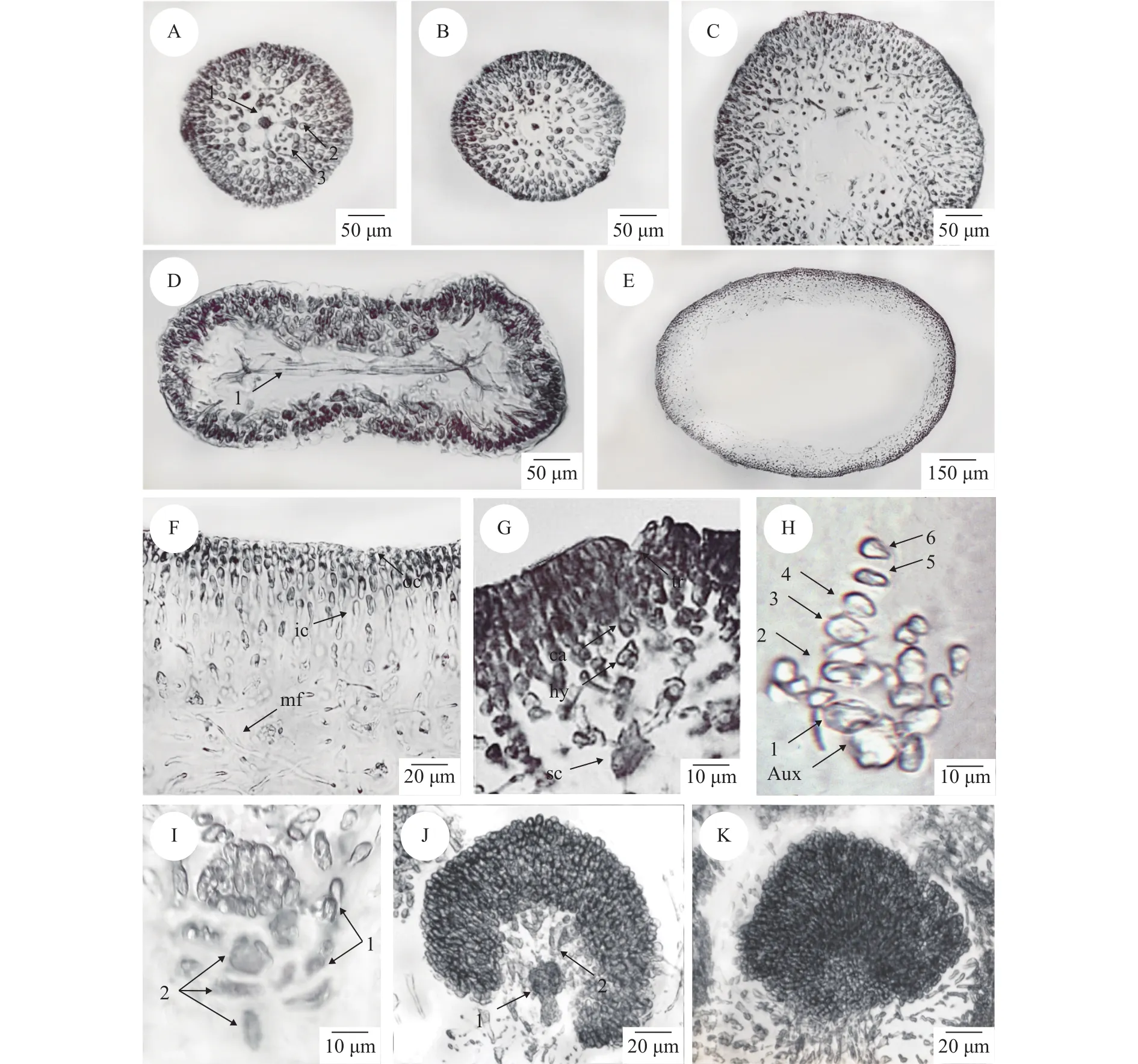
图 4 黏管藻配子体营养结构与生殖结构Fig. 4 The vegetative structure and reproductive structure of G. capillaris gametophyte
采自大连6个地点的黏管藻样本的外部形态、营养结构和生殖结构与夏邦美[1]和曾呈奎[5]的描述一致。在外部形态上, 本研究的样本具有较密的次生分枝, 而轮生黏管藻(G. verticillaris)具有3—6个渐细的轮生分枝, 无次生分枝, 二者易于区分。因此从形态学上确定本研究的样本是黏管藻。根据rbcL序列构建的ML系统发育树(图 5)显示, 本研究中的12个样本与产自加拿大的黏管藻聚在一起, 形成一个独立的分支, 自展值为100, 区别于其他种,验证了本研究的12个样本为黏管藻。根据COⅠ序列构建的ML系统发育树(图 6)显示, 本研究的12个样本间聚在一起, 形成一个独立的分支, 自展值为99, 与同属的轮生黏管藻(G. verticillaris)碱基差异为44 bp (6.352%), 并与该种形成一个较大的黏管藻属分支, Le Gall等[18]研究了DNA条形码技术对于研究海藻种类多样性的作用, 认为海藻碱基序列差异大于2%属于种间差异, 验证了本研究的12个样本为黏管藻。
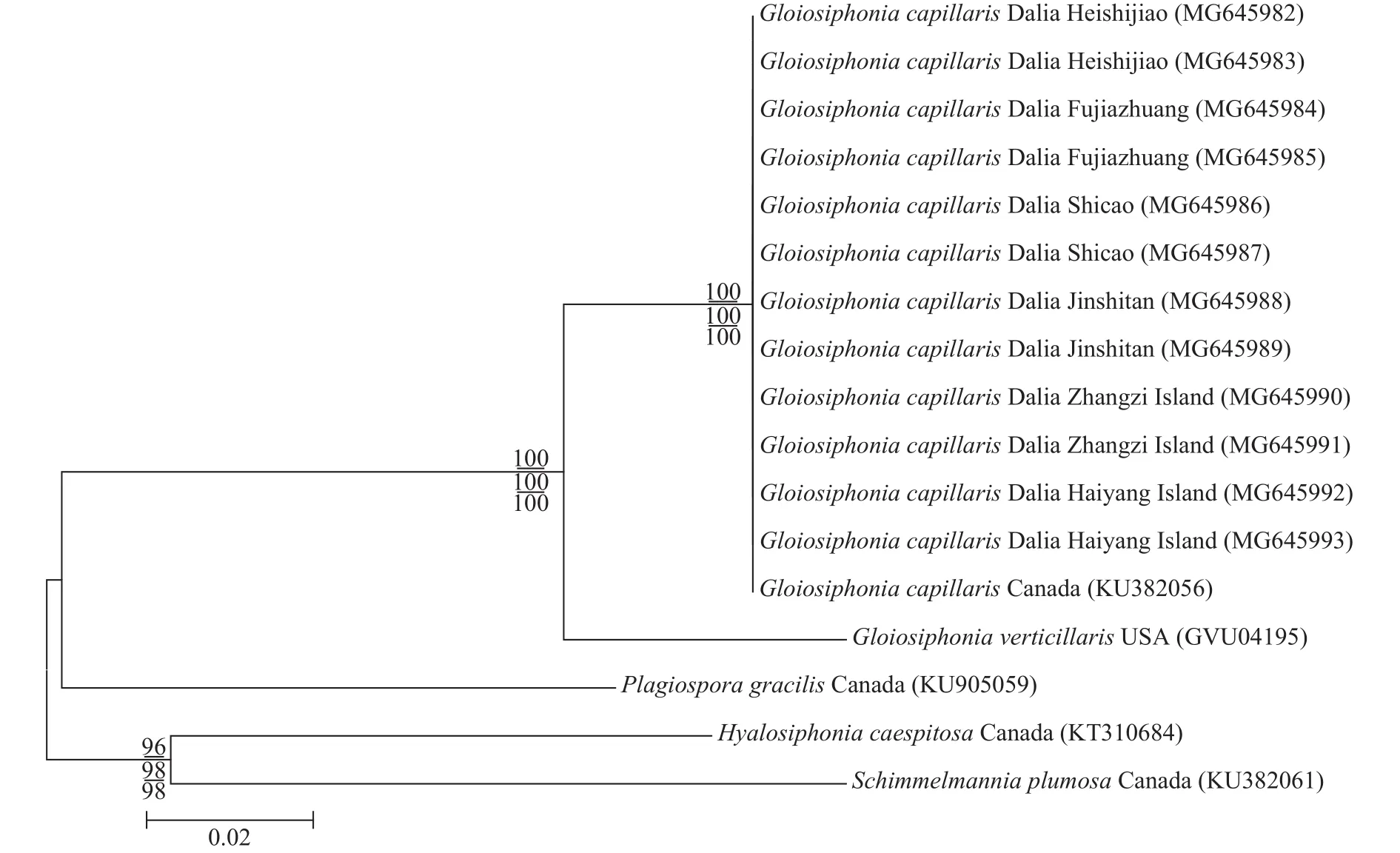
图 5 基于rbcL序列所构建的ML系统发育树Fig. 5 The Maximum likelihood (ML) tree was based on rbcL sequences
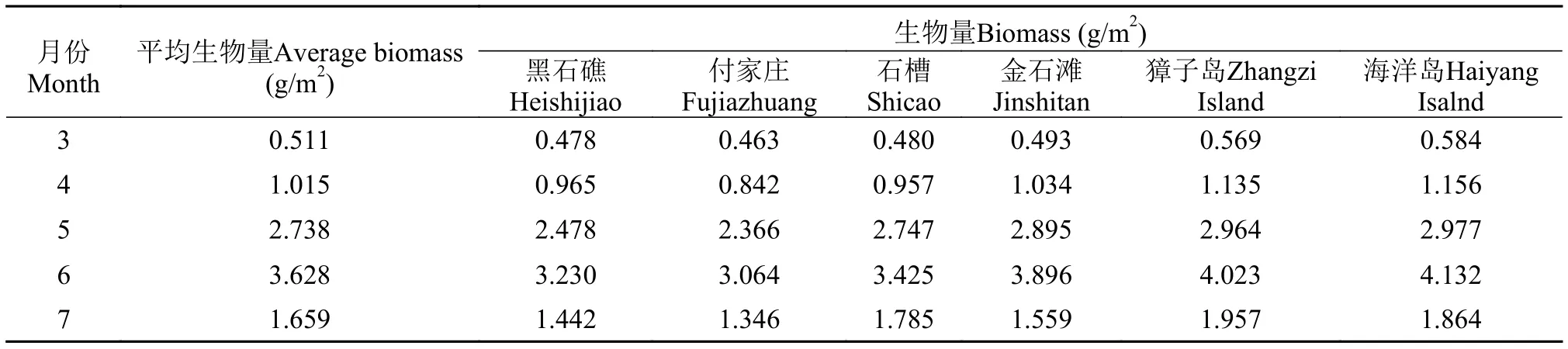
表 4 黏管藻配子体生物量的变化Tab. 4 The biomass of G. capillaris gametophyte
Newton[19]对分布于欧洲的黏管藻配子体的生长周期进行了调查, 发现其春天和夏天有分布, 这与我们的调查结果一致。由于黏管藻的四分孢子体为壳状, 故很难确定黏管藻四分孢子体的生长周期及温度性质。本研究发现大连獐子岛与海洋岛的黏管藻配子体在外部形态与平均生物量上明显大于其他采集地点。经过调查发现獐子岛与海洋岛远离内陆, 海洋生态环境保护较好, 海水富营养化程度较低, 所以我们推测黏管藻的生长对于环境条件要求较高, 对N、P等营养盐及重金属耐受力较弱, 可作为指示植物在海洋水体污染的监测中起到重要作用。王永宇等[14]通过对单条胶黏藻(Dumontia simplex)的生长状态进行了研究, 发现在海水富营养化严重的海域其外部形态和生物量更大,这说明海水富营养化对不同藻类的生长状态影响不同。笔者在标本采集时发现大连海域近几年黏管藻的分布范围逐渐减小, 经研究发现这一现象与大连海域近几年5—6月份石莼(U. lactuca)的大量繁殖有关。海水富营养化为石莼的大量繁殖提供有利的条件[20], 此时正是黏管藻的繁殖盛期, 生长受到抑制的黏管藻与大量繁殖的石莼相互竞争处于弱势, 黏管藻的生活空间被侵占, 最终使其分布范围逐渐减小, 因此有必要对该种继续跟踪调查。此外, 笔者发现大连海域一些常见海藻如刺松藻(Codium fragile)、海萝(Gloiopeltis furcate)等由于海洋生态环境的恶化其分布范围也变得越来越小。据统计大连地区海洋中蕴藏的海藻有71种海藻属于药用海藻[21], 具有抗凝血、抗氧化等多种生物活性[22—24]。因此有必要对大连地区海藻物种以及海洋生态环境进行保护来实现海洋环境和海洋经济的可持续发展。
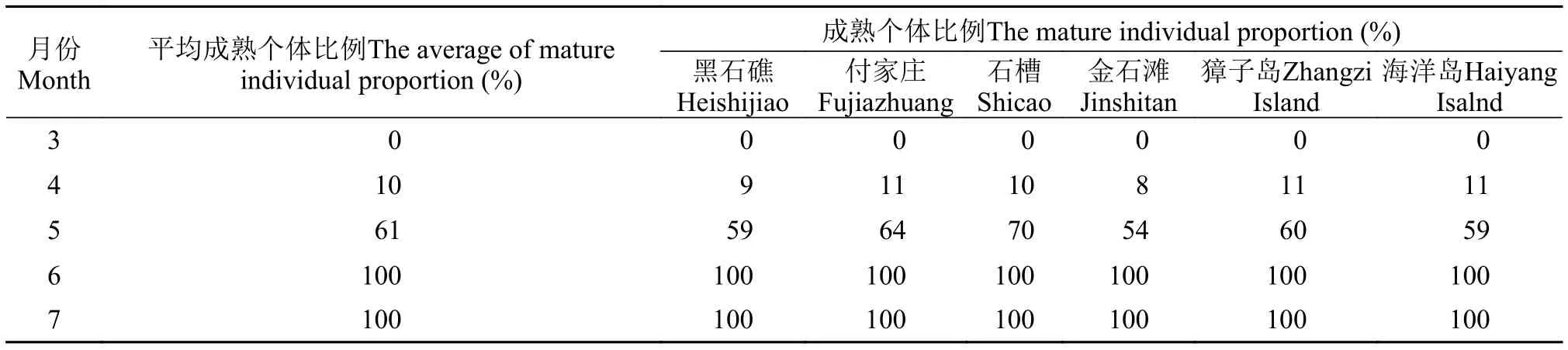
表 5 黏管藻配子体成熟个体比例变化Tab. 5 The mature individual proportion of G. capillaris gametophyte
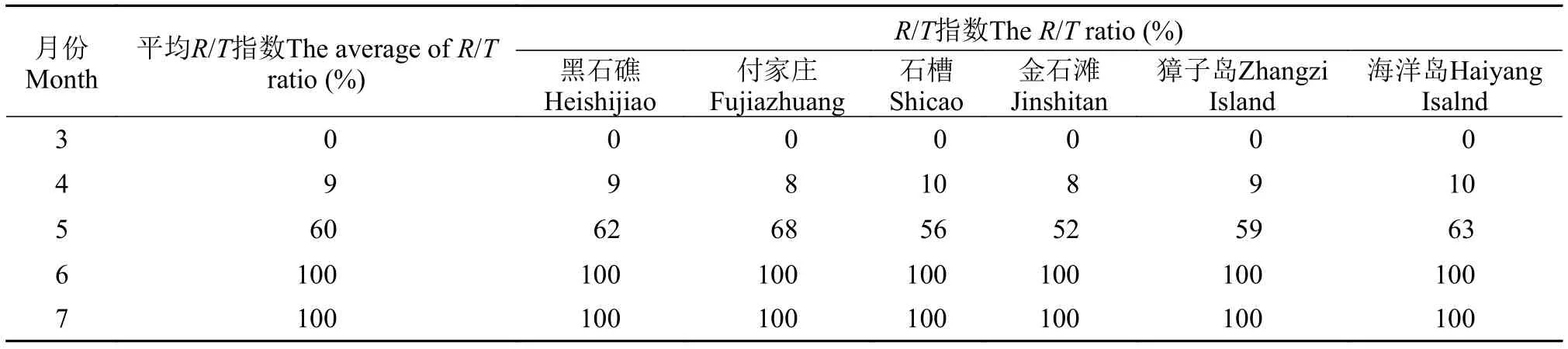
表 6 黏管藻配子体R/T指数的变化Tab. 6 The R/T ratio of G. capillaris gametophyte
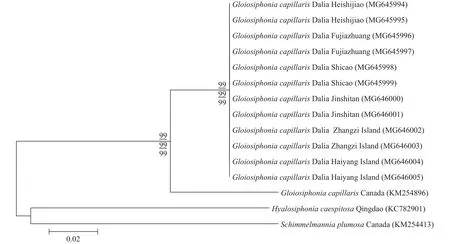
图 6 基于COⅠ序列所构建的ML系统发育树Fig. 6 The Maximum likelihood (ML) tree based on the COⅠ sequences
本研究明确了分布在大连沿海的黏管藻及其资源现状, 明确了其生长周期与繁殖盛期并分析了该种分布减少的原因, 为该种的保护、繁育提供详细的数据支撑并推测黏管藻可作为指示植物在海洋水体污染的监测中具有重要的作用, 为分布于全国其他海域的黏管藻的研究提供参考。

