纤维素酶-超声联合提取菠菜中总黄酮及其成分分析
穆易君,陈 洋,孙 晶,吴 杰,马 云,刘 崑
(锦州医科大学食品科学与工程学院,辽宁省肉类加工与质量安全控制工程中心技术研究中心,辽宁锦州 121001)
菠菜(Spinaciaoleracea)是苋科菠菜属植物中的一种典型的绿叶蔬菜,原产地位于波斯,深受当地阿拉伯人的喜爱,还获得了“蔬菜之王”的称号,于唐朝期间由尼泊尔人传入我国,现已在国内被广泛种植[1]。菠菜对周围环境的适应性强,耐寒、耐储藏,并且供应期长、产量高,还富含大量的维生素、脂肪酸和多种矿物质元素以及一些色素成分,这些营养成分可以维持人体正常生理代谢水平[2]。除食用价值外,菠菜中的黄酮类化合物在生理上也具有抗菌、抗炎、抗氧化、抗细胞增殖和抗变态反应等功效[3]。
黄酮类化合物是一种天然的多酚类物质,也是药食两用植物中的重要成分[4],具有生物活性、低毒性、易获得的特点[5-6]。黄酮类化合物的生物活性作用取决于各取代基的存在和位置,这些取代基同时会影响每种化合物的代谢[7]。
而近几年,对于黄酮资源的研究开发正在蓬勃开展,有许多关于黄酮类化合物提取的研究,大多数研究都涉及到了提取方法的优化和更新,但提取方法比较单一,例如:超声辅助提取、微波辅助提取、酶解提取等,赵娟娟用乙醇提取出菠菜总黄酮,并对提取条件进行了优化[8],2015年许福泉等采用有机溶剂乙醇提取菠菜中的黄酮类化合物[9]。而在关于对植物活性物质提取的研究课题中,有少数研究将两种方法结合使用,如:王如意等利用超声波协同酶解法提取啤酒花中的黄酮类化合物[10],杨海涛等利用酶-超声辅助法提取苦荞秆中总黄酮[11],但将两种提取方法结合提取菠菜中的黄酮类化合物还未有报道。
天然植物提取物通常是含有多种生物活性成分的复杂混合物。将具有生物活性的化合物进行快速准确地检测和评价是植物化学研究的关键。用于黄酮类化合物成分测定的常用方法有:薄层色谱法、高效液相色谱法、气相色谱法等。薄层层析法和气相色谱法及其他一些分析方法,由于工作原理具有局限性、操作复杂、成本高等因素,不适用于分析黄酮类化合物成分或在大规模生产中使用[12-13]。而高效液相色谱法由于具有极快的分析速度、宽泛的流动相选择以及使用条件温和等优点,常被用于天然产物活性成分的分析。本研究采用纤维素酶结合超声提取法提取菠菜黄酮,为菠菜中黄酮的提取提供节能高效的新方法。建立可以同时检测菠菜黄酮中7种黄酮类化合物成分的分析方法,可以使菠菜中的主要黄酮类化合物成分在基线上得以分离,且分离度较好,是检测分析菠菜中黄酮类化合物组成成分及其含量的高效准确的方法。
1 材料与方法
1.1 材料与仪器
菠菜 锦州市售新鲜无虫害菠菜;芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素,纯度均≥98% 北京索莱宝科技有限公司;纤维素酶(活力>200 U/mg) Sigma公司;甲醇(色谱级) 天津市康科德科技有限公司;蒸馏水 实验室自制;AB-8大孔吸附树脂 陕西乐博生化科技有限公司;95%乙醇 天津永晟精细化工有限公司;浓盐酸、甲醇、甲酸、氢氧化钠、石油醚(60~90 ℃) 天津市风船化学试剂科技有限公司;邻苯二甲酸氢钾、混合磷酸盐、四硼酸钠 上海雷磁·创益仪器仪表有限公司。
DHG-9140型电热恒温鼓风干燥箱 上海恒科技有限公司;FW-400A型万能粉碎机 北京中兴伟业仪器有限公司;SHA-B型水浴恒温振荡器 金坛市科析仪器有限公司;0501094S型高速台式离心机 上海安亭科学仪器厂;JA1003N型电子天平 上海精密科学仪器有限公司;UV-5100型紫外可见分光光度计 上海元析仪器有限公司;RE-5298型旋转蒸发器 上海亚荣生化仪器厂;SHZ-Ⅱ型循环水真空泵 上海亚荣生化仪器厂;FD-1A-50型真空冷冻干燥机 北京博医康实验仪器有限公司;PHS-3E型pH计 上海佑科仪器仪表有限公司;KQ-500DE型超声波清洗器 昆山市超声仪器有限公司;CTO-15C型高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 原料预处理 将新鲜菠菜用水洗净表面泥沙及杂质,去根、去黄叶;用电热鼓风干燥机于60 ℃、物料厚度1 cm,干燥24 h;干燥磨粉,过80 目筛;用石油醚60 ℃水浴恒温振荡24 h脱色处理,脱色时每隔6 h更换一次石油醚,用高速离心机4000 r/min离心10 min取上清液,再用石油醚反复萃取至石油醚无色,晾干备用。
1.2.2 菠菜黄酮化合物样品的制备 纤维酶-超声提取:准确称取2.0 g菠菜粉末于具塞三角瓶中,与70%甲醇溶液按料液比1∶30 g/mL混合,加柠檬酸-柠檬酸钠缓冲溶液和纤维素酶,置于超声波清洗器中,在一定温度和时间下进行超声处理。将提取液用旋转蒸发仪50 ℃旋蒸浓缩1 h后,用真空冷冻干燥机于-80 ℃干燥4 h直至变成粉末状,密封于4 ℃下冷藏保存备用。
纯化粗提物:将粗提物配成一定浓度(3.0 mg/mL),用4倍柱体积60%的乙醇溶液通过AB-8大孔树脂进行洗脱,将纯化后的提取液用旋转蒸发仪50 ℃下旋蒸浓缩1 h后,用真空冷冻干燥机于零下80 ℃干燥4 h直至变成粉末状,密封于4 ℃下冷藏保存备用[14]。
1.2.3 单因素实验 选取影响纤维素酶-超声提取菠菜中总黄酮得率的6个因素:甲醇浓度、酶添加量、料液比、提取温度、提取时间、酶解pH,考察各因素对菠菜中总黄酮得率的影响。考察单因素对总黄酮的提取的影响时,固定超声功率为500 W,料液比1∶30 g/mL、甲醇浓度60%、提取时间45 min、提取温度40 ℃、pH4.6、纤维素酶的添加量0.3%,分别改变所对应的设定因素,纤维素酶的添加量0.3%、0.6%、0.9%、1.2%、1.5%;酶解pH4.2、4.6、5.0、5.4、5.8;料液比1∶20、1∶30、1∶40、1∶50、1∶60 g/mL;甲醇浓度50%、60%、70%、80%、90%;提取温度30、40、50、60、70 ℃;提取时间15、30、45、60、75 min,进行单因素实验。
1.2.4 正交试验 根据单因素实验结果优选四个对菠菜总黄酮得率影响较大的主要因素:酶添加量、料液比、提取温度、酶解pH,进行四因素三水平的正交试验,试验因素水平见表1。
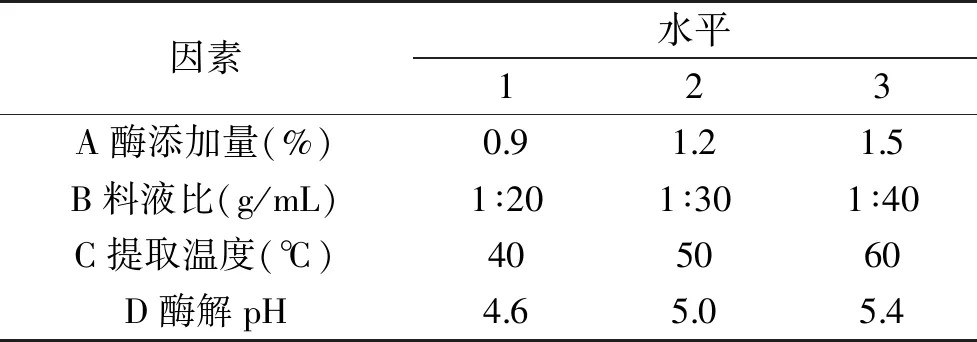
表1 正交试验因素水平Table 1 The factors and levels of orthogonal experiment
1.2.5 样品得率测定 芦丁标准曲线的绘制:称取芦丁20.5 mg置于100 mL容量瓶中,加60%甲醇溶液溶解,稀释至刻度,精确量取25 mL置于50 mL容量瓶中,蒸馏水稀释至刻度摇匀,即得1.0 mL含芦丁0.103 mg的标准溶液。按照李秀信等[15]的NaNO2-Al(NO3)3法绘制芦丁标准曲线,以第一管为空白于510 nm波长下测定吸光度,以吸光度(Y)为纵坐标,芦丁质量浓度(X)为横坐标,绘制标准曲线,得到回归方程为:Y=7.3953X+0.00052,R2=0.9991。
按照1.2.2操作取2.0 mL经纤维素酶联合超声提取法提取得到的菠菜总黄酮溶液,置于10 mL具塞试管中,按1.2.2.1操作,在510 nm测定吸光度,计算菠菜总黄酮得率。
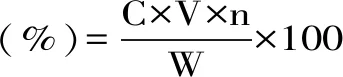
式中:C:稀释液中总黄酮浓度(mg/mL);V:提取液总体积(mL);W:菠菜粉质量(g);n:稀释倍数。
1.2.6 菠菜中黄酮类化合物的成分鉴定 精密称取7种黄酮类化合物标准品:芦丁5.9 mg、儿茶素6.8 mg、芹菜素6.0 mg、绿原酸6.0 mg、槲皮素5.7 mg、没食子酸4.2 mg、山奈酚5.0 mg,用甲醇定容至25 mL容量瓶中,超声使其充分混匀,即得芦丁、儿茶素、芹菜素、绿原酸、槲皮素、没食子酸、山奈酚浓度分别为:0.236、0.272、0.240、0.240、0.228、0.168、0.200 mg/mL的混合标准品储备液。
色谱分析条件:采用岛津CTO-15C型高效液相色谱仪,单次进样量10 μL,以甲醇(A)-0.1%甲酸(B)为流动相,在紫外检测波长280 nm,柱温35 ℃,流速1 mL/min条件下进行梯度洗脱,单次分析时长40 min。
1.2.7 方法学考察
1.2.7.1 线性关系 采用外标五点法进行测定。向5支10 mL容量瓶中分别加入混合标准品溶液0.2、0.5、1、2、4、8 mL,用甲醇定容。按“1.2.6”项的色谱条件进行测定,获得各标准品对应浓度的峰面积。以各个标准品浓度为自变量,该浓度下的峰面积为因变量,记录数据,得到各标准品对应的回归方程。
1.2.7.2 精密度考察 取线性标准品其中一个浓度,连续进样5次,在“1.2.6”的色谱条件下进行测定,分别记录芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素的峰面积并计算含量和RSD值。
1.2.7.3 重复性考察 取供试品6份,每份约20 mg,分别按“1.2.6”项的供试品处理方法制备,在“1.2.6”的色谱条件下进行测定,分别记录芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素峰面积并计算含量,同时计算RSD值。
1.2.7.4 稳定性考察 取供试品一份,分别在0、2、4、8、10、12、24 h时,在“1.2.6”的色谱条件下进行测定,分别记录每个时间供试品溶液的芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素峰面积并计算含量和RSD值。
1.2.7.5 加样回收率考察 称取“1.2.1”方法下提取得到的供试品6份,每份约20 mg,分别加入标准品储备液2.5 mL,定容至10 mL,依照“1.2.6”项下的色谱条件方法进样测定,分别记录芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素峰面积并计算菠菜黄酮的加样回收率及RSD值。
1.2.8 菠菜黄酮中7种黄酮类化合物成分的含量测定 取3批菠菜黄酮,在“1.2.6”的制备供试品溶液方法以及色谱条件下分别进样20 μL,并采用外标法计算菠菜黄酮中各成分的含量。
1.3 数据处理
2 结果与分析
2.1 单因素实验结果
2.1.1 酶添加量对总黄酮得率的影响 关于酶添加量对菠菜黄酮得率的影响,由图1可以看出,酶添加量在0.3%~1.2%时,总黄酮得率随着酶添加量的增加而增加,在酶添加量为1.2%时,得率达到最高值(12.66%),随着酶添加量超过1.2%后,得率开始下降。由于随着酶含量的增加,其对细胞壁的破坏程度随之增大,总黄酮得率增加,在添加量为1.2%时达到最大值,随着酶添加量进一步,酶解部分纤维素和过多的酶附着在颗粒表面,影响黄酮的溶出,使得得率下降[16],故选择适宜的酶添加量为1.2%。

图1 酶添加量对菠菜黄酮得率的影响Fig.1 The effect of enzyme addition on flavonoids extraction rate in spinach
2.1.2 酶解pH对总黄酮得率的影响 关于酶解pH对菠菜黄酮得率的影响,由图2可以看出,当pH在4.2~6.0范围内时,菠菜黄酮得率随着酶解pH的增加先升高后下降,分析原因:随pH增加纤维素酶活性升高,酶对细胞壁的破坏程度增加,降低传质阻力从而使黄酮类化合物更快地溶出至提取剂,提取率升高[17],在酶解pH5.0时得率达到最大值(13.31%±0.21%),当酶解pH超过5.0时,得率开始下降,故选择5.0为最适酶解pH。
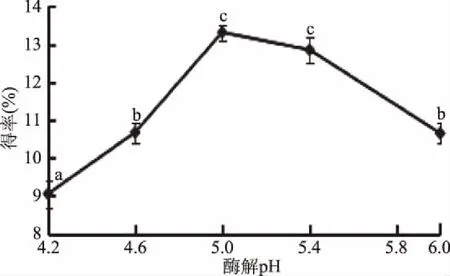
图2 酶解pH对菠菜黄酮得率的影响Fig.2 The effect of enzymatic hydrolysis of pH on flavonoids extraction rate in spinach
2.1.3 料液比对总黄酮得率的影响 关于料液比对菠菜黄酮得率的影响,由图3可以看出,当料液比在1∶20~1∶60 g/mL范围内时,菠菜黄酮得率随着料液比的增加先升高后下降,因为反应开始时随反应溶剂量的增加,在超声破壁作用和酶解双重作用下,有机溶剂与物料的接触面积增大,反应效率随之增加[18],料液比在1∶30 g/mL时得率达到最大值13.07%±0.28%,超过1∶30 g/mL时,相对酶解作用减弱,得率降低。故选择料液比1∶30 g/mL。
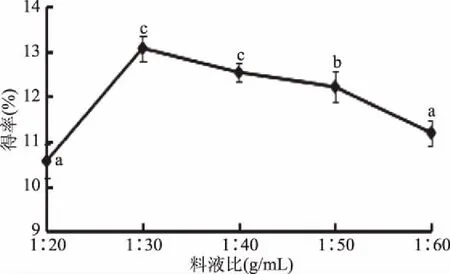
图3 料液比对菠菜黄酮得率的影响Fig.3 The effect of material ratio on flavonoid extraction rate in spinach
2.1.4 提取温度对总黄酮得率的影响 关于提取温度对菠菜黄酮得率的影响,由图4可以看出,当提取温度在30~70 ℃范围内时,菠菜黄酮得率随着温度的升高先升高后下降。温度的升高有利于底物在甲醇溶液中的浸提,也有利于纤维素酶在底物中的溶解扩散,在50 ℃时得率达到最大值为12.64%±0.22%,而过高的温度则会破坏纤维素酶的活性使得率降低[19]。故选择提取温度50 ℃。
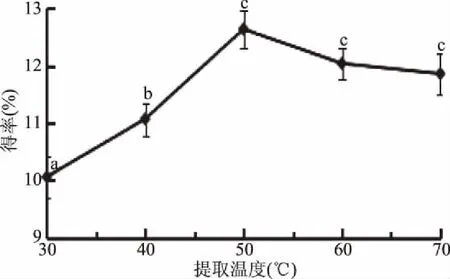
图4 提取温度对菠菜黄酮得率的影响Fig.4 The effect of extraction temperature on flavonoid extraction rate in spinach
2.1.5 提取时间对总黄酮得率的影响 关于提取时间对菠菜黄酮得率的影响,由图5可以看出,提取时间在15~75 min范围内时,菠菜黄酮得率随着时间的增加先升高后下降,因为酶与底物的结合需要一定时间,时间过短酶与底物结合效率降低,得率低;随着时间增加,酶与底物充分结合,得率增加,45 min时到达最大值13.18%±0.12%;超过45 min酶解反应速率下降,溶出黄酮类化合物增加加速了逆反应进行[20],得率缓慢下降。故选择提取时间45 min。
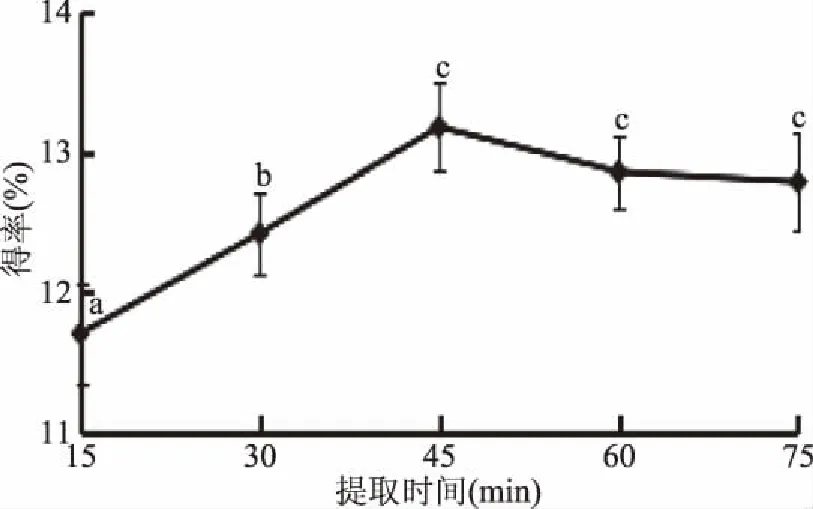
图5 提取时间对菠菜黄酮得率的影响Fig.5 The effect of extraction time on flavonoid extraction rate in spinach
2.1.6 甲醇浓度对总黄酮得率的影响 关于甲醇浓度对菠菜黄酮得率的影响,由图6可以看出,当甲醇浓度在50%~90%范围内时,总黄酮得率随着甲醇浓度的增加而增加,当甲醇浓度超过70%时,得率无明显变化趋势,由于浓度过大会消耗大量的有机试剂,容易造成资源浪费和环境污染,且高浓度的醇会提取出菠菜中的其他活性成分对实验造成干扰[21]。从节约资源保护环境又同时能保证提取效果的角度综合考虑,选择适宜的甲醇浓度为70%。
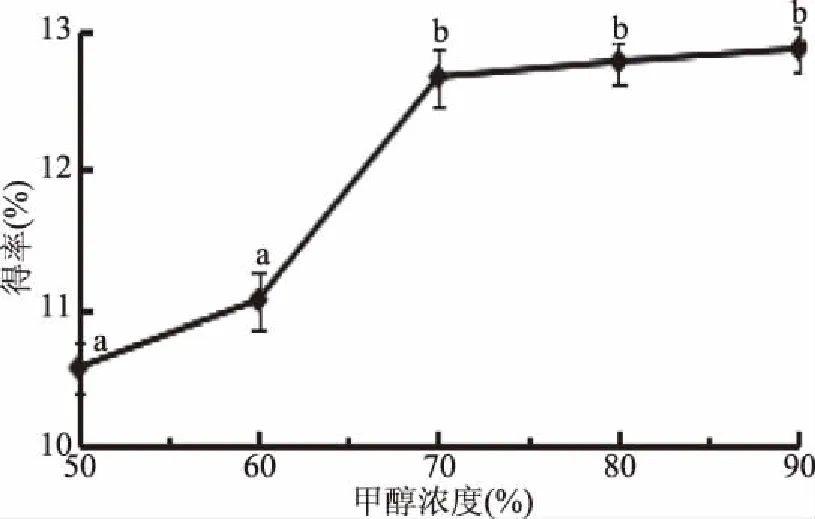
图6 甲醇浓度对菠菜黄酮得率的影响Fig.6 The effect of methanol concentration on flavonoids extraction rate in spinach
2.2 正交试验结果
对单因素实验的6个因素进行综合分析,选取酶添加量、料液比、提取温度和酶解pH因素,以菠菜中总黄酮得率为指标,进行四因素三水平正交试验,试验结果见表2。

表2 L9(34)正交试验结果Table 2 Results of L9(34)orthogonal experiment
从表2中的的极差结果可看出,四个因素对菠菜总黄酮得率的影响大小顺序为:添加量>料液比>酶解pH>提取温度,最佳组合为A2B2C3D2,即酶添加量1.2%,料液比1∶30 g/mL,提取温度60 ℃,酶解pH5.0。在此条件下重复三次,得到的总黄酮得率为15.56%±0.04%。
2.3 样品得率测定结果
将菠菜粉末利用纤维素酶联合超声提取法,在甲醇浓度70%、酶添加量1.2%、料液比1∶30 g/mL、提取温度60 ℃、酶解pH5.0条件下超声提取45 min,提取得到的菠菜总黄酮得率为15.56%。赵娟娟用乙醇热浸提法提取得到的菠菜黄酮,最终得到的总黄酮得率为6.8%[8],经对比,本研究所使用的纤维素酶联合超声提取菠菜黄酮的方法得到的菠菜黄酮得率均高于前人的研究结果,故该方法在菠菜黄酮的提取上具有可行性。
2.4 菠菜中黄酮类化合物的成分鉴定
根据混合标准品色谱图(图7)可以得出,没食子酸、绿原酸、儿茶素、芦丁、芹菜素、山奈酚、槲皮素的混合标准品在“1.2.6”色谱条件下检测出的保留时间分别为8.407、17.926、18.874、27.125、32.148、35.069、35.553 min。
根据菠菜黄酮色谱图(图8)可以看出,从样品中检测得到7种黄酮类物质,保留时间分别为8.390、17.890、18.826、27.068、32.128、35.048、35.531 min,与混合标准品色谱图上的保留时间基本一致,基本可以认为是同一种成分。
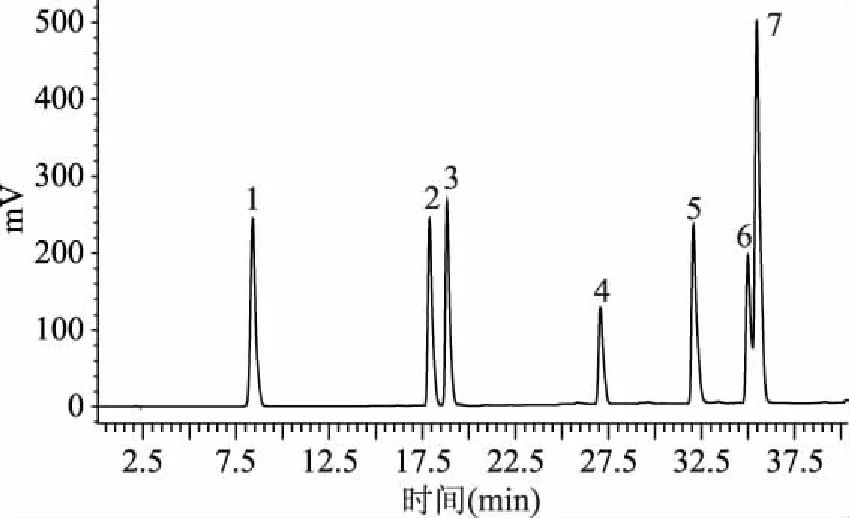
图7 混合标准品色谱图Fig.7 Mixed standard chromatography注:1.没食子酸;2.绿原酸;3.儿茶素;4.芦丁;5.槲皮素;6.山奈酚;7.芹菜素。
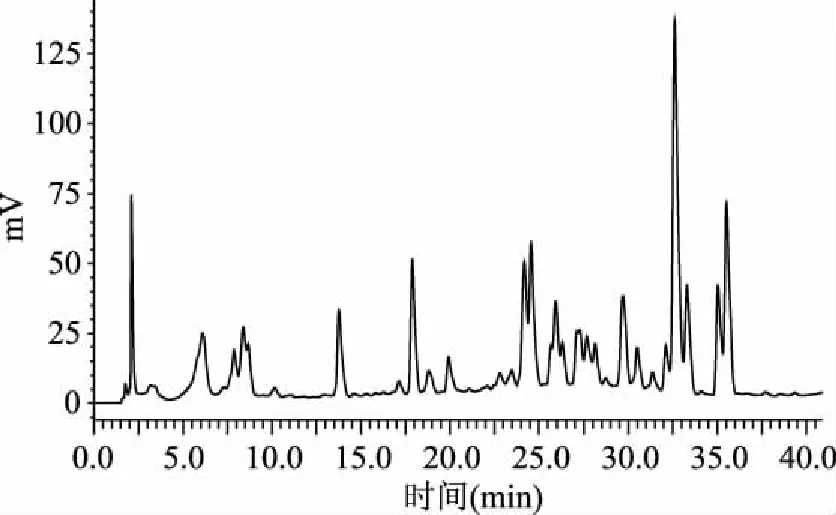
图8 菠菜黄酮色谱图Fig.8 Spinach flavonoids chromatography
2.5 方法学考察
2.5.1 线性关系考察 由表3可以看出,七种单体在线性浓度范围内均与峰面积呈良好的线性关系,决定系数均大于0.999。

表3 线性关系考察结果Table 3 Results of linear relationship investigation
2.5.2 仪器精密度考察结果 由精密度实验结果可以得出,芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素的RSD值在0.24%~2.63%范围内,结果表明该仪器精密度良好。
2.5.3 重复性考察结果 由重复性实验结果可以得出,芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素的RSD值在0.32%~2.06%范围内,结果表明该方法具有良好的重复性。
2.5.4 稳定性考察结果 由稳定性实验结果可以得出,芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素的RSD值在0.43%~2.06%范围内,表明供试品溶液在0~48 h内基本稳定。
2.5.5 加样回收率考察结果 芦丁、槲皮素、山奈酚、绿原酸、没食子酸、芹菜素、儿茶素的平均加样回收率在98.13%~101.00%,RSD值在 2.74%~3.98%,表明该方法具有良好的准确性。
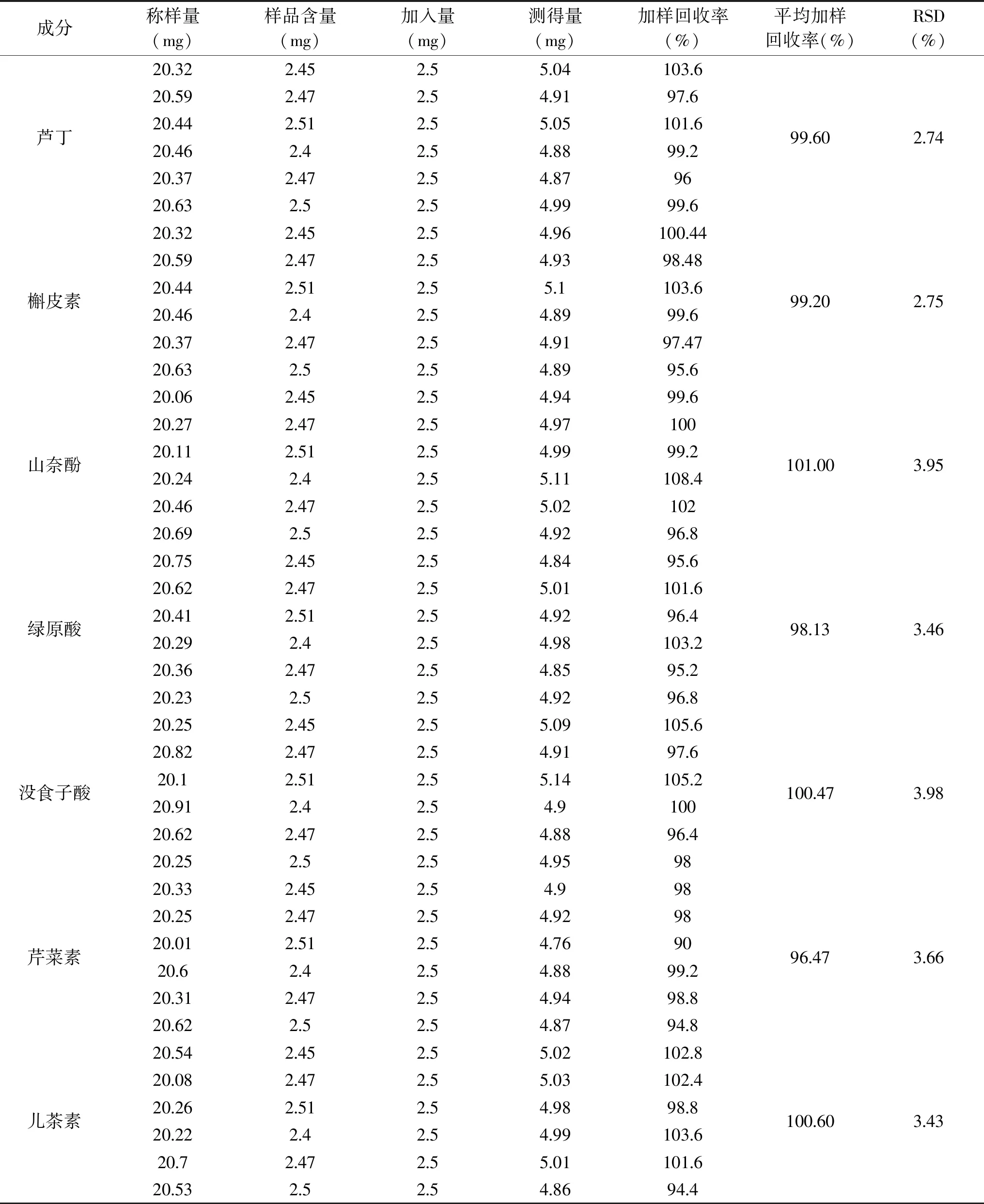
表4 加样回收率考察结果Table 4 Sample recovery rate inspection results
2.6 菠菜黄酮中7种黄酮类化合物成分的含量测定
由表5可以看出,芦丁、儿茶素、芹菜素、绿原酸、槲皮素、没食子酸、山奈酚7种黄酮类化合物成分的含量分别为:0.83、1.37、0.64、1.46、2.12、1.25、1.87 mg/g。
3 结论
本实验以菠菜为原料,通过纤维素酶联合超声提取的方法提取菠菜总黄酮,通过单因素实验和正交分析,得到提取的最佳提取条件为:甲醇浓度70%、酶添加量1.2%,料液比1∶30 g/mL,提取温度60 ℃,提取时间45 min、酶解pH5.0,在此条件下进行三次平行实验得到的菠菜黄酮得率为15.56%±0.04%。得率的平均值比超声提取和纤维素酶提取分别高出2.51%和1.27%。菠菜黄酮中含有没食子酸、绿原酸、儿茶素、芦丁、芹菜素、山奈酚、槲皮素七种黄酮类化合物成分,含量分别为:0.83、1.37、0.64、1.46、2.12、1.25、1.87 mg/g。将混合标准品在特定条件下以不同浓度进样,得出的图谱峰面积与进样浓度之间存在良好的线性关系。经方法学实验结果表明:仪器的精密度、供试样品的稳定性、样品检测的重复性以及实验的准确性均表现良好。
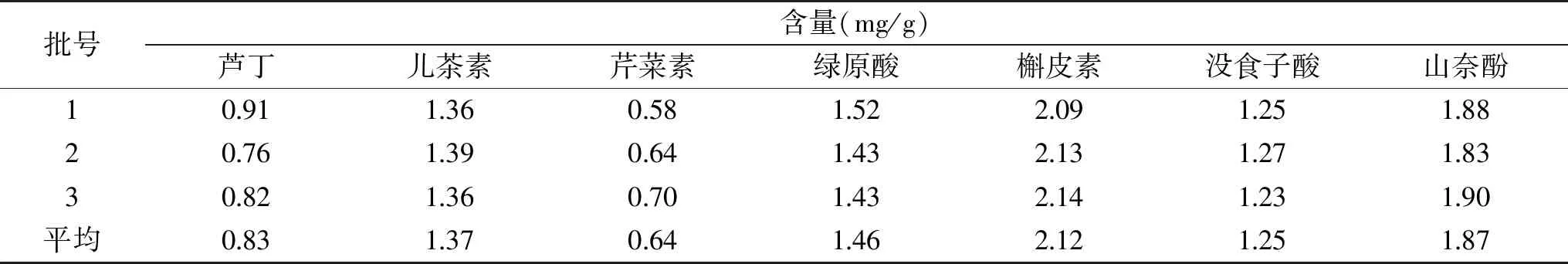
表5 菠菜黄酮中7种黄酮类化合物含量Table 5 Contents of 7 flavonoids in spinach flavonoids

