PD-1和PD-L1在结直肠癌中的表达及其临床病理意义
韩丽芳 王珍 关颖
(1 广州中医药大学祈福医院病理科 广东 广州 511495)
(2 广州中医药大学祈福医院科教科 广东 广州 511495)
(3 南方医科大学生物统计学系 广东 广州 511495)
结直肠癌(CRC)作为最常见的恶性肿瘤之一,在全世界男性的发病率排名第3位,病死率第4位,女性的发病率排名第2位,病死率第3位。晚期结直肠癌(指局部晚期或远处转移),占所有结直肠癌的50%。我国结直肠癌的发病率和病死率呈明显上升趋势,且发病年龄有所提前。而针对结直肠癌的治疗,仍然是以手术为主、放化疗等为辅的综合治疗方法,以减少肿瘤细胞数量来达到治疗效果。但是,术后5年生存率低、复发转移率及耐药率高。目前,肿瘤免疫治疗是肿瘤领域的研究热点,是一种疗效显著的肿瘤治疗模式。肿瘤免疫治疗是通过调动机体的免疫系统,增强抗肿瘤免疫力,从而抑制和杀伤肿瘤细胞。PD-1是一种重要的免疫抑制分子,近期研究发现PD-1和PD-L1的抑制剂在多种肿瘤类型中疗效显著。本研究将收集既往结直肠癌病例,运用免疫组化方法检测癌组织、癌旁组织及其浸润淋巴细胞中PD-1/PD-L1的蛋白表达,分析其与临床参数,如性别、年龄、肿瘤大小、组织类型、TNM分期、淋巴结转移等的相关性,探讨PD-1/PD-L1的蛋白表达在结直肠癌早期诊断、免疫靶向治疗、预后评估中的应用价值。
1.资料与方法
1.1 一般资料
收集广东祈福医院2012年1月-2018年10月期间结直肠癌标本172例作为病例组,随机选取其中50例距肿瘤组织>5 cm的癌旁组织及50例非肿瘤体检者正常肠粘膜作为对照组。病例组术前均未行放化疗,临床资料完整,其中男104例,女68例;年龄31~94 岁,平均年龄64 岁;肿瘤直径(癌结节)1.5~10cm,中位大小4.5cm;依据分化程度,低分化8例,中分化150例,高分化14例;按照AJC C(2010 )第七版结直肠癌 TNM 分期标准[1],Ⅰ~Ⅱ期88例,Ⅲ~Ⅳ期84例;有淋巴结转移者82例,无淋巴结转移者90例;有脉管癌栓者90例,无脉管癌栓者82例。
1.2 方法
免疫组织化学法检测PD-1、PD-L1的表达及分布 采用EnVision两步法,一抗室温孵育2h,二抗室温孵育30min,经DAB显色苏木精复染。鼠抗人PD-1(NAT)单克隆抗体即用型,兔抗人PD-L1(MXR003)单克隆抗体即用型,均购自福州迈新生物技术开发有限公司。
1.3 结果判定
免疫组化结果由2名中级以上病理医师双盲独立观察评估。PD-Ll和PD-l以细胞质或细胞膜出现黄至棕褐色颗粒为阳性显色。PD-Ll以阳性细胞数≥1%判为阳性,<1%判为阴性[2],分别评价肿瘤细胞及间质细胞的表达情况。PD-l表达于肿瘤间质浸润的淋巴细胞,以阳性细胞数≥5%判为阳性,<5%判为阴性[3]。
1.4 统计学处理
数据采用SPSS20.0统计软件进行统计学分析,计数资料采用率(%)表示,进行χ2检验,P<0.05为差异具有统计学意义。
2.结果
2.1 PD-1、PD-L1在结直肠癌组织及淋巴结中的表达
PD-1蛋白表达定位于结直肠癌间质浸润的淋巴细胞中,阳性部位为细胞膜及细胞质,阳性率为32.6%(56/172)。PD-L1蛋白表达主要定位于癌细胞和癌间质淋巴细胞的细胞质和细胞膜,其总体阳性率为65.1%(112/172),其中癌细胞上表达阳性率为24.4%(42/172),癌间质淋巴细胞上表达阳性率为65.1%(112/172)。50例癌旁组织间质淋巴细胞可见少量PD-1和PD-L1表达,其中PD-1阳性率为6%(3/50),PDL-1阳性率为8%(4/50)。淋巴结转移癌中PD-1和PDL-1表达率分别为23.2%(19/82)和61.0%(50/82),与其对应的原发肿瘤组织表达高度一致;见图1。
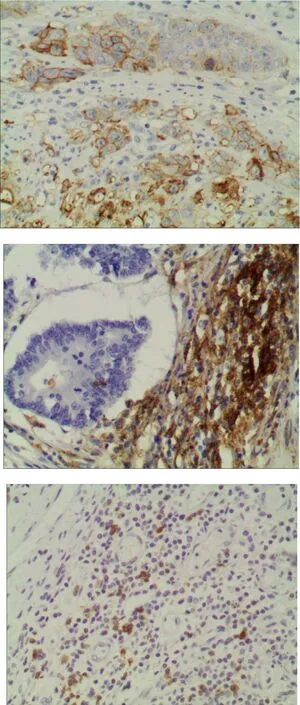
图1 A:PD-L1癌细胞阳性;B:PD-L1癌间质浸润淋巴细胞阳性;C:PD-1癌间质浸润淋巴细胞阳性
2.2 结直肠癌组织中PD-1、PD-L1蛋白表达的相关性
χ2检验结果显示,PD-1、PD-L1两者的蛋白表达呈显著正相关,癌细胞及癌间质浸润淋巴细胞中PD-L1的表达均与PD-1表达具有显著差异(P<0.001),见表1。

表1 结直肠癌组织中PD-L1表达水平与PD-1阳性淋巴细胞相关性(n)
2.3 结直肠癌中PD-1、PD-L1蛋白表达与临床病理特征的关系
癌细胞中PD-L1表达与年龄有关(P<0.01)。癌间质浸润淋巴细胞中PD-L1表达与年龄、TNM分期以及浸润深度(P<0.05)有关。癌组织中PD-1表达与性别和肿瘤大小(P<0.05)有关。见表2。

表2 结肠癌组织中PD-L1和PD-1的表达与临床病理特征的关系
3.讨论
PD-l正常表达在CD4—CD8—胸腺细胞上,诱导性表达于活化的T细胞、B细胞、骨髓细胞、树突状细胞、自然杀伤细胞(NK)、单核细胞等,当抗原清除,免疫应答完成后,T细胞的PD-l表达减少。PD-l持续性表达在T细胞上会诱导T细胞的衰竭。因此PD-l属于免疫抑制受体,而其本身也是活化T细胞的一个标志。PD-L1是PD-l的配体,属于B7家族中的负性共刺激信号分子,正常生理状态下,主要表达于组织细胞、内皮细胞、活化T细胞、B细胞、巨噬细胞和树突细胞等,它与活化T细胞表面PD-l结合,抑制T细胞活化,诱导T细胞凋亡,使机体的免疫应答反应维持在一定动态平衡[4]。肿瘤发生时,肿瘤微环境会诱导浸润性T细胞高表达PD-1分子,肿瘤细胞高表达PD-L1,导致肿瘤微环境中PD-1通路持续激活,PD-L1 与PD-1联接后,T 细胞功能被抑制,不能向免疫系统发出攻击肿瘤的信号[5]。PD-1/PD-L1 抑制剂可以阻断PD-1与PD-L1 的结合,阻断负向调控信号,使T细胞恢复活性,从而增强免疫应答。已有研究证实多种恶性肿瘤[6-11],如肺癌、黑色素瘤、胃癌、胰腺癌、乳腺癌、肾细胞癌等均通过表达PD-L1 来诱导形成免疫抑制性的肿瘤微环境,逃避机体的抗肿瘤免疫反应。
目前对于PD-1、PD-L1在结直肠癌中的表达研究较少,本实验结果显示,结直肠癌组织中高表达PD-1、PD-L1,其中,PD-1蛋白表达定位于癌间质浸润的淋巴细胞中,阳性率为32.6%,PD-L1蛋白表达主要定位于癌细胞和癌间质淋巴细胞,其总体阳性率为65.1%,两者的表达均高于对照组。并且,PD-1、PD-L1蛋白表达与多项临床病理特征相关,癌细胞中PD-L1表达与年龄密切相关(P<0.01),癌间质PD-L1表达与年龄、TNM分期以及浸润深度密切相关(P<0.05)。癌组织中PD-1表达与性别和肿瘤大小密切相关(P<0.05)。因此推测,结直肠患者PD-1/PD-L1高表达可以作为PD-1/PD-L1 抑制剂治疗的用药指标,同时联合临床病理参数,可作为疗效评估指标,有助于判断预后。另外,本实验结果显示结直肠癌组织中PD-1、PD-L1两者的蛋白表达呈显著正相关(P<0.001),此结果与马薇[12]、王也[13]在肺癌中的研究一致;在胃癌中,刘书漫[14]等发现PD-L1与PD-1的表达呈负相关,而吴圣[15]等的研究结果则显示两者之间的表达不存在明显的相关性;张伟[16]等在三阴性乳腺癌的研究中发现间质TIL中PD-L1的表达与PD-1表达有相关性,而肿瘤细胞PD-L 1的表达与PD1表达无相关性。由此看来,PD-1、PD-L1在不同肿瘤中的表达模式及相关性有所不同,其意义仍有待进一步研究。

