Pyrrosia petiolosa抗菌酯提物提取条件优化及效果
张安东, 王 磊, 陶榆玮, 宋丽菊, 成 娟,易思君, 吴道艳, 黄 敏, 赵 建*
(1. 四川大学 生命科学学院, 四川 成都 610064; 2. 四川省原子能研究院 辐照保藏四川省重点实验室, 四川 成都 610101)
石韦(Pyrrosiapetiolosa)始见于《神农本草经》,属于水龙骨科多年生常绿植物,在传统中药系统中常用于治疗肾炎、膀胱炎、尿结石、肺性气管炎、吐血、尿血[1-3],且在羌族民间常被用作外敷上药来治疗病原菌引起的伤口感染.近年来许多研究者报道,相较于化学合成法,植物中提取的化学成分对于拮抗耐药S.aureus有显著效果[4-6].有研究证实P.petiolosa提取物中含有槲皮素、木犀草素、皂苷、山奈酚等组分,也含有丰富的黄酮类和蒽醌类化合物,这些化合物均有较好的抗菌活性[7-8].但是,目前有关P.petiolosa活性成分研究较多,抑菌效果及提取条件优化研究较少.本文通过正交试验优化提取条件,同时通过抑菌圈大小、最小抑菌浓度(MIC)、最小杀菌浓度(MBC)来评估P.petiolosa酯提物(PPEAE)对S.aureus拮抗效果,为进一步研究其抑菌机制及后续研究提供理论基础.
金黄色葡萄球菌(Staphylococcusaureus)是典型的常见革兰氏阳性菌,更是一种人畜共患且严重危害人类健康的病原菌[9-12].当今世界,由S.aureus感染所引起的各类疾病日趋严重,同时该菌所产生引起食物中毒的肠毒素更是世界性难题[13].为有效遏制其蔓延和治疗相关感染引起的疾病,大量抗生素被开发和生产,然而伴随着抗生素的滥用,导致多种耐药S.aureus的出现[14],尤其是耐甲氧西林金黄色葡萄球菌的出现(MRSA),该菌在食品、医院、畜牧业变得愈发流行,极大地威胁着人类健康,且目前无非常有效控制的方法与治疗手段[15-16].因此,研究开发和寻找新型抗菌剂的任务已迫在眉睫.
1 材料与仪器
1.1 植物P.petiolosa采自四川省阿坝藏族羌族自治州汶川县绵虒镇,经四川大学植物学白洁副教授鉴定,阴干处理3 d后4 ℃冷藏保存备用.
1.2 菌株金黄色葡萄球菌(S.aureus)由四川大学资源微生物学及微生物技术四川省重点实验室提供并保藏.
1.3 试剂酵母粉、胰蛋白胨购自Oxoid公司;甘油、氯化钠、琼脂粉、乙酰乙酯购自蜀都化验设备有限公司;链霉素、红霉素购自Sigma公司;乙醇购自成都科龙化工集团.
1.4 仪器LDZX-30KB型灭菌锅(上海申安医疗器械厂),1389型生物安全柜(Thermo),HPS-250型恒温培养箱(哈尔滨市东明医疗器械厂),DK-8D型电热恒温三孔水浴锅(上海跃进医疗器械有限公司),R-201型旋转蒸发仪(上海申顺生物科技有限公司),BCD-160TMPQ型冰箱(海尔).
2 方法
2.1 主要溶液和试剂的配制
2.1.1PPEAE制备 称取阴干3 d的P.petiolosa叶片200 g,剪碎后放入具塞广口瓶中,加入4 000 mL乙酸乙酯浸泡3 d后过滤,滤液在40 ℃条件下旋转蒸发至终质量浓度2 g/mL(原叶质量),酯提物经0.22 μm微孔滤膜除菌后于4℃冰箱保存备用[17].
2.2 提取方法单因素实验及正交优化
2.2.1不同质量浓度的选择 准确向7个蓝口瓶中分别加入250、500、750、1 000、1 250、1 500和1 750 mL乙酸乙酯,每瓶加入50 g阴干3 d的P.petiolosa叶片,室温浸泡5 d,终产物通过旋蒸浓缩至终质量浓度1 g/mL(原叶质量).
2.2.2不同温度的选择 在P.petiolosa质量浓度为1/20 g/mL的条件下,6个蓝口瓶中均加50 g阴干3 d的P.petiolosa叶片,分别在4、25、40、50、60和70 ℃恒温水浴下浸泡5 d,旋蒸浓缩至终质量浓度为1 g/mL(原叶质量).
2.2.3不同时间的选择 在P.petiolosa质量浓度为1/20 g/mL、提取温度为50 ℃的条件下,向6个蓝口瓶中分别加入50 g阴干3 d的P.petiolosa叶片,恒温水浴下分别浸泡1~6 d,旋蒸浓缩至终质量浓度为1 g/mL(原叶质量)[18].
2.2.4提取条件的正交优化 根据单因素试验结果,以PPEAE对S.aureus抑菌圈大小为指标,以提取工艺中质量浓度(A)、提取温度(B)和提取时间(C)为因素设立3水平,选取L9(33)正交表(表1)的试验法优化最佳提取工艺条件[19].
2.3 PPEAE对S.aureus抑菌拮抗活性测定采用牛津杯法和倍比稀释法,并绘制生长曲线,分别检测PPEAE的抑菌活性.将过夜活化的S.aureus稀释至1×106CFU/mL,取100 μL菌悬液涂布至LB平板.将不同质量浓度PPEAE分别吸取130 μL加入至放置在涂有S.aureus的平板牛津杯中,37 ℃恒温培养16 h后测量抑菌圈直径,以乙酸乙酯和LB培养基、红霉素和链霉素分别作为阴性对照组与阳性对照,16 h后测量抑菌圈大小(包括6 mm的牛津杯在内)[20-21].96孔板1~14孔中加入100 μL LB液体培养基,向第一个孔中加入1 g/mL PPEAE 100 μL,再依次进行倍比稀释直至第十二孔,分别向1~12孔加入100 μL过夜重悬的S.aureus菌液,第十三和第十四孔加入200 μL培养基和菌液作为对照.将最小抑菌浓度及两边的孔涂平板,37 ℃培养箱中培养24 h后,平板上无菌落生长的处理浓度即为MBC[22].
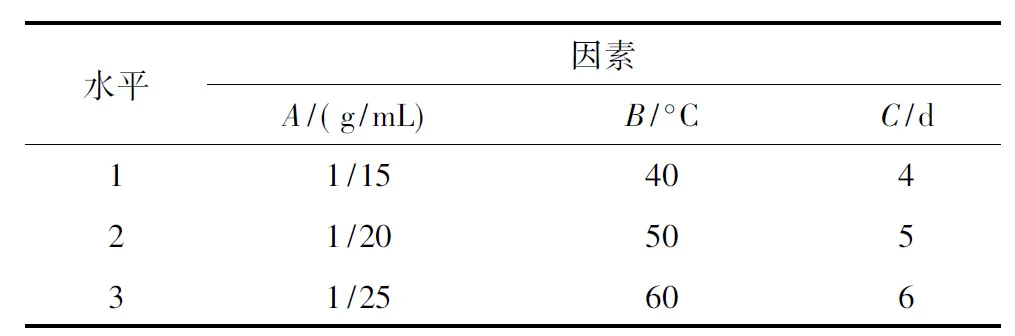
表 1 正交设计试验因素与水平表
2.4 PPEAE拮抗S.aureus生长变化测定向A、B 2个装有100 mL LB液体培养基的锥形瓶中分别加入1 mLS.aureus菌液,37 ℃培养,在对数生长期向A锥形瓶中加入使得终质量浓度为MIC的PPEAE,B瓶作为对照,37 ℃、150 r/min培养,每2 h取3 mL培养液测定600 nm处吸光值,取各个实验OD600平均值绘制生长曲线[23].
2.5 PPEAE作用于S.aureus后菌体形态的测定分别向4支含有S.aureus菌液离心管中加入1/2 MIC PPEAE、MIC PPEAE、生理盐水、乙酸乙酯,37 ℃、150 r/min培养12 h.8 000 r/min离心3 min后PBS缓冲液洗涤,加入质量分数3%戊二醛,放入4 ℃冰箱固定24 h.8 000 r/min离心3 min后PBS洗涤,用质量分数30%~100%不同梯度乙醇脱水20 min,加入乙酸异戊醋置换2次,每次20 min.将处理后菌液滴50 μL于0.5 cm2的盖玻片上,冷冻干燥1 h后将样品置于电镜载物台观察.
3 结果
3.1 提取方法单因素实验
3.1.1不同质量浓度条件下浸提所得PPEAE对S.aureus拮抗效果影响 由图1可知,质量浓度分别为1/5、1/10、1/15、1/20、1/25、1/30和1/35 g/mL,常温浸提5 d的条件下,PPEAE对S.aureus的抑菌效果随质量浓度的提高先增强后减弱,在1/20 g/mL时抑菌圈达到最大值26 mm.

图 1 不同质量浓度浸提所得PPEAE对S. aureus的拮抗效果
3.1.2不同温度条件下浸提所得PPEAE对S.aureus抑菌效果的影响 由图2可知,在其他条件一定时,50 ℃浸提PPEAE对S.aureus抑菌效果最好,温度小于50 ℃时,PPEAE对S.aureus抑菌效果随温度的增加而提高,温度大于50 ℃时,PPEEA对S.aureus抑菌效果随温度的增加而减弱.
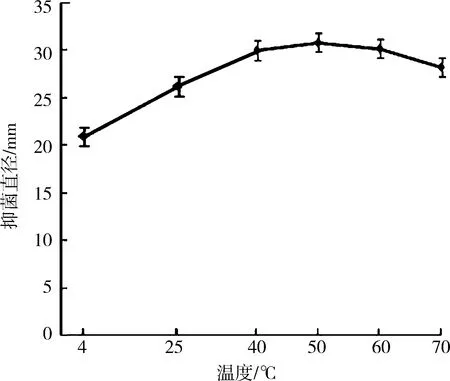
图 2 不同温度浸提所得PPEAE对S. aureus的拮抗效果
3.1.3不同时间条件下浸提所得PPEAE对S.aureus抑菌效果的影响 由图3可知,随着浸泡时间的延长,抑菌效果逐渐增强,浸泡5 d所得PPEAE对S.aureus抑菌圈直径为30.8 mm.随着时间的再延长,抑菌效果变化不显著,因此,选取5 d作为最适提取时间.
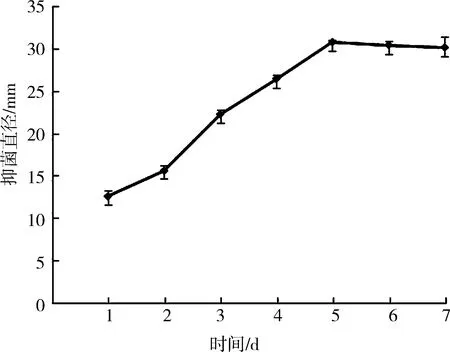
图 3 不同时间浸提所得PPEAE对S. aureus的抑菌效果
3.2 提取优化后PPEAE对S.aureus的抑菌效果由表2数据分析可知,在9种试验方法中,试验组6对S.aureus的拮抗作用最强,抑菌圈直径可达35.67 mm.但在不同因素水平下综合评价:根据K1值可知,质量浓度1/20 g/mL>1/25 g/mL>1/15 g/mL;根据K2值可知,温度60 ℃>40 ℃>50 ℃;根据K3值可知,浸泡时间5 d>4 d>6 d;根据极差(R)大小判断可知B>C>A.因此,在3种因素中,提取温度是影响PPEAE对S.aureus抑菌效果最大因素,其次是提取时间,最后是质量浓度.综合考虑各因素可最终确定PPEAE对S.aureus抑菌效果的最佳提取方案是A2B3C2.
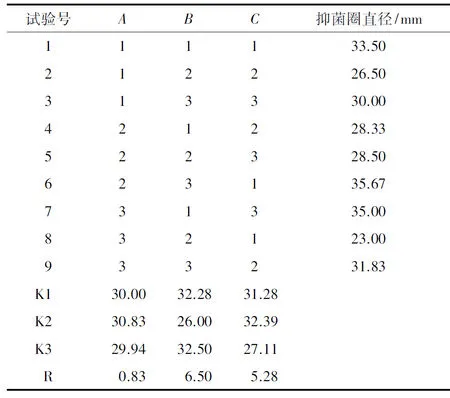
表 2 L9(33)正交提取优化后PPEAE对S. aureus的抑菌效果
3.3 PPEAE对S.aureus抑菌活性测定通过牛津杯法评估PPEAE的抑菌效果,由图4可看出,随着PPEAE质量浓度的增加,PPEAE对S.aureus抑菌圈直径从8 mm增加到24 mm.相同质量浓度下,PPEAE抑菌圈大于链霉素,PPEAE抑菌活性较好.
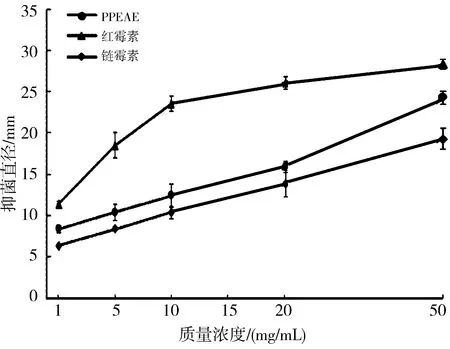
图 4 不同质量浓度PPEAE与抗生素对S. aureus抑菌效果比较
3.4 PPEAE对S.aureus的MIC和MBC值的测定进一步对PPEAE作用的抑菌效果进行探究,通过检测PPEAE对S.aureus的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)数据显示,MIC和MBC值分别为7.8和15.6 mg/mL,拮抗效果较好.
3.5 生长曲线测定由图5可以看出,对照组S.aureus在4 h进入对数期,18 h生物量达到最高,20 h开始进入衰亡期.PPEAE与S.aureus共培养后,S.aureus生长明显受到抑制,相较于正常组其抑制率在24 h时达到83.69%.对比两组生长曲线可知,PPEAE可在MIC处理条件下显著抑制S.aureus的生长.
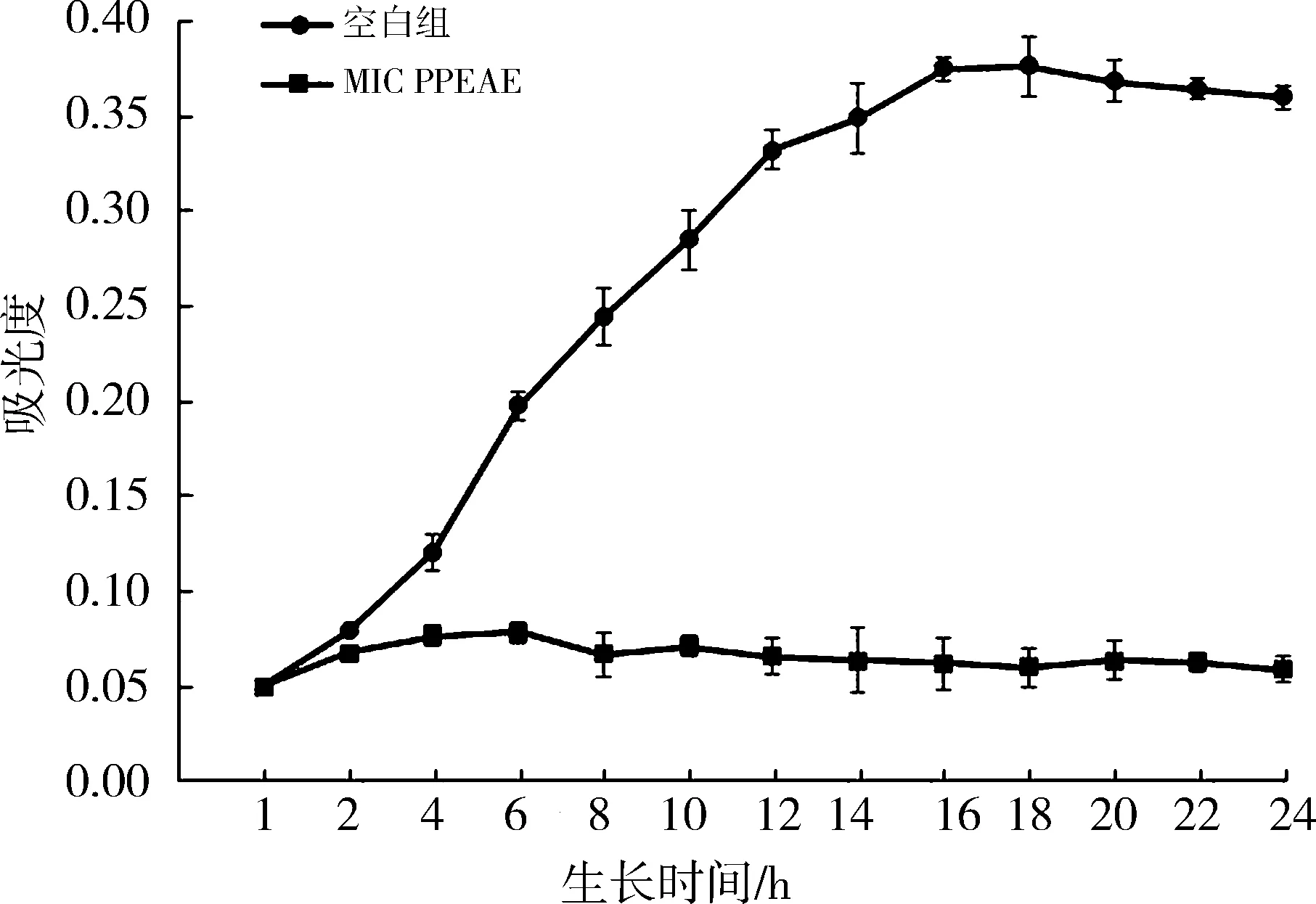
图 5 PPEAE作用S. aureus的生长曲线
3.6 PPEAE作用S.aureus形态变化从图6可看出,正常组S.aureus菌落完整,细胞结构完整,细胞壁分布均匀、形态饱满、结构清晰、完整光滑,未有细胞破损情况,呈葡萄球状(A);与正常组相比,阴性对照组无显著变化(B);1/2 MIC PPEAE作用于S.aureus后,形态发生改变,菌体表面粗糙出现凹痕(C);MIC PPEAE作用于S.aureus后,菌体部分表面有凹陷,出现不规则褶皱、形状不规则、无饱满感,细胞壁、胞膜损伤[24](D).
4 讨论
通过对P.petiolosa酯提物提取条件进行优化,分别以质量浓度、提取温度、提取时间3个单因素下提取所得的PPEAE对S.aureus的抑菌活性进行了测定,并根据单因素试验的所得结果进行正交优化试验,最终得到最佳提取条件是质量浓度1/20 g/mL、提取温度60 ℃、提取时间5 d.采用牛津杯法测定了PPEAE对S.aureus体外抗菌活性,与相同浓度下的抗生素相比,PPEAE拮抗S.aureus的作用效果要强于链霉素,稍弱于红霉素.在PPEAE最小抑菌浓度条件下处理S.aureus后,相较于对照组,其生长、繁殖受到明显抑制.SEM结果显示,PPEAE处理后的S.aureus菌体表面不平整,部分菌体表面出现凹陷、皱缩,且有少量囊泡状不规则突起,与其他的抗菌剂作用后的S.aureus的结果相类似[24].可能原因是PPEAE中某些活性化合物作用于菌体后会对S.aureus菌体细胞造成一定的损伤与影响[25].因此,可以看出PPEAE具有较强的拮抗S.aureus活性.
综上所述,Pyrrosiapetiolosa中的活性成分可在较为简易的条件下被乙酸乙酯所提取,且在体外试验中展示出较高效的拮抗S.aureus活性.本实验对P.petiolosa提取条件的优化以及其拮抗S.aureus作用效果的初步研究,不仅为开发新的抗菌药物提供方向,也为进一步研究PPEAE活性成分与拮抗S.aureus分子机制研究奠定基础.

