肌原纤维蛋白界面膜协同凝胶基质提高乳液的稳定性
李儒仁 谢振峰 荣良燕 邵俊花 贾 娜 杨 鹏 高茗巧 刘登勇
(渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁省食品安全重点实验室 辽宁锦州 121013)
健康低脂乳化型肉制品是由瘦肉、脂肪、盐等其它辅料经斩拌所得的乳化体系,因其蛋白质含量高,饱和脂肪含量低,营养丰富而深受人们喜爱,然而热加工过程中存在出油、出水等问题,即“破乳”现象[1-3]。明确稳定肉糜的机理尤为重要。
目前主要存在两个稳定肉糜理论,即乳化理论和物理包埋理论。前者主要强调界面蛋白膜包裹脂肪球,有效抑制脂肪滴聚集,深入研究发现乳化过程中肌球蛋白分子展开,亲水尾部分布在水相,亲油头部排布于脂肪球表面,降低油水间界面张力,维持乳化稳定性[4-6];而后者主要强调蛋白质凝胶基质的贡献,热加工过程中诱导蛋白质结构发生改变,形成多孔状结构,脂肪滴镶嵌或贯穿于凝胶网状结构中,以稳定肉糜[6-8]。两种理论对稳定肉糜均有一定道理,而乳化后所得产品保油性依赖于单一界面蛋白膜,还是蛋白质凝胶网状结构,或是两者之间协同发挥作用,尚未存在更清晰的解释;蛋白质体积分数是影响低脂乳化型肉制品保油性的重要因素[9],其作用机制目前尚不完全清楚。由此提出假设:不同体积分数条件下,肌肉蛋白质稳定油/水乳液可能存在不同的途径。
本研究以猪肉肌原纤维蛋白为对象,选取橄榄油制备不同蛋白体积分数的乳化体系,探究不同体积分数下(1%,5%,10%)肌原纤维蛋白稳定油/水乳液的具体途径。这对完善肉糜稳定理论及实际生产中指导配方设计具有一定意义。
1 材料和方法
1.1 材料与试剂
三元猪(父本为杜洛克公猪,母本为长白公猪和大白母猪杂交选留的杂交母猪)猪背最长肌(宰后48 h)、橄榄油,锦州大润发超市。
氯化钠、磷酸二氢钠、磷酸氢二钠等均为分析纯级;乙二醇二乙醚二胺四乙酸(EGTA)、吐温20(Tw-20),中国索莱宝生化试剂有限公司;牛血清蛋白(BSA),美国Sigma公司。
1.2 仪器与设备
TGL-20M台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;JYS-A900绞肉机,九阳股份有限公司;T25 digital Ultra-turrak均质机,德国IKA集团;UV-2550紫外可见分光光度计,岛津仪器(苏州)有限公司;DHR-1流变仪,美国TA仪器公司;ALPHA1-2LDplus冷冻干燥机,北京奥创兴业有限公司;FE20 pH计,美国Mettler Toledo公司。
1.3 试验方法
1.3.1 肌原纤维蛋白(MFP)的提取 参照 Liu等[10]的方法并略作修改。三元猪宰后48 h取其一定量背最长肌(pH 5.6~5.9)。单个样品(约500 g)进行真空包装冻藏(-30℃),MFP提取之前先将冷冻的样品在4℃下解冻5 h,破碎并加入4倍体积的提取液(10 mmol/L Na3PO4,0.1 mol/L NaCl,2 mmol/L MgCl2和1 mmol/L EGTA,pH 7.0),匀浆60 s,2 000×g冷冻离心 15 min,取沉淀重复上述步骤2次,最后所得沉淀加入4倍体积0.1 mol/L NaCl溶液按上述离心条件洗涤沉淀3次,最后一次离心前用4层纱布过滤,然后用0.1 mol/L HCl调节pH值至6.25,所得MFP沉淀于4℃冷藏备用,48 h内用完。
1.3.2 乳液样品的制备 MFP稳定乳液样品的制备:用25 mmol/L磷酸缓冲溶液(pH 6.25,含 0.6 mol/L NaCl)将不同体积分数的MFP和一定体积分数(10%)的橄榄油预混合,混合液置于均质机预乳化,条件为:首先低速(3×103r/min)均质 1 min,其次高速(12×103r/min)均质 3 次,每次均质30 s,间隔 30 s,最后低速(1×103r/min)乳化 1 min完成预乳化,得到预乳化液后进一步超声乳化得到微乳液样品,乳化条件:功率450 W,频率2.5 s on/2.0 s off,超声时间 6 min。
Tw-20稳定乳液样品的制备:将乳化剂MFP换为Tw-20,其余乳化条件同上。
1.3.3 粒径分布及乳液大小测定 乳液粒径分布及液滴大小由Zeta Sizer Nano-ZS分析。测试参数:折光率1.34,测量角度90°,温度室温。乳液液滴大小平衡稳定时间120 s,连串数印数3,跑图持续时间10 s,测量数3,延迟测量时间10 s[11]。

1.3.4 乳析指数(CI)测定 参考Liu等[12]的方法,略作修改。取一定量新鲜乳液(3 mL)置于麦氏比浊管中,拧紧瓶盖室温静置24 h后测定乳析层高度Hs及乳液总高度Ht,乳析指数(CI)计算公式见式(1)。
1.3.5 乳液热稳定性 乳液热稳定性通过加热后蛋白与油滴的结合能力(FB)来表征。参照Cofrades等[13]的方法并略作修改。称取一定重量(W1)乳液于15 mL离心管,置于恒温水浴锅中加热,加热条件为从30℃升温至70℃,并在70℃保温30 min,加热后取出离心管并小心取出液体转移至已称重的培养皿(W2),记录清液和培养皿总重(W3)。将收集好的液体同培养皿一起于103℃加热16 h,记录加热后的总重(W4)。乳液热稳定性计算公式见式(2)。

1.3.6 乳液氧化稳定性 参考Nickos等[14]的方法,略作修改。称取一定质量乳液(10 g)于15 mL离心管,70℃条件下加热30 min作为氧化处理,取部分加热后的样品(5 g)及25 mL 5%TCA于50 mL离心管,均质并过滤,取5 mL滤液和5 mL 0.02 mol/L TBA 于试管,(80±1)℃水浴加热 40 min,冷却至室温后于532 nm波长处测吸光值。氧化稳定性用每千克样品中含丙二醛(MAD)的量(mg)表示。
1.3.7 乳化活性及乳化稳定性 参考Molina等[15]的方法并略作修改。乳液均质乳化完毕后立即从底部吸取10 mL,用0.1%SDS稀释到确定倍数,于波长500 nm处测定吸光值A0,静置30 min后,上述同样方法步骤测得吸光值A30,乳化活性(EAI)和乳化稳定性(ESI)计算公式见式(3)、式(4)。

式中,N——稀释倍数(100);C——乳化前MFP的质量浓度(mg/mL);φ——乳液中油相的体积分数。
1.3.8 乳液流变学特性 静态流变:取一定量乳液,采用DHR-1流变仪测定,将不同处理条件下的乳液均匀涂布于50 mm测试平台,涂膜硅油密封,测试参数:测试温度25℃,平衡时间5 s,间隔时间30 s,乳液黏度的变化随着剪切速率从4 s-1至400 s-1而测定。
动态流变:前处理同上,测试参数:频率为0.1 Hz,应变2%,夹缝间距为0.5 mm,起始温度20℃,升温速率1℃/min,终止温度80℃,在该参数下测定储能模量(G′)和损失模量(G")。
1.3.9 界面蛋白吸附量测定 参考Maneephan等[16]的方法并略作修改。新鲜乳液在25℃,10 000×g离心40 min,得到乳脂相和乳清相,乳清相经注射器小心转移后用0.22 μm滤膜过滤。以牛血清蛋白(BSA)为标准蛋白计算水相蛋白含量,界面蛋白吸附量计算公式见式(5)。
1.4 统计分析

2 结果与分析
2.1 MFP体积分数对乳液分层稳定性的影响
乳液分层情况及微观粒度分布可表征其稳定性。不同MFP体积分数下乳液微观粒径分布及其分层指数变化如图1a和1b。蛋白质体积分数较高时(5%和10%),粒径分布均呈单峰分布,且粒径为1~10 μm,说明该体积分数下形成的乳液稳定;低体积分数下,乳液容易分层,粒径分布不均匀,在1~100 μm出现两个拖尾峰,表明此时乳滴聚集,乳液稳定性差。这与图1b结果对应,随着蛋白质体积分数的增加,乳析指数显著降低(P<0.05)。乳化过程中乳化剂体积分数影响乳滴聚集,高蛋白体积分数下乳化后连续相黏度增加,抑制乳滴流动[17]。
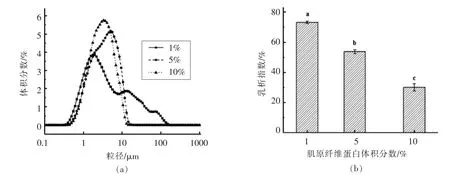
图1 不同MFP体积分数下乳液的粒径分布和乳析指数Fig.1 The droplet size and creaming index of emulsions at different MFP volume fractions
2.2 MFP体积分数对其乳化性能的影响
乳化活性指数(EAI)及乳化稳定性(ESI)可以用来表征乳液的乳化性能。不同MFP体积分数下乳液的乳化活性如图2所示。当MFP体积分数从1%调整为5%时,EAI显著增加(P<0.05),而ESI无明显变化;当MFP体积分数为10%时,二者显著增加(P<0.05)。这表明在MFP体积分数较高时可以有效抑制乳滴聚集,乳液更稳定,这是由于当乳化剂体积分数增加时,乳化体系中能量输入增加,抑制乳滴间相互作用,维持乳液稳定[18];乳化后形成的界面蛋白膜能够降低其表面张力,抑制聚集,改善乳化稳定性及乳化活性,维持乳液稳定[19]。
2.3 MFP体积分数对界面蛋白吸附量的影响
不同MFP体积分数下界面蛋白吸附量变化如图3所示。MFP体积分数从1%调整至10%,界面蛋白吸附量显著增加(P<0.05),表明增加蛋白质体积分数,实际与油滴表面结合的有效蛋白质含量增加,界面蛋白吸附量增加;连续相中未吸附至油滴表面的蛋白与界面蛋白,通过其尾部与尾部相互交联方式,实现蛋白质在油滴表面的进一步吸附排布,导致膜蛋白吸附量增加[20-21]。界面蛋白膜厚度对乳化稳定性具有重要影响,乳化体系中包裹于脂肪滴及脂肪微粒表面的蛋白含量越大,形成较厚界面蛋白膜是肉糜乳化稳定性增强的原因[4,22-23]。
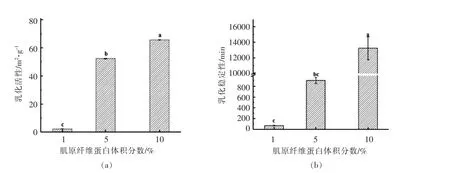
图2 不同MFP体积分数下乳液的乳化活性(a)和乳化稳定性(b)Fig.2 The emulsifying activity(a)and emulsifying stability(b)of emulsions at different MFP volume fractions
2.4 MFP体积分数对乳液保油性的影响
不同MFP体积分数下乳液保油率变化如图4所示。随着MFP体积分数增加,FB值显著增加(P<0.05),即乳液保油性随MFP体积分数的增加而显著增加,这一研究结果与Damodaran等[20]报道结果一致。说明在较高蛋白体积分数下,MFP在橄榄油-水界面吸附形成的界面蛋白热稳定性较好。界面蛋白膜的形成主要涉及两个重要环节:一

图3 不同体积分数MFP在油滴表面的吸附量Fig.3 The surface protein coverage at different MFP volume fractions
2.5 MFP体积分数对乳液流变学特性的影响
蛋白质流变学特性常用与于评价食品加工过程中蛋白质结构变化[27],表现为蛋白质相转化及凝胶形成能力,这对其维持乳液稳定具有重要作是两亲性肌球蛋白吸附至脂肪球表面形成肌球蛋白单分子层,其亲水氨基酸趋向水相,疏水氨基酸趋向油相[4];二是其它盐溶性肌原纤维蛋白通过共价或非共价相互作用与肌球蛋白尾部交联[24]。故连续相中增加蛋白质体积分数,吸附在油水界面蛋白含量增加,形成蛋白膜柔性越好,抗热压能力增强,表现出良好热稳定性[25];蛋白质参与乳化形成乳液的稳定性易受乳化及加热过程中溶胶或凝胶网状结构的影响,蛋白质体积分数成为影响凝胶形成的关键[26],故界面蛋白膜和蛋白质凝胶网状结构协同提高乳液热稳定性。用。不同处理组对其流变学特性影响见图5a、5b、5c。乳液黏度反映乳液流动性,由图5a得知,剪切速率增大,乳液黏度先急剧下降至0.01 Pa·s后趋于平稳,这是由于增加剪切速率破坏布朗运动和蛋白质分子之间的相互作用力,导致乳液在一定剪切速率下流动更加有序,降低剪切抗性,总体黏度降低[28-30]。MFP体积分数越高,相同剪切速率下黏度也越高(10%>5%>1%),表明增加蛋白质体积分数可以增大乳液黏度,维持乳液稳定,这与乳析指数及粒径分布结果一致(图3)。

图4 不同MFP体积分数下乳液的热稳定性Fig.4 The thermal stability of emulsions at different MFP volume fractions
储能模量(G')反映凝胶体系的弹性,G'越高形成凝胶的能力越强[31]。由图5b可知,同一温度下G'随蛋白质体积分数增加而增加,说明蛋白质体积分数越高,凝胶能力越强;5%MFP处理组和10%MFP处理组的G'在30~48℃(±2℃)无明显变化,温度升高至(60±2)℃,两者G'先逐渐增大后无明显变化,并分别在(60±2)℃和(58±2)℃达最高值(0.68 Pa和1.06 Pa);温度继续升高至80℃,10%MFP处理组的G'逐渐上升,5%MFP处理组无明显变化;1%MFP处理组G'全程均无明显变化。说明增加蛋白质体积分数有助于降低蛋白质变性温度,且凝胶能力更强,这是由于较高蛋白质体积分数下肌球蛋白分子轻链从肌球蛋白中分离,天然螺旋结构展开形成β折叠和无规则卷曲,增强蛋白质之间交联,形成一个稳定且不可逆的凝胶结构[32,21];1%MFP 处理组G'随温度升高无明显变化,说明蛋白质变性特征不明显,可能是由于水相中蛋白质体积分数低,蛋白质无法表现出弹性特征。蛋白质体积分数会影响蛋白质变性温度,进而影响蛋白质凝胶形成能力,高体积分数蛋白质条件下形成凝胶更具弹性,图5c显示不同MFP体积分数下损失模量G"随温度变化情况,G"反映乳液黏性特征,其变化趋势与G'变化趋势相似,不同蛋白质体积分数下,乳液黏度随蛋白质体积分数增加而增加,说明肌原纤维蛋白在高体积分数时能更好抑制乳滴流动,提高乳液稳定性。

图5 不同MFP体积分数下乳液的流变学特性Fig.5 The rheological characterization of emulsions at different MFP volume fractions
2.6 MFP体积分数对乳液氧化稳定性的影响
热处理作为生产乳化型肉制品必备单元操作之一,加热过程往往伴随着蛋白及脂肪氧化,丙二醛是油脂氧化后产物,是衡量乳液氧化稳定性的重要依据[33-34]。不同MFP体积分数下乳液氧化稳定性变化如图6所示。结果表明在同一MFP体积分数下,相比添加Tw-20的对照组,仅含MFP乳液氧化稳定性显著高于对照组(P<0.05),说明添加Tw-20降低乳液的氧化稳定性,这可能由于与非离子型表面活性剂Tw-20在界面上与MFP竞争吸附,导致形成的界面蛋白膜不稳定[35];而仅含MFP的乳液组及含MFP和Tw-20的乳液组,二者氧化稳定性均不随蛋白质体积分数增加发生显著变化(P>0.05),表明蛋白质体积分数对新鲜乳液中油滴氧化无显著影响;多数水包油乳液中,氧化通常发生在油-水界面,吸附在界面的蛋白质成为维持整个产品氧化稳定性的主要因素[11],故新鲜乳液中形成的界面蛋白膜可以有效抑制其氧化。

图6 不同MFP体积分数下乳液的氧化稳定性Fig.6 The oxidation stability of emulsions at different MFP volume fractions
3 讨论
肌原纤维蛋白界面蛋白膜协同凝胶基质改善水包油型乳液的保油性。蛋白质体积分数越高,EAI越大,界面蛋白吸附量增加,油水界面张力下降,乳液稳定性增强[19-20],低体积分数下(1%)乳液容易分层,这是由于低MFP体积分数下乳液黏度较小,流动性增强,稳定性较差,乳滴易聚集[28]。
乳滴聚集作为乳液失稳的重要物理过程之一,主要有两步:两乳滴靠近时,范德华力、熵以及静电相互作用下分隔乳滴的水膜被破坏,导致乳滴逐渐靠近聚集;其次热扰驱动下乳滴之间形成气孔并相互连接,气孔之间的距离主要依赖于界面张力大小,低MFP体积分数下,乳滴粒径大小不均匀,由于熵值的作用,不同大小乳滴间能量分布有差异,导致能量偏移,较大乳滴微粒的界面张力降低,乳滴间产生气孔通道,且低MFP体积分数下界面蛋白膜的硬度无法完全抵抗拉普拉斯压力梯度,导致在拉普拉斯压力作用下,两液滴由聚集进一步转变为聚并,形成更大的球状乳滴,当MFP体积分数较高(10%)时,乳液粒径分布均匀,乳化体系中摄入的能量足以抵制驱动乳液聚集的作用力,维持乳液稳定[36-38]。此外,可能由于实际吸附在油水界面的蛋白质有一定限度,导致连续相中未吸附蛋白质和蛋白质之间通过静电相互作用等形成弱共聚合物,在油滴周围构筑一个物理屏障,有效抑制其聚集,维持稳定[39]。加热后水相中未吸附蛋白质在疏水作用力、氢键、静电相互作用和二硫键等多种作用力驱动下,蛋白质之间发生聚集,形成具有持油、持水能力的有序三维网状结构;体积分数越大,热处理蛋白质展开后疏水面积更大,形成较高黏弹性的凝胶结构,抑制体系内乳滴流动,提高乳液热稳定性[40-42];界面吸附肌球蛋白经热变性展开于油滴表面形成肌球蛋白单分子层,连续相中未吸附蛋白质通过尾部与界面肌球蛋白的尾部相互交联,形成一定厚度界面蛋白膜,维持乳液稳定[4,24],故界面蛋白膜及蛋白质凝胶基质,协同提高该乳化体系保油性。流变学研究表明,不同蛋白质体积分数下其变性温度有所不同,10%MFP处理组为(58±2)℃,5%MFP处理组为(60±2)℃,可能由于蛋白质体积分数降低,相对水分含量增加,根据热力学定律,水吸收该乳化体系中大部分热量导致蛋白质变性延缓,比较1%MFP处理组从30℃程序升温至80℃的过程中未出现明显变性情况,故低蛋白质体积分数下,凝胶形成能力弱,对肉糜产品而言,当加热至中心温度为69℃左右时,形成的界面蛋白膜能够维持脂肪球稳定[4],故此时加热条件下维持乳液热稳定情况主要依赖于界面蛋白膜发挥作用;当蛋白质体积分数较高时,满足凝胶形成条件,由图5b可知,蛋白质开始变性形成凝胶是在58℃左右,当温度继续升至70℃左右时,形成稳定凝胶,故较高蛋白质体积分数下经热诱导足以形成凝胶,脂肪能很好镶嵌于凝胶基质,同时加热过程中肌球蛋白分子变性展开于脂肪球表面成膜,较高蛋白体积分数下热诱导形成凝胶基质覆盖了界面蛋白膜,对油滴实现“双重保护”,即协同改善乳液的保油性。研究结果对丰富和完善稳定肉糜机制具有一定意义,然而界面蛋白膜和凝胶基质具体如何协同改善其保油性有待进一步研究。
4 结论
较高蛋白质体积分数有利于维持乳液理化稳定性;加热后MFP界面蛋白膜与其凝胶基质协同改善乳液热稳定性;新鲜乳液中形成的界面蛋白膜可以有效抑制乳液氧化。

