磁性复合载体固定生姜蛋白酶的工艺优化研究
罗璇,王秀原,钱静,罗紫薇
(武汉设计工程学院 食品与生物科技学院,武汉 430205)
生姜蛋白酶是从生姜中提取出的一种新型植物蛋白酶[1],其应用前景十分广泛,可用作食品添加剂,如嫩肉剂、酒澄清剂、乳制品凝固剂等[2],且具有极好的药用保健价值;但在实际生产应用中,处于游离状态的生姜蛋白酶对于环境较敏感,易失活,反应后难以回收[3],导致其无法重复利用。
传统酶的固定化多采用明胶、琼脂糖、海藻酸钠、醋酸纤维素和聚丙烯酰胺等为载体[4],而以纳米Fe3O4为主的磁性固定化材料具有良好的磁响应性和生物相容性的显著特征,且其酶结合能力较高[5],毒性小,易回收。磁性Fe3O4纳米粒子可以和各种天然生物大分子、合成高分子及无机物反应生成磁性复合微球,避免其由于磁性吸引和分子间作用力发生聚集沉淀,又可以在表面引入活性功能基团,被广泛应用于生物、医药等领域[6]。
目前,国内外对于生姜蛋白酶磁性复合载体的固定化研究还未见报道。现有的利用磁性复合体对酶的固定化研究报道也不多,且少量研究集中于磁性复合载体对脂肪酶、纤维素酶及果胶酶的固定化[7-9]。
为了进一步提高在实际操作过程中固定化生姜蛋白酶的稳定性及回收率,本研究采用海藻酸钠、明胶与Fe3O4磁核制备成磁性复合载体,并结合戊二醛交联,协同对生姜蛋白酶进行固定,以得到磁性复合载体固定化生姜蛋白酶;并通过单因素试验结合Box-Behnken响应面分析法进行优化,确定固定生姜蛋白酶最佳工艺条件及预测模型,并对固定化酶与游离酶的部分酶学性质进行研究,旨在为磁性复合载体对生姜蛋白酶的固定化提供理论依据。
1 材料与方法
1.1 材料与仪器
鲜生姜:市售;磷酸氢二钠、磷酸二氢钠、柠檬酸钠、氨水、海藻酸钠、明胶、三氯化铁、硫酸亚铁、三氯乙酸、碳酸钠、干酪素、50%戊二醛、氯化钙、氯化钠:均为分析纯;福林酚试剂:生物纯。
UV2000紫外可见分光光度计 尤尼柯(上海)仪器有限公司;TG16-WS离心机 长沙湘智离心机仪器公司;FA 2014 B电子天平 上海越平科技仪器有限公司;HH-S2电热恒温水浴锅、SHZ-88恒温振荡器 金坛市医疗仪器厂。
1.2 方法
1.2.1 生姜蛋白酶液的制备
取外形完好、无腐烂和机械损伤的新鲜生姜50 g,洗净, 切成小块后,加入2倍体积的磷酸氢二钠-磷酸二氢钠缓冲液(0.05 mol/L,pH 6)研磨30 min,过滤, 将滤液收集至250 mL的三角瓶中,并置于4 ℃冰箱中,2 h后以4000 r/min离心10 min,取上清液,即得生姜蛋白酶液,测其初始酶活。
1.2.2 Fe3O4磁核制备
将0.25 mol/L的硫酸亚铁溶液100 mL、0.5 mol/L氯化铁溶液200 mL以及0.1 mol/L柠檬酸钠溶液40 mL混合,于75 ℃恒温搅拌10 min,滴加10%氨水调节pH为10,并等待其继续反应40 min后,离心10 min,弃上清液,滤渣用蒸馏水重复洗涤至中性,放入80 ℃烘箱干燥,保存备用。
1.2.3 磁性海藻酸钠明胶微球的制备方法
将一定量的Fe3O4磁核与3.5%海藻酸钠及3.0%明胶以一定体积比例混合,室温下恒温振荡器混合均匀;用注射器吸取上述混合液,从一定高度滴入浓度为2% 的CaCl2溶液中,以形成凝胶微球;更换CaCl2溶液,于4 ℃下静置硬化2 h后,再滤出凝胶微球,用质量分数为0.9%的NaCl溶液洗涤,沥干,于 50 ℃干燥。
1.2.4 固定化生姜蛋白酶
将磁性凝胶微球与戊二醛交联2.5 h后,用蒸馏水洗涤,并于50 ℃干燥,以获得磁性凝胶微球复合载体。将其与酶液混合,室温下恒温振荡器混合均匀,用蒸馏水洗涤,获得磁性复合载体固定化生姜蛋白酶,并测其酶活。
1.2.5 生姜蛋白酶活力的测定[10]
酶活力测定方法:分别取酶液和酪蛋白底物1 mL于水浴中预热 2 min,混合均匀后继续恒温反应10 min,加入 0.4 mol/L 三氯乙酸 2 mL,沉淀残余蛋白。离心,取1 mL上清液,加入 0.4 mol/L 碳酸钠溶液和 1 mL稀释后的福林酚试剂,混合均匀,在 40 ℃水浴显色 10 min,用紫外可见分光光度计测试其在 680 nm下的吸光度。
生姜蛋白酶活力(U)=A×K×N×4/10。
式中:A为样品的平均吸光度值;K为100除以酪氨酸标准曲线上100 μg/mL对应680 nm处的吸光度值;N为酶液稀释倍数;4为反应液总体积;10为10 min,酶液分解酪蛋白反应时间。
固定化酶相对酶活力(%)=每次使用后固定化酶活力/最高固定化酶活力×100。
1.2.6 酪氨酸标准曲线的制作方法
分别取0,10,20,30,40,50 μg/mL浓度的酪氨酸标准溶液0,1,2,3,4,5 mL于试管中,并分别用蒸馏水定容至10 mL, 再于每个试管中滴加0.4 mol/L碳酸钠溶液5.0 mL和福林试剂使用液1.0 mL,置于40 ℃水浴中恒温反应20 min;在波长680 nm下, 以OD值为横坐标,酪氨酸标准溶液的浓度为纵坐标,绘制酪氨酸标准曲线;根据空白对照,测定不同酪氨酸浓度的溶液吸光度。
1.2.7 主要影响因素的确定
根据文献[9]设计表1中的单因素试验水平条件,测定其对应的酶活力,并换算成相对酶活力。

表1 溶剂提取单因素试验因素水平
1.2.8 响应面设计
在单因素试验结果的基础上,选取对酶活影响最大的因素即海藻酸钠浓度、戊二醛浓度、Fe3O4磁核量为主要影响因素,结合Box-Behnken法,设计试验方案,并对所得数据进行响应面分析,中心试验重复3次。响应面试验因素与水平设计见表2。

表2 响应面试验因素与水平
1.2.9 数据处理
1.2.9.1 单因素试验结果的数据处理
借助SPSS V18.0来处理单因素的试验数据,确定影响固定化生姜蛋白酶活力的各因素的大小关系,根据单因素试验的方差分析表,选出显著性最大的3个因素。
1.2.9.2 响应面试验结果的数据处理
结合Box-Behnken对试验结果进行分析处理,可得出响应面方案表,二次回归模型,回归方程的方差分析结果。
2 结果与分析
2.1 酪氨酸标准曲线

图1 酪氨酸标准曲线
由图1可知,酪氨酸标准曲线R2=0.9995,说明线性关系很好。
2.2 单因素试验结果与分析
按照1.2.5的实验方法,分别测出在不同Fe2+∶Fe3+体积比、海藻酸钠与明胶体积比、固定化pH、戊二醛浓度、Fe3O4磁核量、固定时间、酶量、交联时间8个因素不同指标下OD680的吸光值,并将各因素条件下最高酶活力作为100%,换算为生姜蛋白酶的相对酶活力。
2.2.1 不同Fe2+∶Fe3+体积比对固定化酶制备的影响

图2 不同Fe2+∶Fe3+体积比对固定化酶制备的影响
由图2可知,当Fe2+∶Fe3+的体积比为0.75∶1时,所制备的固定化酶相对酶活力较高;之后随Fe2+的浓度升高,相对酶活力逐渐减小。
2.2.2 海藻酸钠与明胶体积比对固定化酶制备的影响

表3 不同体积比的海藻酸钠与明胶对固定化酶的影响
由表3可知,海藻酸钠与明胶体积比对形成的微球有重要影响,当两者体积比低于2.0∶1.0时,用注射器制作的海藻酸钠凝胶会形成明显的拖尾现象,海藻酸钠凝胶微球不成形,洗涤时酶易被冲洗掉,使测得的酶活力降低,由图3可知,海藻酸钠与明胶体积比在2.0∶1.0时相对酶活力最高,当两者体积比高于2.0∶1.0时,用注射器制作凝胶微球很困难,经固定化后的酶不易释放酶活。

图3 海藻酸钠浓度对酶活力的影响
2.2.3 戊二醛浓度对酶活力的影响

图4 戊二醛浓度对酶活力的影响
由图4可知,戊二醛的浓度为3%时,固定化酶的相对酶活力达到最高值。
2.2.4 交联时间对酶活力的影响

图5 交联时间对酶活力的影响
由图5可知,交联时间为1.5 h时,相对酶活力最高。
2.2.5 固定时间对酶活力的影响

图6 固定时间对酶活力的影响
由图6可知,固定时间为60 min时,相对酶活力最高。
2.2.6 pH对酶活力的影响

图7 pH对酶活力的影响
由图7可知,当固定化体系pH 4.4时,固定化生姜蛋白酶相对酶活力最高。分析认为酶蛋白质中的-NH2与戊二醛的醛基之间的加成反应,需要在酸性环境中进行。
2.2.7 Fe3O4磁核量对酶活力的影响

图8 Fe3O4磁核量对酶活力的影响
由图8可知,当Fe3O4磁核量为3.0 mg/mL时,固定化酶相对酶活力最高。
2.2.8 酶量对酶活力的影响

图9 酶量对酶活力的影响
由图9可知,1 g微球载体固定30 mg酶量时,相对酶活力最高。1 g微球载体固定的酶量<30 mg时,随酶量的增加,固定化酶相对酶活力逐步上升;酶量超过30 mg时,固定化酶相对酶活力随其增加呈下降趋势。
2.2.9 单因素试验方差分析表

表4 单因素试验的方差分析
由表4可知,借助SPSS处理单因素的试验数据,得出固定化生姜蛋白酶活力的影响因素大小关系为戊二醛浓度>Fe3O4磁核量>海藻酸钠和明胶体积比>Fe2+∶Fe3+体积比>固定时间>交联时间>酶量>pH。其中海藻酸钠浓度、戊二醛浓度、Fe3O4磁核量3个因素的P值是影响固定化生姜蛋白酶的主要因素,Fe2+∶Fe3+体积比影响不显著,酶量、固定时间、交联时间和pH影响的显著性比海藻酸钠浓度、戊二醛浓度、Fe3O4磁核量弱。下面应用响应面进行最优分析时,设定Fe2+∶Fe3+体积比为0.75∶1,交联时间为1.5 h,固定时间为60 min,pH值为4.4,酶量为30 mg/g进行工艺优化。
2.3 响应面试验结果
响应面试验方案及结果见表5。

表5 响应面试验方案及结果
用Design-Expert软件对试验结果进行拟合,以固定化生姜蛋白酶酶活力Y为响应值,对自变量海藻酸钠浓度、戊二醛浓度、Fe3O4磁核量3个因素的回归方程为:
Y=50.2-0.12A+1.51B+1.11C+0.44AB-1.44AC-1.80A2-2.66B2-1.09C2。
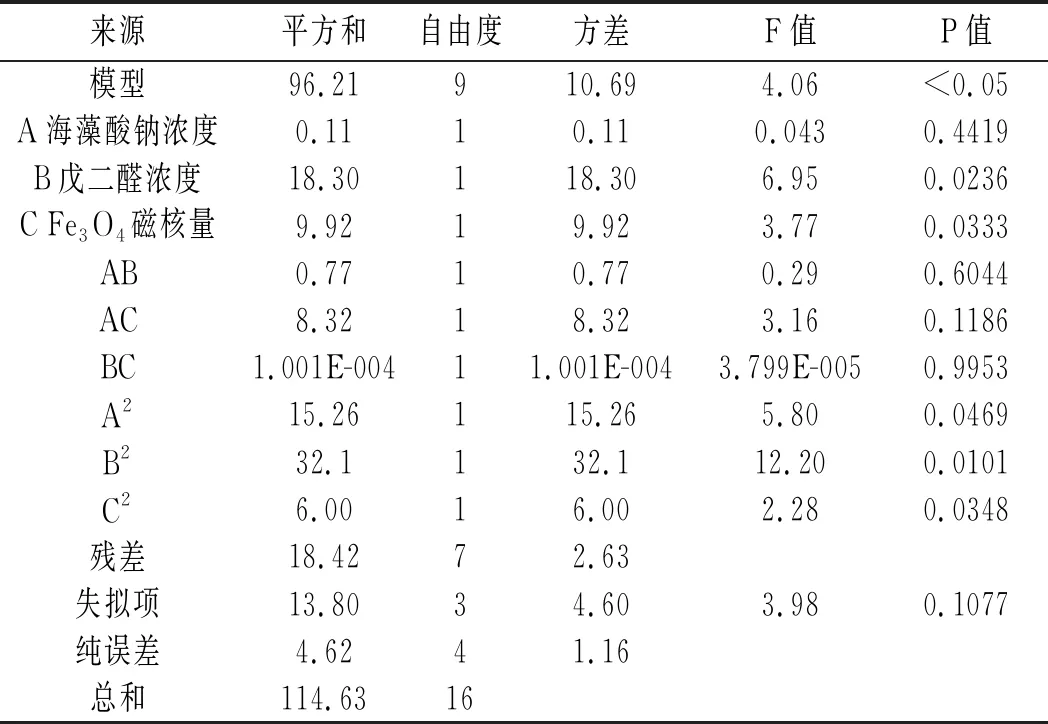
表6 回归方程的方差分析
注:P<0.05表示差异显著;P<0.01表示差异极显著。
由表6可知,模型P值<0.05,说明该模型显著;失拟项P值>0.05,说明该回归拟合的情况良好,可以用其进行固定化酶活力的预测和分析。对于回归方程各项的方差分析结果表明,方程的一次项B,C及二次项A2、B2和C2的P值均小于0.05,显著;而交互项AB、AC、BC不显著,说明此方程的拟合较充分。故各因素对固定化酶活力的影响依次为:戊二醛浓度>Fe3O4磁核量>海藻酸钠浓度,与SPSS分析结果一致。
去除不显著的交互项AB、AC、BC,对表6进行二次多元回归拟合,得到固定化酶活力对3个因素的二次多项回归方程:
Y=50.2-0.12A+1.51B+1.11C+0.44AB-1.44AC-1.80A2-2.66B2-1.09C2。
经优化后,模型极显著,失拟项不显著,决定系数R2为0.9929,调整系数RAdj2为0.9892,预测系数RPred2为0.9699,说明测定值与模型预测值之间具有良好的相关度[11]。调整系数和预测系数值高且接近(RAdj2-RPred2<0.2),则回归模型能充分说明工艺过程。
2.4 响应面分析
响应面图形分析可以直观地反映出各因素之间的交互作用对响应值的影响[12],3个因素各交互作用影响的响应面图和等高线图见图10~图15,响应面图是三维空间立体图,各试验因素对响应值的影响不是简单的线性关系,各因素之间的交互作用对响应值的影响与响应面的陡峭程度成正比,即交互作用对响应值影响越强,曲面越陡峭,反之则平缓[13],其曲面的最高区域存在最大值[14],即实验结果y在试验区域内具有最大极值。通过回归模型预测,给出固定化生姜蛋白酶的最佳工艺条件为Fe2+∶Fe3+体积比为0.75∶1、磁核量Fe3O4为3.0 mg/mL,海藻酸钠与明胶体积比为2∶1,戊二醛浓度为3%,交联时间为1.5 h,固定时间为60 min,pH值为4.4,酶量为30 mg/g,在此条件下酶活力的预测值为50.39 U/g。

图10 海藻酸钠浓度和Fe3O4磁核量交互作用的响应面图

图11 海藻酸钠浓度和Fe3O4磁核量交互作用的等高线图

图12 海藻酸钠浓度和戊二醛浓度交互作用的响应面图

图13 海藻酸钠浓度和戊二醛浓度交互作用的等高线图

图14 Fe3O4磁核量和戊二醛浓度交互作用的响应面图

图15 Fe3O4磁核量和戊二醛浓度交互作用的等高线图
2.5 最佳固定条件的验证
单因素试验结果与响应面试验结果相结合,并通过响应面软件分析得出回归模型预测数值,得出固定化生姜蛋白酶的最佳工艺条件:Fe2+∶Fe3+体积比为0.75∶1,磁核量Fe3O4为3.0 mg/mL,海藻酸钠与明胶体积比为2∶1,戊二醛浓度为3%,交联时间为1.5 h,固定时间为60 min,pH值为4.4,酶量为30 mg/g,在此条件下酶活力的预测值为50.39 U/g。并以此条件进行3 次平行验证实验,固定化生姜蛋白酶的酶活力均值为52.63 U/g,误差值很小,与预测值接近,证明了此模型的合理性。
3 结论
通过单因素试验结合Box-Behnken响应面分析法进行优化后,得到的磁性复合载体固定生姜蛋白酶的最佳工艺条件为:Fe2+∶Fe3+体积比为0.75∶1、磁核量Fe3O4为3.0 mg/mL、海藻酸钠与明胶体积比为2∶1、戊二醛浓度3%、交联时间1.5 h、固定时间60 min,pH值4.4、酶量30 mg/g。在此条件下,得到固定化生姜蛋白酶的酶活力为52.63 U/g,高于传统固定制备法所得到的固定化酶酶活,且具有比游离酶良好的稳定性。由此可见,磁性载体固定生姜蛋白酶是一种高效可行的固定化方法。

