人参皂苷Rh2对慢性不可预知应激所致抑郁小鼠的治疗作用及机制研究
方玲 杨莉莉
抑郁症是一种常见的情感精神障碍,严重患者可出现自杀念头。随着生活节奏的加快,人们工作和生活压力的增加,抑郁症发病率呈逐年上升趋势[1-2]。目前关于抑郁症的发病机制尚未十分清楚,有研究认为慢性应激与抑郁症的发生关系密切。海马在学习记忆、情绪、行为等调节中具有重要作用,是应激反应的调节中枢;而慢性应激易损伤海马组织并引起海马结构功能发生变化[3]。神经炎症在抑郁症的发生过程中也发挥着重要作用,抑郁症患者神经炎症因子水平往往升高[4]。目前抑郁症的治疗手段主要有抗抑郁药物治疗、物理治疗、心理治疗、中医治疗等,其中抗抑郁药物治疗是最主要的方法,但存在药物价格昂贵、患者易复发、不良反应较为严重、靶点单一、依从性差等问题[5-6]。人参皂苷Rh2是从人参中分离出来的单体,其药理作用广泛,在治疗恶性肿瘤、子宫内膜异位症、哮喘以及改善心肌缺血、调节免疫功能、抗过敏、抗辐射、抗抑郁等方面都有一定作用[7-11]。本研究通过建立抑郁小鼠模型来观察人参皂苷Rh2对小鼠抑郁行为、神经元发生及神经炎症的影响,并探讨人参皂苷Rh2治疗抑郁症的可能机制。
1 材料和方法
1.1 动物和试剂 健康、清洁级、雄性、22~26g、10~12周龄、C57BL/6J的小鼠100只,购自上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2012-0002。人参皂苷Rh2(上海顺博生物工程有限公司);PCR试剂盒、BCA蛋白浓度测定试剂盒、蛋白裂解液、SP检测试剂盒、RNA提取试剂盒等(美国 Gibco公司);NF-κB p65、TNF-α、IL-1β(上海生工生物有限公司合成);Trizol试剂、多聚甲醛、结晶紫溶液、山羊血清、一抗、二抗等(美国Sigma公司)。
1.2 动物分组与处理 将100只小鼠随机分为对照组、模型组、Rh2低剂量组、Rh2中剂量组、Rh2高剂量组,每组20只。模型组、Rh2低剂量组、Rh2中剂量组、Rh2高剂量组小鼠建立慢性应激所致抑郁模型,应激源包括2次5min游泳、2次6h饮水剥夺、1次30min悬尾、2次彻夜光照、3次10min闪光、1次17h湿笼、1次17h空笼无垫料、1次17h合笼、2次14h食物剥夺、1次2h合笼,以不可预知方式随机组合实施,每天实施2种应激源,持续10周;对照组小鼠不给予应激。从应激处理第3周开始,Rh2低、中、高剂量组小鼠分别给予5、10、40mg/(kg·d)的人参皂苷Rh2(溶于0.2ml蒸馏水中)灌胃,1次/d;对照组、模型组小鼠每天给予等量蒸馏水灌胃。
1.3 小鼠悬尾不动、强迫游泳不动时间百分比测定第10周应激处理结束后,测定小鼠悬尾不动、强迫游泳不动时间百分比。(1)悬尾测试实验:固定小鼠远端尾部1.5cm处,鼠头向下、距离地面35cm悬挂,测定360s内小鼠悬挂时静止不动的时间百分比。(2)强迫游泳实验:在直径25cm、高30cm透明玻璃水缸中注入15cm高的水,将小鼠放入水中,水温21~25℃,记录360s内小鼠轻微肢体活动或漂浮不动的时间百分比。
1.4 标本采集 悬尾测试、强迫游泳实验结束后,每组取10只小鼠,用戊巴比妥钠麻醉后打开小鼠腹腔、暴露心脏,200ml PBS灌流,多聚甲醛灌流固定;断头取脑、分离脑组织,多聚甲醛固定,石蜡包埋,切片,取4μm冠状脑组织切片用于免疫组化染色。每组剩余10只小鼠快速断头处死,冰上分离海马组织,液氮中速冻,用于RT-PCR和Western blot实验。
1.5 小鼠海马区5-溴脱氧尿嘧啶核苷(BrdU)和神经元核抗原(NeuN)表达情况检测 采用免疫组化染色法。(1)BrdU表达检测:小鼠脑组织切片用PBS洗涤,HCl孵育30min;硼酸缓冲液洗涤,PBS洗涤,H2O2孵育10min;PBS洗涤,山羊血清封闭45min。加入小鼠抗BrdU抗体过夜孵育;PBS洗涤,加入抗小鼠二抗孵育。阴性对照以PBS代替一抗,PBS洗涤,DAB显色,脱水、透明、封固。采用体视学方法分析BrdU免疫组化染色结果,观察并统计BrdU阳性细胞数。(2)NeuN表达检测:小鼠脑组织切片用PBS洗涤,加入Tritonx-100孵育30min;PBS 洗涤,H2O2室温孵育 10min;PBS 洗涤,山羊血清封闭45min。加入小鼠抗NeuN抗体过夜孵育;PBS洗涤,加入抗小鼠二抗。阴性对照以PBS代替一抗,PBS洗涤,DAB显色,脱水、透明、封固。采用Carl Zeiss Axio Vision Rel.4.6图像分析系统分析NeuN免疫组化染色图像,NeuN表达量以灰度值表示,灰度值越大表示NeuN表达量越少。
1.6 小鼠海马区 NF-κB p65、TNF-α、IL-1β mRNA 表达水平测定 采用RT-PCR法。取约100mg小鼠海马组织,加入裂解液,匀浆器匀浆后提取总RNA;取1μg RNA反转录获得海马组织cDNA,以cDNA为模板进行PCR,以β-actin为内参照,反应条件:94℃ 5min;94℃30s、55℃ 30s、72℃ 30s,共 40 个循环;72℃ 10min。NF-κB p65、TNF-α、IL-1β mRNA 相对表达量以 2-ΔΔCT表示。
1.7 小鼠海马区 NF-κB p65、TNF-α、IL-1β 蛋白表达水平测定 采用Western blot法。取小鼠海马组织50mg,加入裂解液提取海马组织总蛋白,BCA法测定海马组织总蛋白浓度。制备电泳凝胶,每孔加入10μl上样液进行电泳分离,将得到的目的蛋白转移至PVDF膜上,脱脂奶粉封闭,加入 NF-κB p65 抗体(1∶1 000 稀释)、TNF-α 抗体(1∶200稀释)、IL-1β 抗体(1∶200稀释)、β-actin抗体(1∶5 000稀释)过夜孵育,加入二抗(1∶5 000稀释)孵育2h。采用Tanon-4200凝胶成像系统对结果进行分析,NF-κB p65、TNF-α、IL-1β 蛋白表达水平以 NF-κB p65、TNF-α、IL-1β 条带吸光度值/β-actin条带吸光度值的比值表示。
1.8 统计学处理 应用SPSS 20.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 5组小鼠悬尾不动、强迫游泳不动时间百分比比较5组小鼠悬尾不动、强迫游泳不动时间百分比比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组小鼠悬尾不动、强迫游泳不动时间百分比均明显增加(均P<0.05);与模型组比较,Rh2中、高剂量组小鼠悬尾不动、强迫游泳不动时间百分比均明显降低(均P<0.05),而Rh2低剂量组有所降低但差异均无统计学意义(均P>0.05),见表 1。
2.2 5组小鼠海马区BrdU和NeuN表达情况比较 免疫组化染色显示,BrdU阳性细胞散在或成簇分布在齿状回颗粒下区,呈梭形或圆形,见图1;NeuN阳性细胞广泛密集分布在海马区,见图2。5组小鼠海马区BrdU阳性细胞数和NeuN灰度值比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组小鼠海马区BrdU阳性细胞数明显减少(P<0.05),NeuN灰度值明显升高(P<0.05);与模型组比较,Rh2中、高剂量组小鼠海马区BrdU阳性细胞数均明显增加(均P<0.05),NeuN灰度值均明显降低(均P<0.05),而Rh2低剂量组小鼠海马区BrdU阳性细胞数和NeuN灰度值变化均不明显(均P>0.05),见表2。

图1 5组小鼠海马区BrdU免疫组化染色所见(a:对照组;b:模型组;c:Rh2低剂量组;d:Rh2中剂量组;e:Rh2高剂量组;×200)
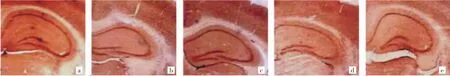
图2 5组小鼠海马区NeuN免疫组化染色所见(a:对照组;b:模型组;c:Rh2低剂量组;d:Rh2中剂量组;e:Rh2高剂量组;×25)
2.3 5 组小鼠海马区 NF-κB p65、TNF-α、IL-1β mRNA表达水平比较 5组小鼠海马区NF-κB p65、TNF-α、IL-1βmRNA表达水平比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组小鼠海马区NF-κB p65、TNF-α、IL-1β mRNA表达水平均明显升高(均P<0.05);与模型组比较,Rh2中、高剂量组小鼠海马区NF-κB p65、TNF-α、IL-1β mRNA 表达水平均明显降低(均P<0.05),而Rh2低剂量组有所降低但差异均无统计学意义(均P>0.05),见表3。
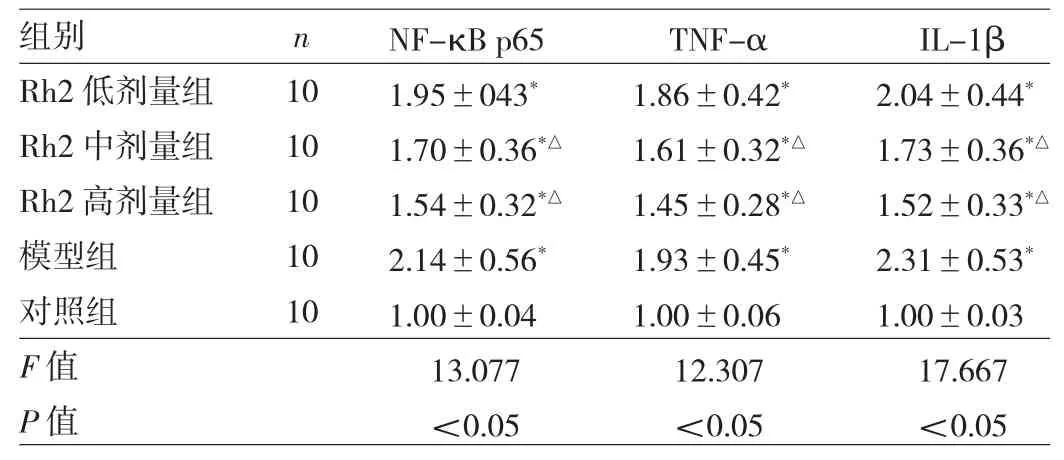
表 3 5 组小鼠海马区 N F-κB p65、T N F-α、I L-1β m R NA表达水平比较
2.4 5 组小鼠海马区 NF-κB p65、TNF-α、IL-1β 蛋白表达水平比较 5组小鼠海马区NF-κB p65、TNF-α、IL-1β蛋白表达水平比较,差异均有统计学意义(均P<0.05)。与对照组比较,模型组小鼠海马区NF-κB p65、TNF-α、IL-1β蛋白表达水平均明显升高(均P<0.05);与模型组比较,Rh2中、高剂量组小鼠海马区NF-κB p65、TNF-α、IL-1β蛋白表达水平均明显降低(均P<0.05),Rh2低剂量组有所降低但差异均无统计学意义(均P>0.05),见图3和表4。
3 讨论
有研究发现人参皂苷Rh2可改善结肠癌模型小鼠的抑郁行为,降低抑郁相关细胞因子水平,同时认为人参皂苷Rh2可能通过降低抑郁相关细胞因子水平来发挥抗抑郁作用[12]。本文通过慢性不可预知应激建立抑郁小鼠模型并给予人参皂苷Rh2治疗,结果发现人参皂苷Rh2中、高剂量均可有效改善抑郁小鼠的悬尾不动和强迫游泳不动时间百分比,笔者认为人参皂苷Rh2能抑制小鼠的抑郁行为,且可能呈剂量依赖性。

图 3 5组小鼠海马区N F-κB p65、T N F-α、I L-1β蛋白表达的电泳图(a:对照组;b:模型组;c:R h2 低剂量组;d:R h2 中剂量组;e:R h2高剂量组)
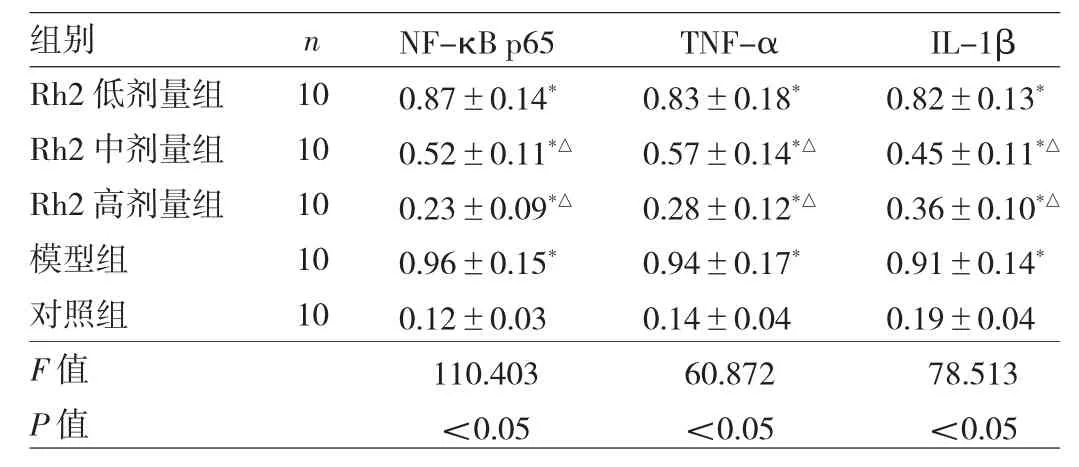
表 4 5 组小鼠海马区 N F-κB p65、T N F-α、I L-1β蛋白表达水平比较
成年动物的海马组织每天会生成大量新神经元,而海马齿状回终生具有生成新神经元的能力。齿状回是海马组织的重要信息传入通路,齿状回新生的神经元对学习记忆功能具有重要作用。成年动物的海马神经干细胞分布在海马齿状回颗粒细胞及亚颗粒区的最内层,海马神经干细胞产生的新生细胞可以分化为神经元。近年来研究发现,神经发生障碍与抑郁症的发病关系密切,是抑郁症的发病基础之一,抗抑郁药可通过增加海马区神经发生来发挥抗抑郁的作用[13]。NeuN在成熟神经元中特异表达,而BrdU在细胞中永久存在,可用于标记处于DNA合成器的齿状回先祖细胞,NeuN和BrdU标记的阳性神经元变化可反映神经细胞增殖和分化情况[14-15]。本研究结果发现,抑郁模型小鼠海马区NeuN表达下降(NeuN灰度值升高)、BrdU阳性细胞数减少,表明抑郁可引起小鼠海马神经元损伤及神经发生减少;而人参皂苷Rh2中、高剂量治疗可增加抑郁小鼠海马区NeuN表达及BrdU阳性细胞数。分析原因,笔者认为人参皂苷Rh2可能通过促进抑郁症小鼠海马神经元成熟和神经发生、恢复海马组织的结构和功能来发挥抗抑郁作用。
细胞因子对应激反应、免疫反应、炎症反应等具有调节作用,抑郁症患者的生理和心理应答与细胞因子的中枢效应关系密切,多种炎症介质及细胞因子等活性分子水平的改变与抑郁症的发生有关。在抑郁症的发生过程中,抑郁、焦虑等负面情绪可引起下丘脑、垂体、肾上腺轴负反馈失调,引起机体免疫功能异常[16]。NF-κB蛋白家族在中枢神经系统中广泛分布,NF-κB为早期转录因子,参与包括TNF-α、IL-1β等多种炎症因子的生成。脑内TNF-α、IL-1β等一系列炎症细胞因子水平增加,可引起神经细胞损伤[17-19]。本研究结果发现,抑郁模型小鼠海马组织 NF-κB p65、TNF-α、IL-1β 水平升高。慢性应激能激活海马组织NF-κB,增加NF-κB表达水平,而NF-κB水平升高又进一步上调TNF-α、IL-1β等炎症细胞因子水平,从而引起海马神经元损伤;而人参皂苷 Rh2治疗可降低海马组织 NF-κB、TNF-α、IL-1β水平。故笔者认为,人参皂苷Rh2对抑郁症的治疗作用可能与人参皂苷Rh2抑制NF-κB信号通路,降低海马组织TNF-α、IL-1β水平有关。
综上所述,人参皂苷Rh2对抑郁症小鼠具有治疗作用,其作用机制可能是人参皂苷Rh2可促进海马神经元成熟和神经发生,并通过抑制NF-κB信号通路降低海马组织炎性反应来发挥抗抑郁作用。

