黄精多糖的提纯、硫酸化和羧甲基化修饰及其抗氧化活性研究
张遥遥,张 梦,胡 悦,任建武
(北京林业大学,生物科学与技术学院,北京 100083)
黄精(Polygonatumsibiricum,PS)是我国传统中草药,且药食两用。黄精性平、味甘,具有滋阴润肺、健脾之功效[1],包含多糖、皂苷、黄酮、醌类、生物碱、木质素和人体必需氨基酸等有效成分[2]。多糖是黄精主要活性成分之一,研究发现黄精多糖有调节免疫力[3-4]、抗肿瘤[5-6]、降脂降糖[7]、抗炎抑菌[8]等功效。
多糖结构修饰是引入官能团、提高多糖生物活性甚至使其产生新活性的有效手段,常见的化学修饰方法包括六种:硫酸化、磷酸化、乙酰化、烷基化、磺酰化和羧甲基化[9]。多糖的结构修饰已在黑木耳多糖[10]、银耳多糖[11]、茶多糖[12]、青钱线柳多糖[13]等中得到研究,但关于黄精多糖结构修饰的研究很少,梁引库等[14]采用三种方法制备硫酸酯化黄精多糖,修饰前后均具有较好的抗氧化活性;Khamphone等[15]得到取代度分别为0.50、0.94和1.90的三种硫酸化衍生物,并证实硫酸化黄精多糖有助于激活自然杀伤细胞。现有研究主要是黄精多糖硫酸化修饰,未见羧甲基修饰的相关报道。本文对黄精多糖进行硫酸化及羧甲基化两种结构修饰,并对比修饰前后抗氧化活性的变化,以期为多糖构效关系的进一步研究提供思路,并为开发潜在功能性食品提供科学依据。
1 材料与方法
1.1 材料与仪器
黄精 采自北京怀柔区,2017年10月;DEAE纤维素、葡聚糖凝胶Sephadex G-200 上海源叶生物科技有限公司;葡萄糖、无水乙醇、三氯乙酸、浓盐酸、浓硫酸、硫酸铵、氯乙酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠、DPPH、ABTS、过硫酸钾、铁氰化钾、无水氯化铁、水杨酸、七水合硫酸亚铁、双氧水 以上均为分析纯,国药集团北京化学试剂公司。
TL-650Y型超声波细胞粉碎机 江苏天翎仪器有限公司;新世纪T6紫外分光光度计 北京普析通用仪器有限公司;TGL16M台式高速低温冷冻离心机 上海赫田科学仪器有限公司;DTQC-10A水浴恒温振荡器 北京普析通用仪器有限公司;85-2数显恒温磁力搅拌器 金坛市华城润华实验仪器厂;Spectrum400红外光谱仪 美国PERKIN ELMER公司;R-210旋转蒸发仪 瑞士步琪公司;FA2004型分析天平 上海上平仪器有限公司;DZF真空干燥箱 上海龙跃仪器设备有限公司;BS-100A自动部分收集器 上海沪西分析仪器厂;DHG-9033B5电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;800Y小型粉碎机 永康市铂欧五金制品有限公司;LGJ-10N普通型真空冻干机 北京亚星仪科科技发展有限公司;L100-1S-1型恒流泵 兰格恒流泵有限公司;Shodex SB-806M示差折光检测器 北京京京时代科技发展有限公司。
1.2 实验方法
1.2.1 黄精多糖的提取 参照骆文灿[16]的方法,取筛选后鲜黄精,清洗去须切片,于40 ℃电热恒温鼓风干燥箱中干燥12 h,粉碎后过60目筛,粉末常温干燥保存。取200 g黄精粉,按20∶1 (mL/g)的液料比加入蒸馏水800.0 mL,设定超声功率180 W,超声时间60 min进行超声提取,然后40 ℃水浴15 min。以8000 r/min的转速离心10 min,取上清液经三氯乙酸法脱蛋白得洗脱液,60 ℃旋蒸至一定体积,加五倍体积无水乙醇在4 ℃冰箱醇沉14 h,经8000 r/min离心后得到多糖沉淀,真空冻干,得到粗多糖粉末。
1.2.2 多糖含量测定 参照2015年版《中国药典》,采用苯酚-硫酸法。即以葡萄糖为标准样品,配制90 μg/mL溶液。分别在6支试管中加入葡萄糖标液(0、0.2、0.4、0.6、0.8、1.0 mL),加水到1.0 mL,分别向其中加入1.0 mL苯酚溶液(5%,W/V),5.0 mL浓硫酸,使总体积为7.0 mL,摇匀后沸水浴20 min,然后立即冰浴5 min,在488 nm处测定吸光值,绘制标准曲线。
1.2.3 黄精多糖的纯化
1.2.3.1 DEAE-52纤维素柱层析 填料进行预处理、装柱后,称取黄精粗多糖粉末500 mg溶于10.0 mL蒸馏水中,离心(8000 r/min)除不溶物,过0.45 μm滤膜得到上清液,用吸管缓慢上样。分别以两倍柱体积的蒸馏水、0.2和0.5 mol/L NaCl洗脱液进行洗脱。恒流泵调节流速为1.0 mL/min,自动收集器收集流出液,每管10.0 mL。苯酚-硫酸法跟踪检测每管糖含量,收集单峰对应的管内溶液,浓缩冻干。重复蒸馏水洗脱操作,富集得率最高的蒸馏水洗脱部分PSP1,按1.2.1方法浓缩、醇沉、离心、冻干,进行下一步纯化。
1.2.3.2 葡聚糖凝胶层析 取经过DEAE-52分离后的多糖100 mg,溶于2.0 mL蒸馏水中,以脱气后蒸馏水作为洗脱液上样洗脱。恒流泵调节流速为1.0 mL/min,自动收集器每管收集10.0 mL,苯酚-硫酸法跟踪检测每管糖含量,收集单峰对应的管内溶液,浓缩冻干,得到纯化多糖(PSP1-A),重复蒸馏水洗脱操作,富集多糖。并于室温放入以五氧化二磷为干燥剂的干燥器中保存。
1.2.4 黄精多糖纯度鉴定
1.2.4.1 PSP1-A的紫外全波长扫描分析 取10 mg PSP1粉末,加蒸馏水制备成1.00 mg/mL溶液。取适量溶液于190~900 nm范围内进行紫外全波长扫描,蒸馏水调零,绘制紫外全波长扫描图。
1.2.4.2 PSP1-A的分子量测定 采用高效凝胶渗透色谱法测定纯化多糖的分子量。流动相:NaCl、Na2HPO4水溶液;Mw测量范围:500~109 Daltons;柱温:25 ℃;流速:0.8 mL/min;色谱柱:SB-802.5HQ;检测器:Shodex SB-806M示差折光检测器;进样量:100 μL。
以去离子水为溶剂,真空抽滤处理对去离子水进行过滤和脱气。以处理后的溶剂配制待测样品溶液。取10 mg多糖PSP1,加水使待测液浓度为2.00 mg/mL,在室温下静止过夜,使粉末充分溶解,可轻微摇动样品以促进溶解但不可剧烈摇动。样品溶解后,采用一次性微孔滤膜(孔径0.2 μm)对样品溶液进行过滤,取过滤后样品注入凝胶色谱柱中,根据ParSEC Chromatography Software软件计算相对分子量。
1.2.5 黄精多糖的硫酸化修饰 参照梁引库等[14]的研究,量取4.0 mL正丁醇置于冰浴锥形瓶中,加入磁石磁力搅拌,向其中缓慢加入浓硫酸12.0 mL,搅拌5 min后加入300 mg硫酸铵。搅拌10 min混匀后向其中加入800 mg 纯化多糖,并搅拌反应30 min。反应结束后立即以2.5 mol/L NaOH溶液调至pH为7.0,4000 r/min离心15 min,取上清用蒸馏水透析3 d,每4 h换一次水。透析后溶液浓缩,五倍无水乙醇醇沉,8000 r/min离心后收集沉淀,真空冷冻干燥,得到硫酸化多糖(SPSP1-A)。
1.2.6 黄精多糖的羧甲基化修饰 参照Machová等[17]的研究,精确称取纯化多糖500 mg,使其充分溶解于38.0 mL质量分数为20%的NaOH溶液中,30 ℃恒温振荡搅拌60 mim。向反应体系中加入6%氯乙酸(W/V,无水乙醇溶解)50.0 mL,充分搅拌均匀后,55 ℃恒温水浴振荡器中反应5 h。冷却至室温后以2.0 mol/L HCl调节溶液pH至中性,透析袋透析3 d(每4 h换一次蒸馏水),浓缩醇沉,真空冷冻干燥,得到羧甲基化多糖(CPSP1-A)。
1.2.7 取代度的测定
1.2.7.1 硫酸基取代度(DS)的测定 采用氯化钡-明胶比浊法[18]测定硫酸基的取代度。硫酸基标准曲线 称取2 g明胶加400.0 mL蒸馏水溶解,于4 ℃冰箱中静置12 h得到明胶溶液(Ⅰ)。称取1 g氯化钡溶解于200.0 mL明胶溶液中得到氯化钡-明胶溶液(Ⅱ),4 ℃保存备用。称取60 mg硫酸钾,以1.0 mol/L盐酸溶液定容至100.0 mL得到硫酸钾标准液(0.60 mg/mL)。分别用移液枪吸取20、60、100、140、180、200 μL标准液于6支试管中,加1.0 mol/L盐酸溶液补至200 μL(200 μL盐酸溶液为空白对照),再加入3.8 mL 8%的三氯乙酸溶液(W/V,蒸馏水溶解),摇匀后加入1.0 mL Ⅱ液,充分混匀室温下静置20 min,360 nm处测得吸光值A1。将Ⅱ液换为Ⅰ液重复上述操作,测得吸光值A2。以硫酸根浓度为横坐标,A1-A2差值为纵坐标绘制标准曲线。
1.2.7.2 SPSP取代度测定 取10 mg SPSP粉末于试管中,加入1.0 mL 1.0 mol/L盐酸溶液并于沸水浴中反应5 h,按照标准曲线中的方法测定硫酸基取代度,并按以下公式计算:
式中:S为SPSP1-A中硫酸根离子含量,%;C为SPSP1-A溶液浓度,mg/mL;V为SPSP1-A溶液体积,mL;W为SPSP1-A粉末质量,mg。
1.2.7.3 羧甲基化取代度的测定 根据Wang等[19]的方法,称取CPSP粉末50 mg置于烧杯中,加入0.1 mol/L盐酸溶液2.0 mL,并搅拌混匀,使多糖完全溶解,再用0.1 mol/L的NaOH溶液进行滴定,根据pH达到2.1和4.3时所需碱液体积V1、V2,按以下公式计算取代度,公式如下:
式中:M为CPSP1-A质量,g;C为NaOH浓度,mol/L。
1.2.8 红外光谱分析 分别取PSP1-A、SPSP1-A、CPSP1-A粉末各10 mg,鼓风干燥箱中40 ℃烘干24 h,将样品粉末与适量溴化钾晶体混合,在玛瑙研钵中研磨均匀,压成1 mm薄片,使用红外光谱仪测定4000~400 cm-1波段样品的红外吸收。
1.2.9 抗氧化活性测定
1.2.9.1 清除DPPH自由基能力 根据Eskandari等[20]的方法稍作改动,取5支洁净试管,依次向其中加入1.0×10-4mol/L的DPPH-乙醇溶液2.0 mL,0.2 mol/L pH=7.0的磷酸盐缓冲液1.0 mL,待测样品(2.00、4.00、6.00、8.00、10.00 mg/mL)2.0 mL。混匀后室温下避光处反应30 min,在517 nm处测得反应后吸光值A1,以无水乙醇代替DPPH得到吸光值A2,以蒸馏水代替多糖样品溶液得到吸光值A0,并以稀释100倍的VC溶液(0.02、0.04、0.06、0.08、0.10 mg/mL)作阳性对照。
DPPH自由基清除率计算公式:
式中:A1为不同浓度样品(PSP1-A、SPSP1-A、CPSP1-A、VC)溶液的吸光值;A2为无水乙醇代替DPPH的参比对照吸光值;A0为蒸馏水代替样品的空白对照吸光值。
1.2.9.2 清除ABTS自由基能力 根据Wootton-Beard等[21]的实验方法稍作改动,取10.0 mL ABTS溶液(7.0 mmol/L)与10.0 mL过硫酸钾溶液(15.0 mmol/L)混匀,在4 ℃冰箱中避光反应16 h,实验前用pH=7.4的磷酸盐缓冲液进行稀释,使反应液的吸光值在734 nm处达到0.70±0.02,得到ABTS工作液。取5支洁净试管,依次向其中加入ABTS工作液2.0 mL,待测样品(2.00、4.00、6.00、8.00、10.00 mg/mL)0.2 mL,混合均匀,室温下避光反应20 min,测定734 nm处吸光值A1,以蒸馏水代替多糖样品得到吸光值A0,并以稀释100倍的VC溶液(0.02、0.04、0.06、0.08、0.10 mg/mL)作阳性对照。
ABTS自由基清除率计算公式:
式中:A1为不同浓度样品(PSP1-A、SPSP1-A、CPSP1-A、VC)溶液的反应后吸光值;A0为蒸馏水空白组吸光值。
1.2.9.3 清除羟基自由基能力 采用水杨酸比色法,根据侯令[22]的研究稍作改动,取5支洁净试管,依次向其中加入9.0 mmol/L水杨酸-乙醇溶液0.5 mL,待测样品(2.00、4.00、6.00、8.00、10.00 mg/mL)2.0 mL,9.0 mmol/L硫酸亚铁溶液0.5 mL,蒸馏水6.5 mL,最后加入8.8 mmol/L H2O2溶液0.5 mL,在37 ℃恒温水浴锅中水浴反应30 min,测定510 nm处吸光值A1,以蒸馏水代替硫酸亚铁溶液得到吸光值A2,取蒸馏水代替样品测得吸光值A3,并以稀释100倍的VC溶液(0.02、0.04、0.06、0.08、0.10 mg/mL)作阳性对照。
羟基自由基清除率计算公式:
式中:A1为不同浓度样品(PSP1-A、SPSP1-A、CPSP1-A、VC)溶液的反应后吸光值;A2为蒸馏水取代亚铁离子的吸光值;A3为蒸馏水空白组吸光值。
1.2.9.4 总还原力 参照张荣华[23]的研究稍作调整,取5支洁净试管,依次向其中加入1%铁氰化钾溶液(W/V)1.0 mL,pH=6.6的磷酸盐缓冲液1.0 mL,待测样品(2.00、4.00、6.00、8.00、10.00 mg/mL)1.0 mL,混匀后于恒温水浴锅中50 ℃保温20 min。再向反应液中加入10%三氯乙酸溶液(W/V)1.0 mL,混匀后4000 r/min离心10 min去除沉淀,取上清液2.0 mL,再依次加入蒸馏水1.0 mL,0.1%氯化铁溶液(W/V)0.4 mL,室温下反应10 min后于700 nm处测定反应液吸光值。以稀释100倍的VC溶液(0.02、0.04、0.06、0.08、0.10 mg/mL)作阳性对照。
1.3 数据处理
体外抗氧化实验重复3次以去除实验误差,数据处理运用Origin Pro 8.0及SPSS 19.0软件进行。
2 结果与分析
2.1 黄精多糖含量
采用苯酚-硫酸法测得葡萄糖标准曲线图(图1),线性回归方程为y=0.0643x+0.0041,R2=0.9978,测得黄精的多糖含量为(18.65%±0.04%)。

图1 多糖含量标准曲线Fig.1 Standard curve of polysaccharide concentration
2.2 黄精多糖的纯化
2.2.1 DEAE-52纤维素柱层析 黄精粗多糖以蒸馏水、0.2和0.5 mol/L NaCl为洗脱液,经过阴离子交换层析柱,分离得到三个洗脱峰。第一个洗脱峰为蒸馏水洗脱峰,从第6管开始收集一直到第18管,洗脱液浓缩醇沉冻干后得到多糖粉末,记为PSP1;第二个洗脱峰为0.2 mol/L NaCl溶液洗脱得到的的单峰,收集第24~34管洗脱液,冻干后得到多糖粉末记为PSP2;第三个洗脱峰为0.5 mol/LNaCl溶液洗脱得到的单峰,收集46~48管洗脱液记为PSP3。重复操作,富集得率最大的蒸馏水洗脱组分用于后续纯化。
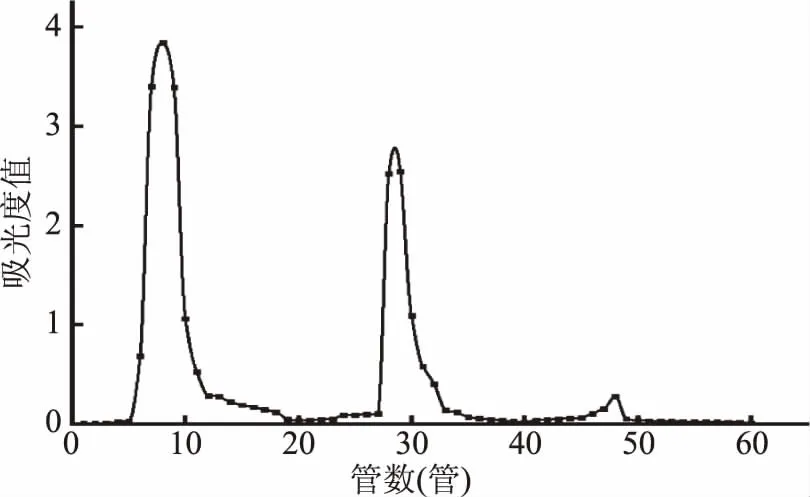
图2 DEAE-52纤维素离子交换层析Fig.2 DEAE-52 column chromatogram
2.2.2 葡聚糖凝胶层析 以蒸馏水为洗脱液进一步纯化DEAE-52分离所得多糖PSP1,得到洗脱曲线如图3。由图可知,凝胶柱洗脱得单一峰,收集5~16管洗脱液得到冻干多糖粉末,记为PSP1-A,重复操作,富集纯化多糖PSP1-A。
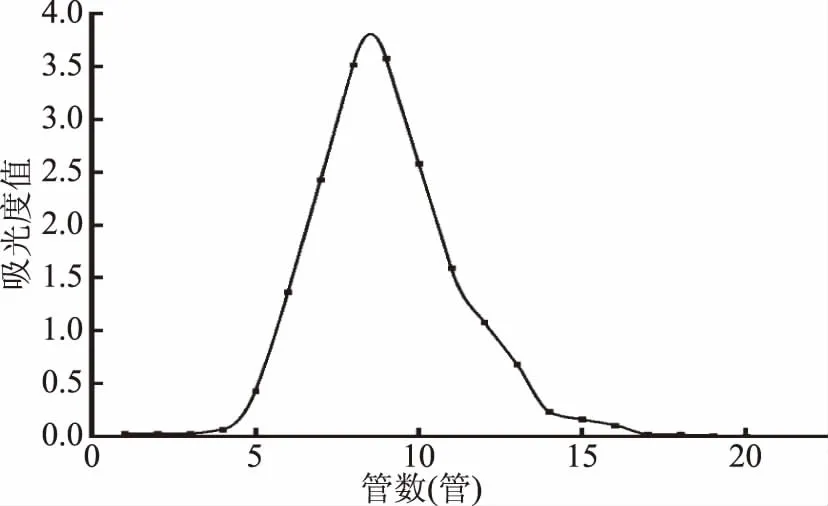
图3 Sephadex G-200层析洗脱曲线Fig.3 Sephadex G-200 column chromatogram
2.3 黄精多糖纯度鉴定
2.3.1 PSP1-A的紫外全波长扫描分析 PSP1-A的紫外全波长扫描图如图4所示。由图谱可知,黄精多糖纯化组分PSP1-A在260 nm和280 nm处无吸收峰,说明不含核酸和蛋白质成分,表明粗多糖的除杂效果较好。

图4 PSP1-A的紫外可见全波长扫描曲线图Fig.4 UV-visible full spectrum scan of PSP1-A
2.3.2 PSP1-A的分子量测定 本实验测得的黄精多糖分子量结果如下,数均分子量(Mn)为12.83 kDa,重均分子量(Mw)为21.58 kDa,分布宽度指数PD为1.68,其PD值在小于1.8,这说明黄精多糖分散性虽大但分布均匀。刘娜[4]分离得到四种黄精多糖组分,分子量相差很大,Mw在2.24~7.74 kDa范围内,其结果均小于本实验测得的分子量。

表1 PSP1-A 的分子量分布特性Table 1 Molecular characterization of PSP1-A
2.4 取代度(DS)的测定
2.4.1 硫酸基取代度的测定 以硫酸根离子浓度为横坐标,A1-A2差值为纵坐标得到标准曲线图(图5),线性回归方程为y=0.7357x-0.01122,R2=0.9961,将SPSP1-A的吸光值带入公式中,得到其硫酸基含量为14.93%,取代度为1.44。
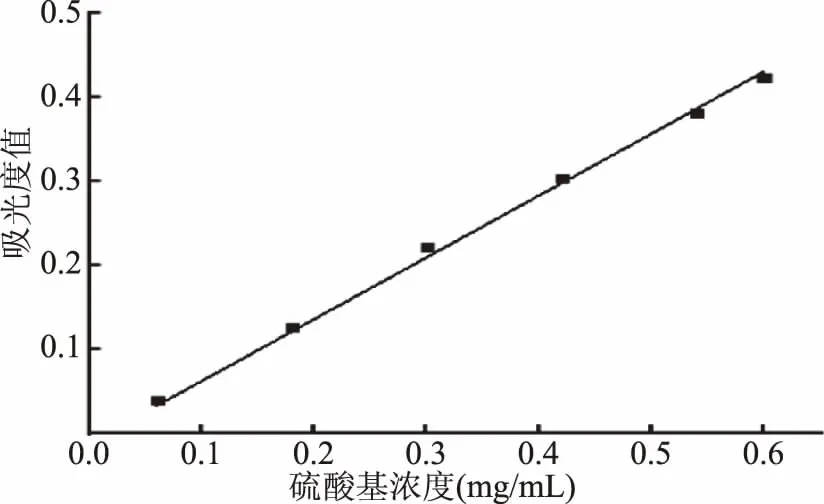
图5 硫酸基含量的标准曲线Fig.5 Standard curve of sulfonic acid content
2.4.2 羧甲基化取代度的测定 利用黄精多糖在碱性条件下与一氯乙酸反应的方法制得羧甲基化黄精多糖,根据公式计算出CPSP1-A的取代度为0.49。
2.5 红外光谱分析

图6 PSP1-A、SPSP1-A、CPSP1-A的红外光谱Fig.6 Infrared spectra of PSP1-A,SPSP1-A and CPSP1-A
修饰前PSP1-A及修饰后SPSP1-A、CPSP1-A的红外光谱图分别如图6所示。PSP1-A存在多糖特征吸收峰,分别在3424、2934、1640、1423、1377、1128、1029、879和809 cm-1处有特征峰。在3424 cm-1处有典型较宽的大拉伸峰,表明存在分子间的O-H伸缩振动;2934 cm-1的特征吸收峰与饱和C-H键伸缩振动有关[24];1640 cm-1处是由-OH弯曲振动引起的;1423、1377 cm-1处存在=CH2变形吸收峰[25]。研究表明1200~1000 cm-1区间内的特征峰与C-O-C及C-O-H的伸缩振动有关[26],该多糖在1128、1029 cm-1处有羧基C-O的伸缩振动,证明该多糖为吡喃糖[27]。多糖在879 cm-1处存在特征吸收峰,且在(840±8) cm-1处未出现特征吸收峰,判断该多糖可能主要是β-型异构体。与PSP1-A相比,SPSP1-A除具备类似PSP多糖的特征吸收峰外,在1260、812 cm-1处出现强吸收峰,分别为不对称S=O伸缩振动及C-O-S拉伸振动引起的吸收峰[28],说明羟基上有硫酸酯基,硫酸化修饰成功。CPSP1-A多糖在保留3415 cm-1附近O-H伸缩振和2930 cm-1附近C-H键伸缩振动等特征吸收峰的同时,在1604 cm-1处出现-COOCH3的C-H变角振动引起的特征吸收峰,在1328 cm-1处出现C=O对称收缩振动引起的特征吸收峰[29],由此证明CPSP多糖中羧甲基(-CH2COOH)基团的存在,羧甲基化修饰成功。
2.6 抗氧化活性检测
2.6.1 清除DPPH自由基的能力 黄精多糖修饰前后对DPPH自由基的清除作用如图7所示。
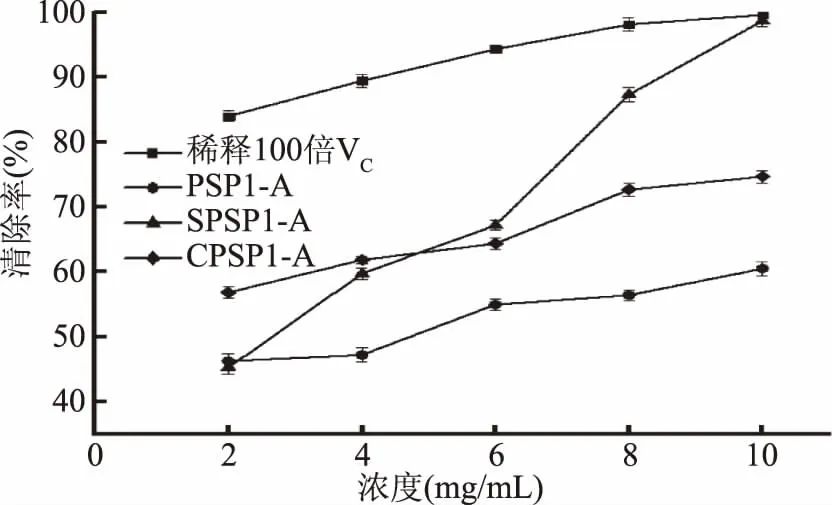
图7 PSP1、SPSP1和CPSP1对DPPH自由基的清除作用Fig.7 Scavenging capacity of PSP1,SPSP1 and CPSP1 on DPPH free radicals
DPPH自由基清除实验是常用的体外评估抗氧化活性的方法之一,抗氧化剂通常通过提供电子或氢原子来中和DPPH自由基,使DPPH在517 nm处发生颜色变化,由紫色变为浅黄色。由图7可知,随着反应浓度的增加,4种物质对DPPH自由基的清除率均随着反应浓度的增加而增加,且清除DPPH自由基的能力均弱于稀释100倍浓度的VC,通过SPSS软件计算可得SPSP1-A、CPSP1-A、PSP1-A的EC50值分别为2.68、1.33和4.72 mg/mL。结合EC50值综合考虑,硫酸化及羧甲基化均能提高PSP1-A清除DPPH自由基的能力。文献中,将黑木耳多糖进行羧甲基化修饰,修饰后多糖的DPPH自由基清除率提高16.65%[10],青钱柳多糖硫酸化后清除作用也显著增强,多糖浓度为0.25 mg/mL时,其清除率最高可达到88.09%,远强于黄精多糖的自由基清除率[13]。多糖可为DPPH自由基提供电子,使一系列自由基反应终止,其抗氧化活性可能与多糖及结构组成等因素相关。
2.6.2 清除ABTS自由基的能力 黄精多糖修饰前后对ABTS自由基的清除作用如图8所示。
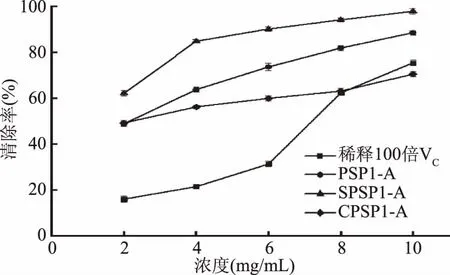
图8 PSP1、SPSP1和CPSP1对ABTS自由基的清除作用Fig.8 Scavenging capacity of PSP1,SPSP1 and CPSP1 on ABTS free radicals
ABTS自由基清除实验是常用的间接抗氧化能力测定方法,氧化后的蓝绿色自由ABTS+可被抗氧化剂还原而褪色。由图7可知,自由基清除率与所测样品浓度之间存在剂量依赖关系,随浓度增大清除率增大。通过SPSS软件计算可得SPSP1-A、CPSP1-A、PSP1-A的EC50分别为1.52、2.33和2.26 mg/mL,清除ABTS自由基的能力均强于浓度稀释100倍的VC。各浓度下CPSP1-A清除率小于PSP1-A,说明羧甲基化修饰后,清除ABTS自由基的能力能力减弱,其机理有待进一步研究。研究表明黑木耳羧甲基化衍生物的ABTS+清除率增加,与本实验结果存在差异。
2.6.3 清除羟基自由基的能力 黄精多糖修饰前后对羟基自由基的清除作用如图9所示。

图9 PSP1、SPSP1和CPSP1对羟基自由基的清除作用Fig.9 Scavenging capacity of PSP1,SPSP1 and CPSP1 on hydroxyl radicals
羟基自由基是可以轻易穿过细胞膜造成细胞死亡的高效氧化剂,因此在研究多糖对羟基自由基的清除能力具有重要意义。图9显示,SPSP1-A、CPSP1-A、PSP1-A清除·OH的能力与浓度呈正相关,通过SPSS软件计算可得SPSP1-A、CPSP1-A、PSP1-A的EC50分别为2.65、1.65和3.10 mg/mL,结果表明硫酸化、羧甲基化修饰均能增强PSP1-A的·OH清除活性。青钱柳硫酸化多糖对羟基自由基的清除作用显著增强,IC50最低值为0.24 mg/mL,远低于硫酸化黄精多糖,而青钱柳多糖的半抑制浓度为4.71 mg/mL[13],活性低于黄精多糖PSP1-A。
2.6.4 还原力 黄精多糖修饰前后还原力变化如10所示。
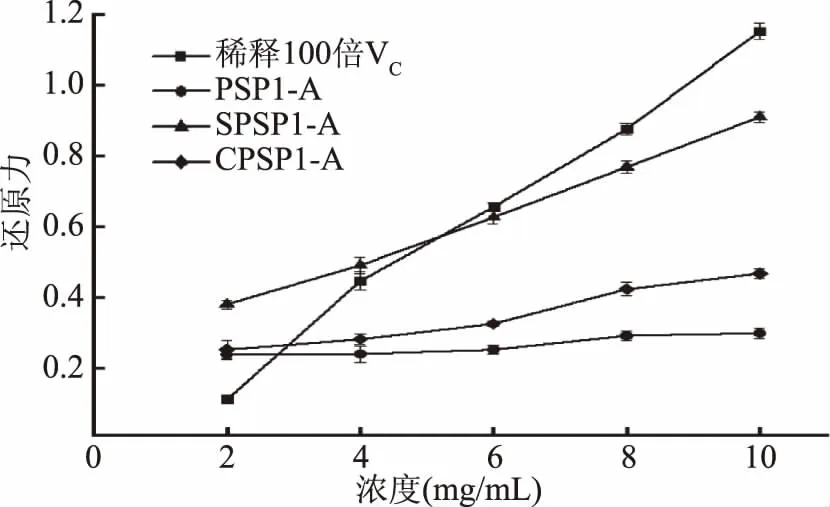
图10 PSP1、SPSP1和CPSP1还原力测定Fig.10 Reducing power assay of PSP1,SPSP1 and CPSP1
实验采用铁氰化钾还原法来测定样品的电子供给能力,抗氧化剂可将Fe3+复合物还原,从而评估待测样品的潜在抗氧化活性。如图10所示,所有多糖样品的还原能力均低于浓度缩小100倍的VC。PSP1-A还原力最弱,最大浓度10.00 mg/mL时,还原力为0.299,与PSP1-A相比,羧甲基修饰多糖的还原力略微增加为0.468,此时SPSP1-A还原力为0.910,远高于羧甲基修饰结果,约为PSP1-A还原力的三倍。结果表明羧甲基化修饰可一定程度上提高黄精多糖的还原力,硫酸化修饰能显著增加PSP1-A的还原力,所有多糖样品的还原能力均低于VC。这些变化可能与修饰改变多糖空间结构等因素相关。
3 结论
本实验以黄精多糖为研究对象,超声提取的粗多糖,经DEAE-52纤维素柱层析对脱蛋白后黄精多糖进行分离,富集含量较高的蒸馏水洗脱组分PSP1过葡聚糖凝胶柱后得到均一组分PSP1-A,紫外光谱证实不含蛋白质及核酸,平均分子量为21.58 kDa。纯化后进行硫酸化及羧甲基化修饰,得到SPSP1-A、CPSP1-A两个修饰产物,取代度(DS)值分别为1.44、0.49。傅里叶红外光谱分析表明两种产物均有多糖特征吸收峰,且SPSP1-A成功引入硫酸酯基,CPSP1-A中也存在羧甲基。体外抗氧化活性研究显示,相同剂量下,SPSP1-A和CPSP1-A清除DPPH、羟基自由基的能力比PSP1-A更显著,还原力也强于PSP1-A。此外,与PSP1-A、CPSP1-A相比,取代度更高的SPSP1-A对以上四个抗氧化指标的作用更显著。本实验表明硫酸化和羧甲基修饰是增强抗氧化活性的有效方法,这可能与硫酸基、羧甲基官能团的引入以及引入基团取代度的不同导致的空间变化有关,从而拓宽多糖及其化学修饰衍生物的生物学应用。

