尼妥珠单抗联合调强适形放疗及化疗治疗局部晚期肺鳞癌的研究
唐武兵 杨文 陈健智 潘兴喜 陈永发 伍楚蓉 袁燕玲 童丽华

摘要:目的 探讨尼妥珠单抗联合调强适形放疗(IMRT)及化疗治疗局部晚期肺鳞癌的临床疗效。方法 选取2015年1月~2018年12月我院经组织病理确诊为肺鳞癌且免疫组织化学检查表达EGFR的Ⅲa~Ⅲb期患者58例,采用随机数字表法分为对照组(n=28)和观察组(n=30)。对照组采用IMRT及化疗治疗,观察组在对照组基础上联合尼妥珠单抗治疗,比较两组EGFR表达、近期疗效、不良反应及远期疗效。结果 两组EGFR表达比较,差异无统计学意义(P>0.05)。观察组总有效率(ORR)高于对照组(73.33% vs 46.43%),疾病控制率(DCR)高于对照组(96.67% vs 67.86%),差异有统计学意义(P<0.05)。两组白细胞下降、血红蛋白下降、血小板下降、胃肠道反应、肝功能异常、肾功能异常、放射性肺炎、放射性食管炎比较,差异无统计学意义(P>0.05)。观察组无进展生存期(PFS)和总生存期(OS)较对照组延长,差异有统计学意义(P<0.05)。结论 尼妥珠单抗联合IMRT及化疗治疗局部晚期肺鳞癌,可有效改善患者的治疗有效率和病情控制效果,且不良反应低,耐受性好,远期疗效较好。
关键词:非小细胞肺癌;放射治疗;化学治疗;尼妥珠单抗;靶向治疗;表皮生长因子受体
中图分类号:R734.2 文獻标识码:A DOI:10.3969/j.issn.1006-1959.2019.20.001
文章编号:1006-1959(2019)20-0001-04
Study of Nimotuzumab Combined with Intensity-modulated Radiotherapy and Chemotherapy in the Treatment of Locally Advanced Lung Squamous Cell Carcinoma
TANG Wu-bing1,YANG Wen1,CHEN Jian-zhi2,PAN Xing-xi1,CHEN Yong-fa1,WU Chu-rong1,YUAN Yan-ling1,TONG Li-hua1
Foshan 528200,Guangdong,China)
Abstract:Objective To investigate the efficacy of nimotuzumab combined with intensity-modulated radiotherapy (IMRT) and chemotherapy in the treatment of locally advanced lung squamous cell carcinoma.Methods From January 2015 to December 2018, 58 patients with stage IIIa~IIIb who were diagnosed as lung squamous cell carcinoma and immunohistochemically examined for EGFR were enrolled in our hospital. The patients were randomly divided into control group (n=28)and observation group (n=30). The control group was treated with IMRT and chemotherapy. The observation group was treated with rituximab in the control group. The EGFR expression, short-term efficacy, adverse reactions and long-term efficacy were compared between the two groups.Results There was no significant difference in EGFR expression between the two groups (P>0.05). The ORR of the observation group was higher than that of the control group (73.33% vs 46.43%), and the DCR was higher than that of the control group (96.67% vs 67.86%),the difference was statistically significant (P<0.05). There were no significant differences in white blood cell decline, hemoglobin decline, thrombocytopenia, gastrointestinal reactions, liver dysfunction, renal dysfunction, radiation pneumonitis, and radiation esophagitis between the two groups (P>0.05). The PFS and OS in the observation group were longer than those in the control group,the difference was statistically significant (P<0.05).Conclusion Nimotuzumab combined with IMRT and chemotherapy for locally advanced lung squamous cell carcinoma can effectively improve the treatment efficiency and disease control effect, and has low adverse reactions, good tolerance and good long-term efficacy.
Key words:Non-small cell lung cancer;Radiotherapy;Chemotherapy;Nimotuzumab;Targeted therapy; Epidermal growth factor receptor
非小细胞肺癌(non-small cell lung cancer,NSCLC)位居目前癌症死亡原因的首位,发病率逐年上升,其中大部分NSCLC患者在发病时已属Ⅲa~Ⅲb期(局部晚期)或Ⅳ期(转移性),失去根治手术治疗机会。NSCLC组织学类型可以分为腺癌、鳞癌和大细胞癌,鳞癌占20%~30%[1]。目前主要采用三维适形放疗、调强适形放疗(IMRT)或立体定向放疗,以及同期放疗联合以铂类为基础的化疗方案,其中贝伐珠单抗、表皮生长因子受体酪氨酸酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)不适用于鳞癌患者[2]。临床研究表明,接受一线治疗的中晚期鳞癌患者的预后差,亟需新的治疗手段。尼妥珠单抗是一种人源化的抗EGFR的单克隆抗体,并在鼻咽癌、头颈部癌、食管癌、宫颈癌、脑胶质瘤的治疗中取得了良好的效果,且耐受性良好[3-6]。本研究主要探讨尼妥珠单抗联合IMRT及化疗治疗局部晚期肺鳞癌的疗效,现报道如下。
1资料与方法
1.1一般资料 选取2015年1月~2018年12月南方医科大学附属南海医院收治的局部晚期肺鳞癌患者58例作为研究对象,本研究经医院伦理委员会审批通过,患者知情同意并签署知情同意书。按照随机数字表法分成观察组(30例)和对照组(28例)。观察组男23例,女7例;年龄50~68岁,平均年龄(62.35±6.25)岁;病程6个月~3年10个月,平均病程(20.36±8.64)个月;临床TNM分期:Ⅲa期7例,Ⅲb期23例。对照组男20例,女8例,年龄48~67岁;平均年龄(60.28±7.72)岁;病程4个月~3年8个月,平均病程(17.68±8.32)个月;临床TNM分期:Ⅲa期5例,Ⅲb期23例。兩组性别、年龄、病程、临床TNM分期等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2纳入及排除标准
1.2.1纳入标准 ①经组织病理学确诊为肺鳞癌Ⅲa、Ⅲb期初治患者;②免疫组织化学检查EGFR过表达;③根据实体肿瘤的疗效评价标准(RECIST1.1)[7],治疗前有可测量的靶病灶;④Karnofsky功能状态评分标准评分≥60分;⑤预计生存时间>6个月;⑥患者至少完成2个周期的化疗,4个周期尼妥珠单抗靶向治疗。
1.2.2排除标准 ①免疫组织化学检测EGFR表达阴性,或基因检测EGFR突变(+)、ALK、ROS1、RET融合重排的患者;②有远处转移瘤、伴随第二原发肿瘤、以及怀孕、哺乳期患者;③不耐受放疗或化疗患者。
1.3方法 对照组给予IMRT及化学治疗,观察组在对照组基础上联合尼妥珠单抗靶向治疗。
1.3.1 IMRT 采用IMRT技术,CT定位,勾画靶区,放射治疗均采用Varian TRILOGY11.0直线加速器多叶光栏技术实施调强适形放射治疗。95%PTV:50~56 Gy,95%CTV:56~60 Gy,95%GTV:60~76 Gy,以95%等剂量曲线覆盖计划靶区,肺组织的耐受剂量推荐值(V5<48%,V20<30%~35%,V30<25%,MLD<20~23 Gy),分两段影像学检查调整靶区规划,满足剂量靶区要求同时减少肺放射性损伤。放疗时间:1次/d,5次/周,治疗6~7周。
1.3.2化疗 化疗药物方案:吉西他滨(江苏豪森药业集团有限公司,批号:150305,0.2 g/支)1.25 g/m2,静脉滴注;紫杉醇(海南卓泰制药有限公司,批号:20161002,30 mg/支)175 mg/m2,静脉滴注;多西他赛(上海创诺制药有限公司,批号:9011160104,20 mg/支)75 mg/m2,静脉滴注;长春瑞滨(法国皮尔法伯制药公司,批号:1P160,10 mg/支)25 mg/m2,静脉注射;联用铂类药物方案:顺铂(江苏豪森药业集团有限公司,批号:150103,30 mg/支)75 mg/m2,分3~4 d使用;奈达铂(齐鲁制药有限公司,批号:5C0115B04,10 mg/支)75 mg/m2,分3~4 d使用。吉西他滨、或紫杉醇、或多西他赛、或长春瑞滨联合顺铂或奈达铂方案化疗,每21 d为1个疗程,共治疗4~6疗程。
1.3.3尼妥珠单抗治疗 在放疗前4 h给予静脉滴注尼妥珠单抗(百泰生物药业有限公司生产,批号:0120150510,50 mg/支)200 mg,滴注时间在1 h以上,1次/周,治疗6~7个疗程。
1.4随访 采用门诊随访和电话随访,末次随访时间至2019年4月。
1.5观察指标 比较两组EGFR表达水平、近期疗效、不良反应及远期疗效。
1.5.1 EGFR表达 免疫组织化学方法检测肿瘤组织EGFR,表达强度和比例的分值之积共9分,3分以上为阳性,分1~3级,由两位病理医生质控评分。
1.5.2近期疗效 根据治疗前后CT观察肿瘤灶的两垂直径最大乘积变化,按照RECIST1.1版[7]分为,①完全缓解(CR):所有目标病灶消失;②部分缓解(PR):基线病灶长径总和缩小30%;③稳定(SD):基线病灶长径总和有缩小,但未达PR或有增加但未达PD;④进展(PD):基线病灶长径总和增加20%或出现新病灶。总有效率(ORR)=(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
1.5.3不良反應 采用RTOG、CTCAE4.03版评价[7,8]不良反应,包括皮疹、发热、过敏、乏力、白细胞下降、血红蛋白下降、血小板下降、胃肠道反应、肝功能异常、肾功能异常、放射性肺炎、放射性食管炎等。
1.5.4远期疗效 比较两组无进展生存期(PFS),总生存期(OS)。
1.6统计学分析 采用SPSS 22.0统计软件分析处理数据,计量资料以(x±s)表示,采用t检验;计数资料以(%)表示,采用?字2检验;PFS及OS采用Kaplan-Meier法并行Log-Rank检验分析,以P<0.05表示差异有统计学意义。
2结果
2.1两组EGFR表达比较 两组各分级间EGFR表达比较,差异无统计学意义(?字2=0.257,P=0.880),见表1。
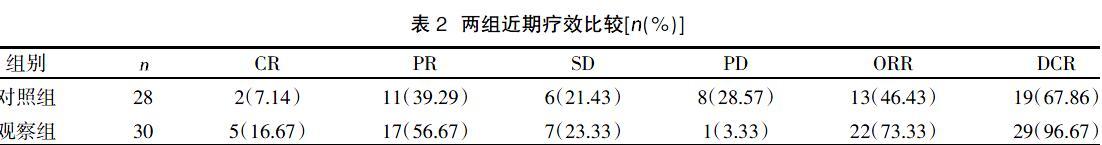
2.2两组近期疗效比较 观察组ORR高于对照组,差异有统计学意义(?字2=4.381,P=0.036);观察组DCR高于对照组,差异有统计学意义(?字2=6.256,P=0.011),见表2。
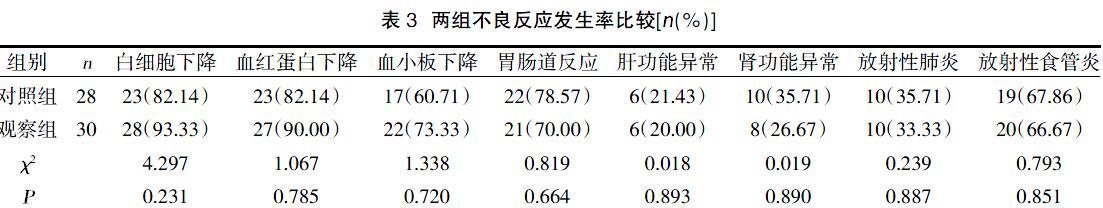
2.3两组不良反应发生率比较 两组白细胞下降、血红蛋白下降、血小板下降、胃肠道反应、肝功能异常、肾功能异常、放射性肺炎、放射性食管炎比较,差异无统计学意义(P>0.05),见表3。
2.4两组远期疗效比较 随访至2019年4月,观察组死亡1例,对照组死亡3例,死亡原因主要为远处转移。观察组和对照组的中位PFS分别为14个月(95%CI:12.936~15.064)和10个月(95%CI:8.704~11.296),两组PFS比较,差异有统计学意义(?字2=17.889,P=0.000);观察组和对照组的中位OS分别为35个月(95%CI:32.413~37.587)和29个月(95%CI:28.172~29.828),两组OS比较,差异有统计学意义(?字2=18.728,P=0.000),见图1、图2。
3讨论
晚期NSCLC分为鳞状细胞亚型和非鳞状细胞亚型,其中鳞状细胞亚型在西方人群中大约占NSCLC的25%,在中国人群中占NSCLC的30%~46%。分子检测技术的进步和靶向药物的应用改善了驱动基因阳性患者的生存获益,但是驱动基因阳性的患者主要见于肺腺癌亚型中,在鳞状细胞癌中的比例相当低,有数据显示,晚期肺腺癌患者驱动基因阳性率为53.9%,其中EGFR突变占46.1%,ALK阳性率占6.4%,ROS1阳性占1.5%[9];EGFR基因突变在鳞癌患者中约为8.8%,ALK基因重排在鳞癌中阳性率约5.6%[10]。随着免疫治疗的研究深入,2019版CSCO指南也更新加入免疫检查点抑制剂在NSCLC的一线治疗推荐,主要还是以含铂双药化疗为标准治疗,所推荐的含铂双药化疗(紫杉醇、多西他赛、长春瑞滨或吉西他滨联合铂类)是对于身体状况较好(PS=0~1)的晚期肺鳞癌患者的一线治疗方案,对于PS=2的晚期肺鳞癌患者推荐单药化疗(吉西他滨、紫杉醇、长春瑞滨、多西他赛)。对于局部晚期NSCLC,各大指南基本推荐的治疗方案仍以三维适形放疗、IMRT或立体定向放疗,以及同期放疗联合以铂类为基础的化疗方案为主。随着肿瘤生物学的发展,分子靶向治疗成为治疗NSCLC的新方法,因此研究放化疗的靶向治疗方法对于治疗局部晚期NSCLC具有重要意义。
EGFR作为erbB家族的第一个成员,目前研究显示EGFR过表达与肿瘤的高度侵袭力、转移性及不良预后高度相关[11];EGFR过表达率在NSCLC中为45.9%[6],在肺鳞癌中为63.4%,在腺癌中为43.9%,因此EGFR已成为肺癌治疗的新靶点。尼妥珠单抗属抗EGFR单克隆抗体,IgG1亚型,具有人源化程度高(高达95%)、亲和力高、选择性高及半衰期长的特点,可以特异性阻断肿瘤细胞表面的EGFR与内源性配体的结合,从而阻断细胞信号传导通路,抑制肿瘤细胞增殖,增强肿瘤细胞对于放化疗的敏感性;尼妥珠单抗还可以通过抑制NF-κB表达和激活细胞死亡,增加NSCLC对TNF-α诱导的细胞凋亡的敏感性[12];同时,还可提高人类白细胞抗原(HLA Class I)表达水平,增加抗肿瘤免疫力[13],在治疗中展现出高度的抗肿瘤活性[14-17]。
本研究结果显示,两组EGFR表达比较,差异无统计学意义(P>0.05)。观察组ORR高于对照组,差异有统计学意义(P<0.05);观察组DCR高于对照组,差异有统计学意义(P<0.05)。观察组和对照组的中位PFS分别为14个月和10个月,中位OS分别为35个月和29个月,观察组PFS和OS较对照组有延长,差异有统计学意义(P<0.05),与Li J等[17]研究结果相似,说明尼妥珠单抗联合IMRT及化疗治疗表达EGFR的局部晚期肺鳞癌患者,可提高近期放化疗效果。两组白细胞下降、血红蛋白下降、血小板下降、胃肠道反应、肝功能异常、肾功能异常、放射性肺炎、放射性食管炎比较,差异无统计学意义(P>0.05),提示尼妥珠单抗作为人源化IgG1型单克隆抗体,对正常组织反应小,耐受性好。
综上所述,尼妥珠单抗联合IMRT及化疗治疗局部晚期肺鳞癌患者疗效确切,不良反应少,患者耐受性好。但本研究样本量偏小,有必要进一步扩大样本量及延长随访时间研究尼妥珠单抗与肺腺癌、鳞癌等非小细胞肺癌的远期疗效之间的关系。
参考文献:
[1]Xu S,Ramos-Suzarte M,Bai X,et al.Treatment outcome of nimotuzumab plus chemotherapy in advanced cancer patients:a single institute experience[J].Oncotarget,2016,7(22):33391-33407.
[2]de Castro Junior G,Segalla JG,de Azevedo SJ,et al.A randomised phase Ⅱ study of chemoradiotherapy with or without nimotuzumab in locally advanced oesophageal cancer:NICE trial[J].Eur J Cancer,2018,88(1):21-30.
[3]Subramanian S,Sridharan N,Balasundaram V,et al.Effectiveness and tolerability of nimotuzumab in unresectable,locally advanced/metastatic esophageal cancer:Indian hospital-based retrospective evidence[J].South Asian J Cancer,2019,8(2):112-115.
[4]Chen YF,Tang WB,Pan XX,et al.Safety and efficacy of nimotuzumab combined with hemoradiotherapy in Chinese patients with locally advanced cervical cancer[J].Onco Targets Ther,2017(10):4113-4119.
[5]Du XJ,Li XM,Cai LB,et al.Efficacy and safety of nimotuzumab in addition to radiotherapy and temozolomide for cerebral glioblastoma:a phase Ⅱ multicenter clinical trial[J].J Cancer,2019,10(14):3214-3223.
[6]张坤宁,路军,赵宏颖,等.表皮生长因子受体、人类表皮生长因子受体2、人类表皮生长因子受体3表达与非小细胞肺癌预后的关系[J].肿瘤研究与临床,2016,28(2):73-89.
[7]周际昌.实用肿瘤内科治疗(第2版)[M].北京:北京科学技术出版社,2016.
[8]李晔雄.肿瘤放射治疗学(第5版)[M].北京:中国协和医科大学出版社,2018.
[9]苏宁,张贤兰,黄惠怡,等.晚期肺腺癌驱动基因分布及其一线治疗现状-单中心真实世界研究[J].实用医学杂志,2019,35(4):537-540.
[10]张童童,李峻岭.存在驱动基因突变肺鳞癌患者的临床病理特征及预后分析[J].中国肺癌杂志,2016,19(10):648-652.
[11]Concha-Benavente F,Ferris RL.Reversing EGFR Mediated Immunoescape by Targeted Monoclonal Antibody Therapy[J].Frontiers in Pharmacology,2017(8):332.
[12]Zhu J,Xin Y,Liu X,et al.Nimotuzumab enhances the sensitivity of non-small cell lung cancer cells to tumor necrosis factor-α by inhibiting the nuclear factor-кB signaling pathway[J].Experimental and Therapeutic Medicine,2018(5):3345-3351.
[13]Garrido G,Rabasa A,Garrido C,et al.Upregulation of HLA Class I Expression on Tumor Cells by the Anti-EGFR Antibody Nimotuzumab[J].Front Pharmacol,2017(8):595.
[14]Kato K,Ura T,Koizumi W,et al.Nimotuzumab combined with concurrent hemoradiotherapy in Japanese patients with esophageal cancer:A phase I study[J].Cancer Science,2018,109(3):785-793.
[15]Peng H,Tang LL,Liu X,et al.Anti-EGFR targeted therapy delivered before versus during radiotherapy in locoregionally advanced nasopharyngeal carcinoma:a big-data,intelligence platform-based analysis[J].BMC Cancer,2018,18(1):323.
[16]Zhao J,Zhuo M,Wang Z,et al.A phase Ⅰ study of nimotuzumab plus docetaxel in chemotherapy-refractory/resistant patients with advanced non-small-cell lung cancer[J].Chinese Journal of Cancer Research,2016,28(1):12-18.
[17]Li J,Yan H.Skin toxicity with anti-EGFR monoclonal antibody in cancer patients:a meta-analysis of 65 randomized controlled trials[J].Cancer Chemother Pharmacol,2018,82(4):571-583.
收稿日期:2019-8-6;修回日期:2019-8-22
編辑/杜帆

