一株碱性果胶酶产生菌的分离与培养条件研究
杨金宏,孔卫青
(安康学院 陕西省蚕桑重点实验室,陕西 安康 725000)
家蚕(Bombyxmori)是一种重要的吐丝结茧的经济昆虫,桑叶是家蚕唯一的食物,家蚕对桑叶的消化吸收效率,暨叶丝转化率(茧层量/食下量)是蚕桑生产效益的重要指标之一。肠道菌群定殖在宿主肠道内,与宿主相互依赖、互利共生,对宿主的消化吸收和生长发育有重要影响。家蚕肠道菌群丰富,高绘菊等对家蚕中肠菌群进行分离培养,显示其中存在多种可以分泌蛋白酶、脂肪酶、纤维素酶、淀粉酶的菌种[1]。邹昌瑞等分离培养柞蚕中肠菌,显示芽孢杆菌是其主要菌群,可以产纤维素酶和蛋白酶[2]。但上述研究均未发现其中分泌果胶酶的菌株。
蚕沙是家蚕排泄物,含大量未被家蚕消化吸收的桑叶成分,其中果胶占风干蚕沙的10%~12%,是家蚕不能吸收利用的桑叶成分之一。外源添食纤维素单胞菌、枯草芽孢杆菌或外源性芽孢杆菌等,给家蚕添食均对家蚕的生长发育、肠道优势菌群和经济性状有一定影响[3-6]。因此,研究家蚕产果胶酶菌株,通过外源添加菌群,促进家蚕对桑叶果胶的消化吸收,对提高家蚕叶丝转化率具有重要意义。
中肠是家蚕分泌消化酶、消化吸收桑叶的主要场所,中肠肠液pH值在9.2以上,中肠中部的pH值甚至达10.5~11.0,强碱性环境抑制了果胶酶产生菌的发生。而中肠后部至排出蚕沙中的菌群研究鲜见报道。本研究拟分离家蚕蚕沙的果胶酶产生菌,为通过外源添加降解桑叶中果胶、提高家蚕对桑叶果胶成分的消化吸收和家蚕叶丝转化率提供理论依据。
1 材料与方法
1.1 试验材料
试验使用的5龄3 d家蚕871×872饲养于安康学院恒口蚕桑科研基地,取样前1 h置于超净工作台,用无菌样品盒饲养,取排出30 min内的新鲜蚕沙。
1.2 菌株的分离筛选与鉴定
取1.1新鲜蚕沙3 g,加入到50 mL 富集培养液中,无菌玻璃棒搅拌,30℃ 160 r·min-1振荡培养2 d后,按10-6~10-9梯度对培养液进行稀释,并均匀涂布到分离培养基平板上,30 ℃培养2 d。后从平板上挑取较大的菌落,进行再次分离纯化,获得单菌落。在菌落周围加入几滴1%的CTAB,静置10 min, 若有透明圈产生则为碱性果胶酶产生菌。
1.3 菌株16S rDNA序列获取及分析
提取菌株的基因组DNA,16S rDNA通用引物对27F和1492R扩增菌株的16S rDNA,PCR扩增条件参照Oliwa-Stasiak等[7]。PCR扩增产物委托上海生工(生物工程)有限公司进行测序。测序结果进行在线BLASTN比对,同时下载克雷伯氏菌属内物种的同源系列,MEGA 6.0软件的极大似然法(Maximum Likelihood)构建系统进化树,重复1 000次进行Bootstrap检验,确定菌株归属[8]。
1.4 培养条件的优化与生长曲线的测定
分别以淀粉、果胶、蔗糖、葡萄糖为碳源,配制浓度0.1 g·L-1,以硫酸铵、酵母粉、蛋白胨、蚕蛹粉为培养氮源,配制浓度0.05 g·L-1,正交设计配制菌株培养基100 mL,调节培养基初始pH值为8.0。1:100加入培养液,35℃培养2 d,3个重复筛选菌株生长最佳碳氮源。分别调节培养基初始pH为4.0,5.0,6.0,7.0,8.0,9.0,10.0,设定培养温度为25 ℃,30℃,35℃,40℃,45℃,50 ℃,研究培养基pH值和培养温度对菌株生长的影响。采用测定培养液OD600或细菌计数法(THAOMA)分析培养结果。最后利用最优培养条件测定每隔5 h菌液的OD600,重复3次求平均值,绘制菌株生长曲线。
1.5 菌株产酶活性的测定
取培养2 d的菌液,无菌四层纱布过滤,滤液5 000 r·min-1离心15 min,上清液即为粗酶液。取粗酶液20 μL,与含0.2%聚半乳糖醛酸的甘氨酸-氢氧化钠缓冲液(pH8.6)2 mL混合,后分别添加5 mmol·L-1钙、镁、锰、锌等二价离子至不同测试管,以未添加金属离子测试管为对照,检测不同金属离子对酶活性的影响。30℃反应10 min,加入0.03 mol·L-1磷酸溶液3 mL终止反应,测定235 nm 处吸光度,记为A,以同样体系加热煮沸10 min的粗酶液做空白对照,每个样品3个重复。
一个标准酶活单位(U)定义为:1 mL酶液每min使聚半乳糖醛酸裂解产生1 μmol的不饱和聚半乳糖醛酸的酶量。不饱和聚半乳糖醛酸在235 nm 处的摩尔吸光系数a为4 600 L·mol-1cm-1。根据公式:A=abc,其中b=1 cm,计算样品浓度平均值c,计算标准酶活性。
2 结果与分析
2.1 菌株形态特征与CTAB显色法鉴定
菌株在分离培养基30 ℃培养2 d的菌落为圆形(图1A),直径1.5~2 mm,扁平,边缘整齐,灰白色,稍微不透明,有淡淡的异味。利用CTAB显色法对菌株进行鉴定,产生明显的透明圈(图1B),初步确定该菌为碱性果胶酶产生菌。
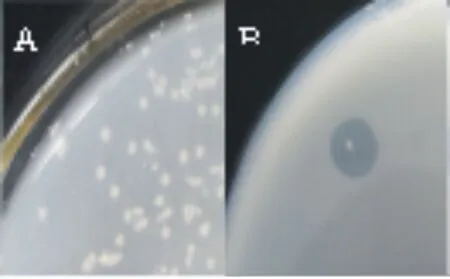
图1 菌株菌落形态(A)与水解圈鉴定(B)
2.2 基于16S rDNA的菌株鉴定
对菌株的16S rDNA序列进行的PCR扩增和测序,获得1408 bp的DNA序列(GenBank登录号:MH916560)。在线BLASTN比对,其与Klebsiellasp. SPC06的16S rDNA的一致性达99%。MEGA 6.0软件构建系统进化树,结果显示,本菌与产酸克雷伯氏菌(K.oxytoca)、格氏勒米诺克雷伯氏菌(K.grimontii)等优先聚合在一起。结合菌株形态特性,确定该菌为克雷伯氏菌属Klebsiellasp.,命名Klebsiellasp. AKB01。
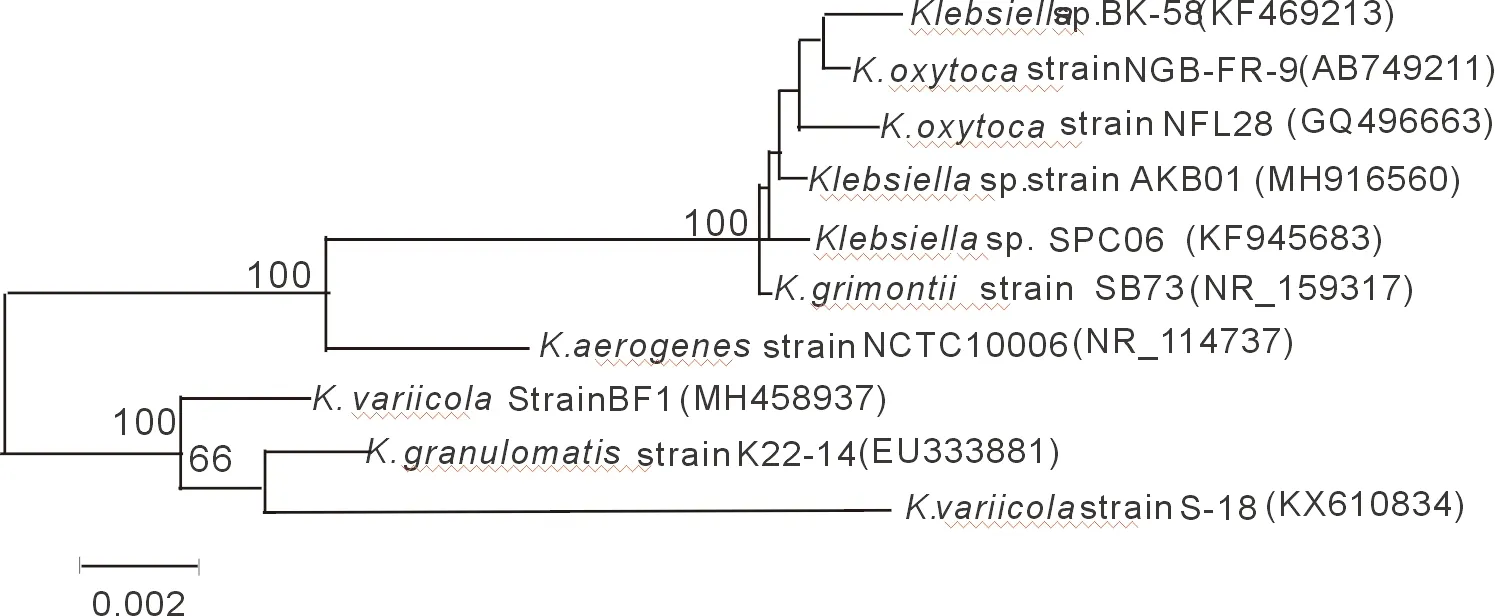
图2 基于16srDNA序列的系统发育树,加粗分支为Klebsiellasp.AKB01;括号中字符为基因登录号
2.3 菌株AKB01培养条件的优化
不同碳氮源对菌株AKB01生长影响的研究显示(图3),葡萄糖和酵母粉组合条件下菌株生长最快,菌液活菌量8.58*108个·mL-1,其次是蔗糖和酵母粉组合(7.84*108个·mL-1),淀粉和硫酸铵组合条件下生长最慢(1.40*108个·mL-1)。因此葡萄糖和酵母粉是菌株生长的最适碳氮源。
进一步研究培养温度和初始pH值对菌株AKB01生长的影响,结果表明(图4),菌株的最佳生长温度为 35℃,低于25℃或高于40 ℃生长速度明显下降。菌株生长的最适pH为8.0,pH小于5.0或大于9.5时生长几乎停滞。基于此,得到本研究菌株AKB01的最优培养条件为:1%葡萄糖,0.5%酵母粉,pH 8.0,温度35 ℃。最优培养条件下,绘制菌种的生长曲线,发现15 h菌株进入对数生长期,35 h后进入稳定生长(图5)。
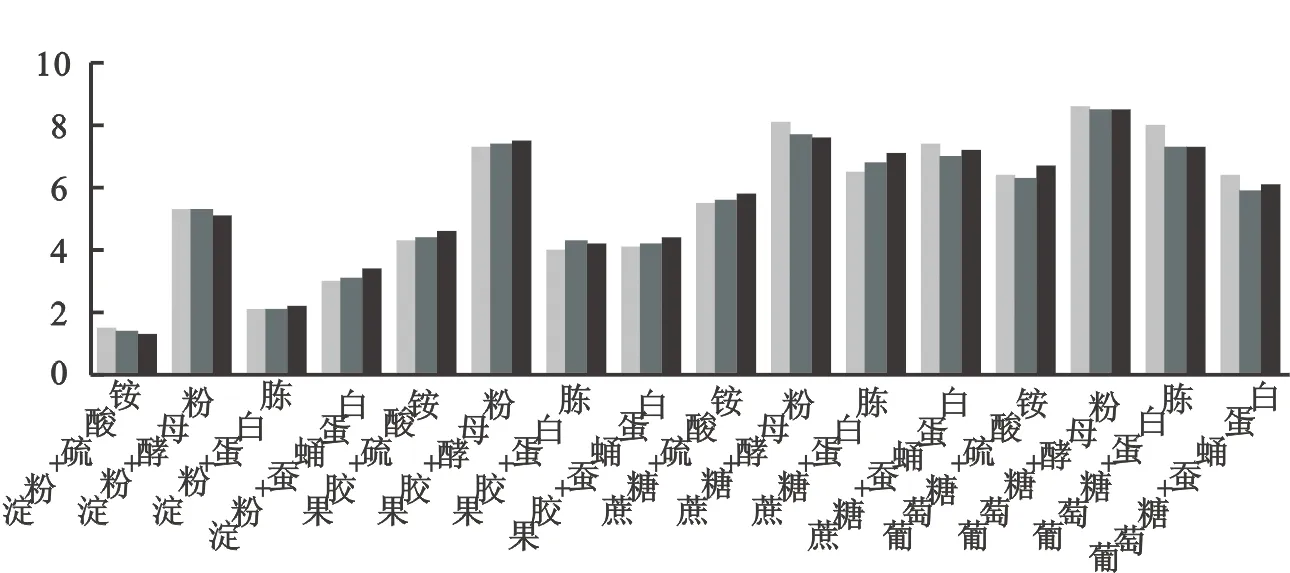
图3 不同碳氮源组合对菌株生长的影响
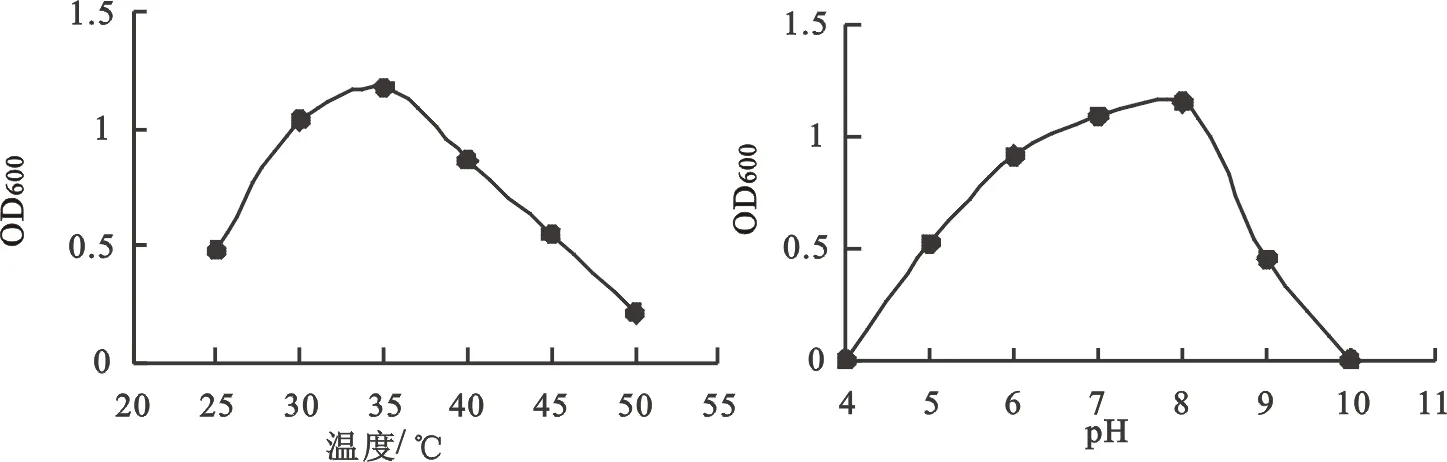
图4 不同温度和起始pH对菌株AKB01生长的影响
2.4 不同金属离子对菌株碱性果胶酶活性的影响
以5 mmol·L-1二价金属离子作为辅助剂,测定粗酶液的酶活性,结果对照中,菌株的酶活性仅0.98 U·mL-1,添加不同金属离子酶活性存在差异(图6),添加钙离子酶活性最高为48.50 U·mL-1,镁离子时最低为5.39 U·mL-1,符合果胶酸裂解酶的特点[9]。
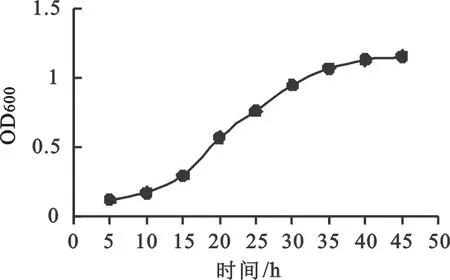
图5 菌株AKB01生长曲线
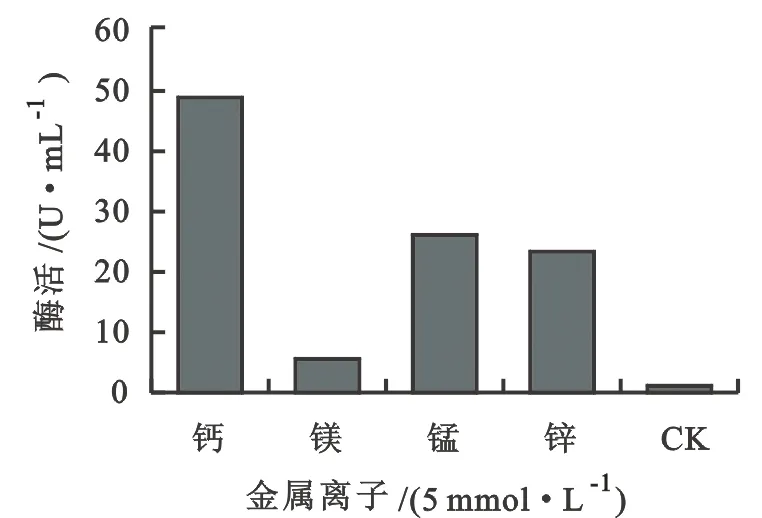
图6 不同二价金属离子对酶活性的影响
3结论与讨论
本试验以果胶为唯一碳源从蚕沙中的分离获得果胶酶产生菌,并利用酶水解透明圈和16S rDNA序列对筛选获得菌株进行鉴定,命名为Klebsiellasp. AKB01,这也是首次从蚕沙中分离得到分泌果胶酶的菌株,说明在碱性较弱的家蚕中肠后部(pH值8.0-9.0左右),可能存在产果胶酶菌株,为进一步家蚕对果胶的消化吸收以及家蚕肠道产果胶酶微生物菌群的研究提供了参考。
外源添加家蚕肠道的优势菌群,也可加强肠道优势菌群能力,对家蚕全茧量和茧层量等茧丝经济性状具有显著改善。本研究分离菌株AKB01在pH值大于9.5时生长缓慢或停滞,而中肠中部为强碱性环境,对菌株的生长具有抑制甚至灭活作用,因此目前很少有家蚕肠道产果胶酶相关菌的报道。
二价金属离子是果胶酶发生作用的辅助因子,钙离子可显著提高菌株AKB01的碱性果胶酶的活性至48.50 U·mL-1,酶活性稍低于来源于史密斯杆菌产碱性果胶酶的菌株(88U·mL-1)[10],与枯草芽孢杆菌的酶活性相当45 U·mL-1[11],高于芽孢杆菌 WSHB04-02(34 U·mL-1)[12],符合野生菌株的特征。该菌株发酵周期短,为碱性果胶酶的工业化生产奠定了一定的基础。

