手性伯胺-硫脲的合成与应用
马志伟,王建玲,李爱勤,赵立魁
(河南牧业经济学院 理学部,河南 郑州 450046)
不对称有机催化已成为一种高效、环保、条件温和的合成方法,广泛用于制备光学纯天然产物、手性药物、建筑材料等重要分子。在许多情况下,有机小分子催化剂的有效性依赖于氢键作用:例如硫脲、脲、二醇等。开创性的例子包括Jacobsen、Schreiner和Takemoto等的工作,他们的研究表明硫脲类有机催化剂可以成功地用于多种不同的不对称C-C键形成反应。
在过去的十多年中,双功能氨基-硫脲类有机催化剂由于其优越的不对称催化性能,在有机合成中有着广泛的应用。叔胺硫脲和仲胺硫脲开始研究使用较早,并取得了较大的研究进展。起步较晚的伯胺硫脲有机催化剂也取得了重大研究进展,Tsogoeva课题组和Jacobsen课题组于2006年首次报道了此类催化剂。手性伯胺作为有机催化剂具有特殊的吸引力,因为它们存在于多种酶的催化位点中,如I型醛缩酶、脱水酶和脱羧酶。伯胺硫脲作为一种有强大发展潜力的有机催化剂,激发了不同研究小组利用此类催化剂开发新的不对称反应。特别是近年来,手性氨基硫脲类催化剂的设计合成及在各类不对称反应中的应用探索已成为催化领域中一个备受关注的研究课题。
异斯特维醇是天然产物甜菊糖的酸性水解产物,廉价易得。在过去的几年中,化学工作者做了大量的研究工作。一方面,大量的异斯特维醇衍生物被合成出来,并表现出了不错的生物活性,这就激起了化学工作者继续研究的兴趣,尤其是在药物化学领域的应用。另一方面,在其分子结构中,两个重要的官能团(即羰基和羧基)位于整个分子骨架的同侧,同时还有一个甲基,这就使得这个分子形成了一个非常优越的不对称环境。因此,异斯特维醇及其衍生物在超分子化学和不对称有机催化中也得到了较深入的研究。
鉴于此,我们计划将伯氨基通过硫脲与异斯特维醇骨架连接起来,一方面利用氨基和硫脲分别活化两个反应底物,另一方面,借助异斯特维醇骨架优异的手性空腔环境,从而影响产物的立体选择性。
1 手性伯胺-硫脲的结构

2 手性伯胺-硫脲的合成路线

3 手性伯胺-硫脲的合成方法
称取2 g氢氧化钾加入70 mL二甲亚砜中,随后加入10 g异斯特维醇。冰浴、搅拌条件下,向反应体系中滴加2 mL溴乙烷,加毕。将体系转至室温搅拌6h,在此过程中可以观察到大量白色固体生成。将反应体系倒入500 mL冰水中,并用玻璃棒不断搅拌,经过滤,洗涤后得粗品,经柱层析分离后得白色固体纯品化合物2,产率92%。
称取0.10 g盐酸羟胺0.13 g和碳酸氢钠加入25 mL乙醇中,室温搅拌5分钟后,向体系中加入0.34 g化合物2,而后将反应体系加热至回流状态反应2小时。反应结束后,减压蒸除溶剂,向蒸馏残余物中加入水和乙酸乙酯,分出有机相,水相再用乙酸乙酯萃取2次后,合并有机相,干燥、过滤、浓缩后得化合物3为白色固体,产率96%。
将3.61 g化合物3、2.19 g三氧化钼加入30 mL甲醇中,随后在冰浴、搅拌条件下,向反应体系中分批加入1.90 g硼氢化钠。加毕,将反应体系转至室温条件下,搅拌反应过夜。反应结束后,过滤,滤液加水并用二氯甲烷萃取,有机相经干燥、过滤、浓缩后得白色固体化合物4,产率77%。
将1.53 g化合物4加入5 mL乙醇中,待化合物4溶解完全后,向体系中加入3.34 g二硫化碳和0.44 g三乙胺,室温搅拌反应0.5h。而后将体系转至冰浴条件下,依次向其中快速加入0.95 g二碳酸二叔丁酯和2 mol% 4-二甲氨基吡啶,搅拌反应5分钟后转至室温反应。TLC监测反应完全后,将体系浓缩得粗品,再经柱层析分离后得白色固体纯品化合物5,产率89%。
将0.35 g化合物5和0.08 g乙二胺加入20 mL二氯甲烷中,室温条件下搅拌反应,过夜。浓缩体系得粗品,再经柱层析分离后得白色固体纯品化合物6,产率84%。
4 手性伯胺-硫脲的表征
1H NMR (400 MHz,CDCl3,TMS):δ 0.71 (s,3H),0.86 (m,1H),0.94 (s,3H),1.08 (m,4H),1.16 (s,3H),1.25 (m,5H),1.34 (m,5H),1.60 (m,6H),1.78 (m,2H),1.95 (t,J=11.6 Hz,2H),2.15 (d,J=12.8 Hz,1H),3.07 (s,2H),3.69 (s,2H),4.02-4.12 (m,2H),4.49 (s,3H);13C NMR(100 MHz,CHCl3):δ 13.5,14.2,18.9,25.2,28.9,29.7,38.0,40.5,41.4,42.3,55.8,55.9,57.0,60.1,177.7;calcd. for C25H44N3O2S [M+H]+:450.3154,found 450.3155。
5 手性伯胺-硫脲在异丁醛与硝基苯乙烯的Michael加成反应中的催化性能
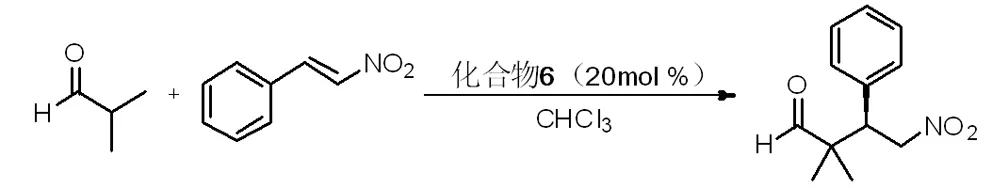
将0.40 mmol异丁醛、0.20 mmol硝基苯乙烯和20 mol%化合物6加入1.0 mL氯仿中,室温搅拌反应3h,TLC监测反应完全后,减压蒸除溶剂,然后经薄层色谱分离得产品。收率,85%。
产物的对映选择性经HPLC确定。液相分离条件为:色谱系统:Labtech-2006 型 HPLC 泵、Labtech UV600 型紫外-可见检测仪;手性柱:Chiralcel OD-H (4.6 mm × 250 mm);流动相Hexanes/i-PrOH = 80/20;流速:0.7 mL/min;波长:254 nm。液相结果为:tR= 21.0 min (major),30.9 min (minor);对映选择性(ee):55%。
6 结果
本文设计并成功合成了一个未见文献报道的新型手性伯胺-硫脲化合物6。合成方法简便,且目标产物收率高。此手性伯胺-硫脲可用于催化异丁醛和硝基烯烃的不对称Michael加成反应,所得加成产物具有较高的收率,但对映选择性结果不理想。对此催化剂结构及此催化体系的优化工作仍在进行中。

