安罗替尼治疗复发转移性食管鳞癌的疗效及安全性观察
邵岚 王文娴 宋正波 娄广媛 古翠萍 石志永 张沂平
最新GLOBOCAN研究显示[1],2018年有57.2万例患者新诊断为食管癌。根据2018年中国癌症报告,我国食管癌新发病例数为25.8万,其发病率在恶性肿瘤中排第六位[2]。根据病理类型,食管癌分为鳞癌和腺癌。腺癌为欧美国家的主流类型,而鳞癌在亚洲、非洲国家多见。中国95%以上食管癌为鳞状细胞癌[3],主要危险因素为饮酒、吸烟和炎症引起的慢性刺激。近年来食管癌诊疗技术有所进步,但总体疗效仍不理想,5年生存率仅30%左右[4]。目前治疗食管癌的主要方法有手术、化疗和放疗等。2019年中国临床肿瘤学会食管癌诊疗指南更新了复发转移性食管癌二线及以上治疗策略,对于体力活动状态(PS)评分0~1分的患者,安罗替尼、阿帕替尼等抗血管生成药物均可作为Ⅱ级推荐药物应用,其中安罗替尼仅用于食管鳞癌患者。安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,能抑制血管内皮生长因子受体、血小板衍生生长因子受体、成纤维细胞生长因子受体等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的作用[5]。目前在肺癌、食管癌、软组织肉瘤、甲状腺髓样癌等实体瘤中都表现出抗肿瘤治疗的价值,本文就安罗替尼治疗复发转移性食管鳞癌的疗效及安全性作一探讨,现将结果报道如下。
1 对象和方法
1.1 对象 回顾性分析2018年6月至2019年4月在本院胸部肿瘤内科接受安罗替尼治疗的22例复发转移性食管鳞癌患者的临床资料。其中男20例,女2例;年龄 54~83[64(61.5,69.0)]岁,<65 岁 12 例,≥65 岁 10例;PS评分0~1分14例,2~3分8例;疾病分期ⅢB期2例,Ⅳ期20例;病理分化程度:低分化4例,高中分化7例;未明确分化11例;远处转移20例,转移部位包括肺、骨、肝等;安罗替尼二线治疗9例,三线及以上治疗13例。
1.2 方法
1.2.1 给药方法 所有患者予盐酸安罗替尼胶囊(12mg/粒,国药准字H20180004,正大天晴药业集团股份有限公司)12mg口服,1次/d,若不能耐受则下调剂量至10mg/d。服药2周停药1周,以3周为1个疗程。
1.2.2 近期疗效评价 1个疗程后评估近期疗效,对于疗效稳定或有效的患者,每2个疗程复查1次CT及其他影像学检查。疗效评估参照实体瘤疗效评价标准(RECIST v1.1),评定结果包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)[6]。客观缓解率(ORR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
1.2.3 随访及生存分析 采用门诊随访或电话随访的方式,末次随访时间为2019年7月5日。总生存期(OS)为患者自安罗替尼治疗开始至死亡或末次随访的时间。无进展生存期(PFS)为患者自安罗替尼治疗开始至明确为PD的时间。
1.2.4 不良反应评价 根据美国国立癌症研究院通用毒性标准4.0评价不良反应。
1.3 统计学处理 应用SPSS 19.0统计软件。计数资料用率表示,组间比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线,生存率比较采用log-rank检验;采用Cox比例风险回归模型分析安罗替尼治疗复发转移性食管鳞癌患者PFS的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 不同临床特征患者近期疗效比较 22例接受安罗替尼治疗的患者中,ORR为9.1%(2/22),DCR为77.3%(17/22)。不同性别、年龄、PS评分、病理分化程度、安罗替尼治疗线数以及是否远处转移、肝转移、手术、放疗的患者ORR比较,差异均无统计学意义(均P>0.05)。在DCR方面,PS评分0~1分的患者明显高于2~3分的患者,差异有统计学意义(P<0.05);与其他临床特征无关,差异均无统计学意义(均P>0.05),见表1。
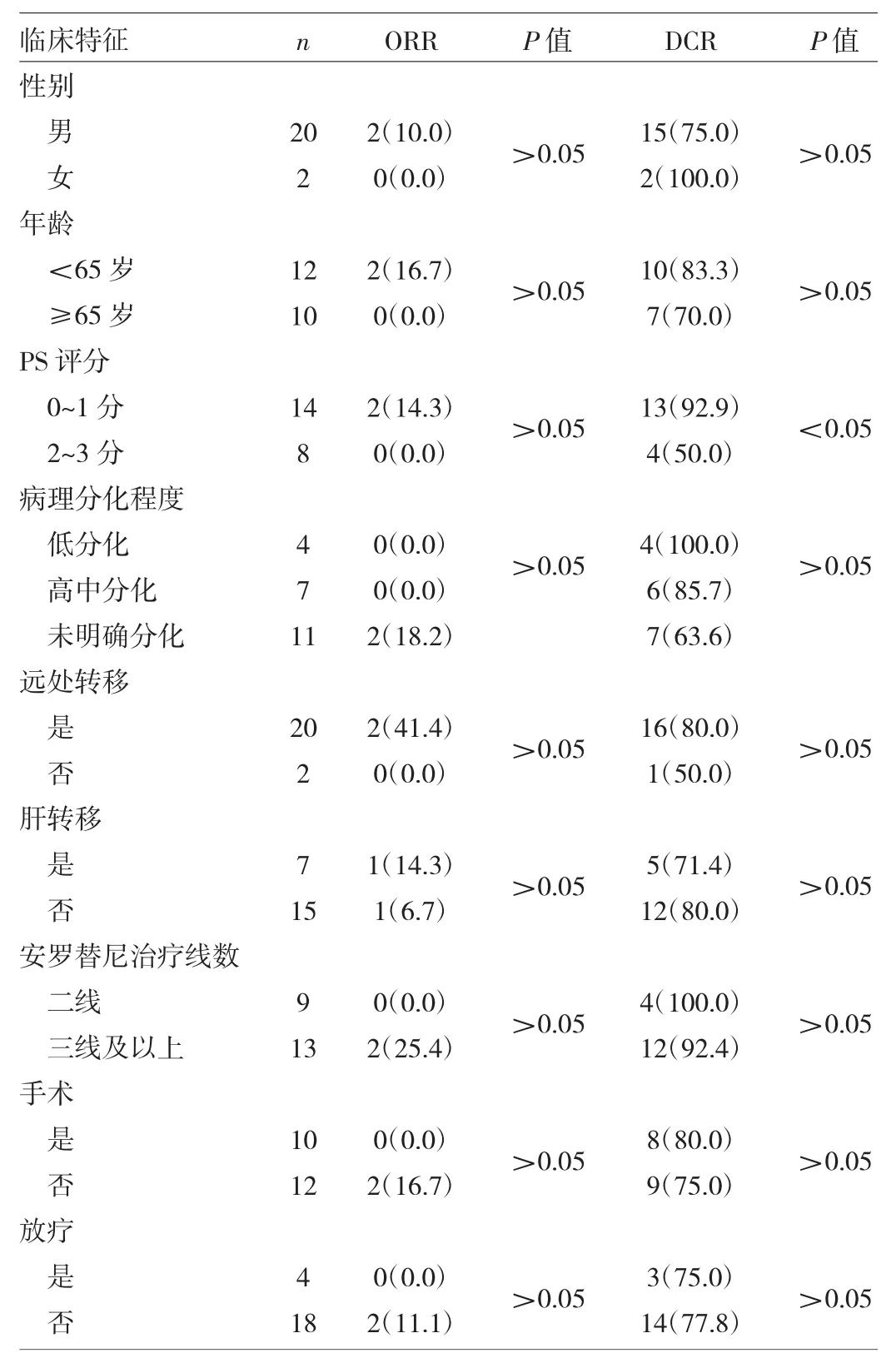
表1 不同临床特征患者近期疗效比较[例(%)]
2.2 生存分析 22例患者中位PFS为4.13个月(95%CI:3.54~4.73),见图 1。进一步分析不同 PS 评分、是否肝转移患者的PFS,发现PS评分0~1分患者中位PFS(4.43个月)明显长于2~3分的患者(1.50个月),生存率比较差异有统计学意义(P<0.05),见图2;无肝转移患者中位PFS(4.43个月)明显长于肝转移患者(3.53个月),但生存率比较差异无统计学意义(P>0.05),见图3。Cox比例风险回归模型分析结果显示,PS评分、肝转移是安罗替尼治疗复发转移性食管鳞癌患者PFS的独立影响因素,见表2。
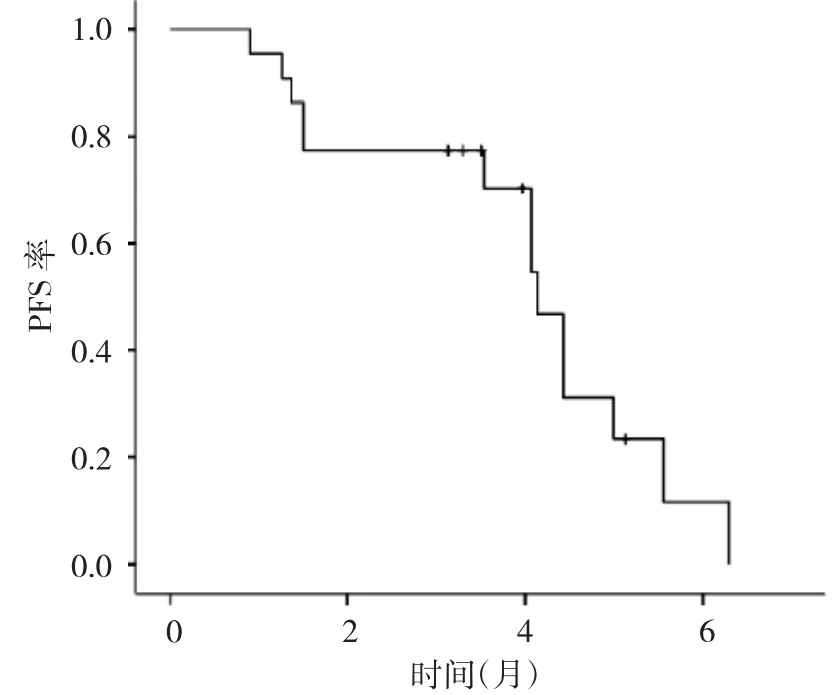
图1 安罗替尼治疗食管鳞癌患者的PFS曲线
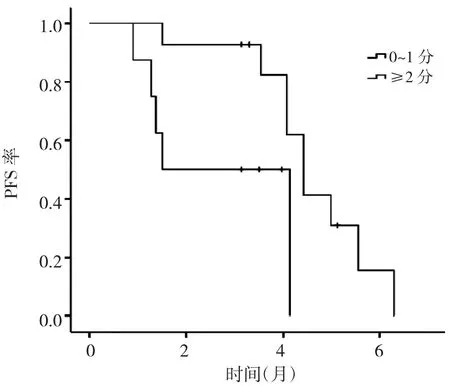
图2 安罗替尼治疗不同PS评分食管鳞癌患者的PFS曲线
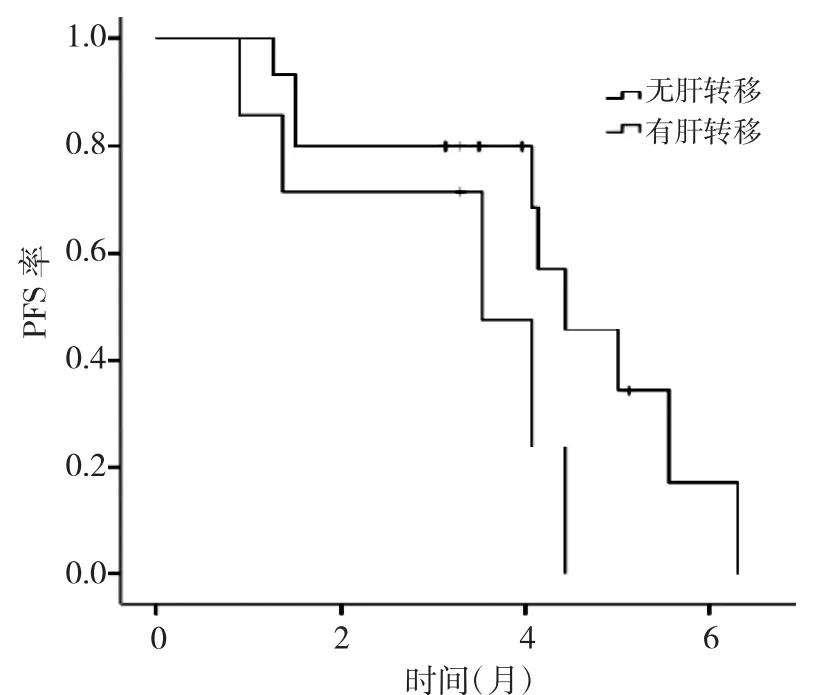
图3 安罗替尼治疗是否肝转移食管鳞癌患者的PFS曲线
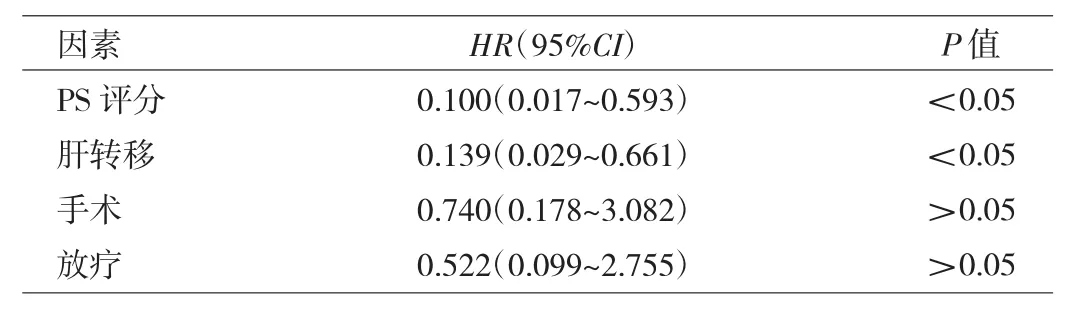
表2 影响安罗替尼治疗复发转移性食管鳞癌患者PFS的Cox比例风险回归模型分析
2.3 不良反应 安罗替尼治疗的常见不良反应有乏力、高血压、食欲下降、体重下降等,均为Ⅰ~Ⅱ级不良反应,经对症治疗后改善或恢复正常,见表3。其中1例患者因高血压、1例患者因乏力和食欲下降不能耐受而下调安罗替尼剂量至10mg后耐受良好。
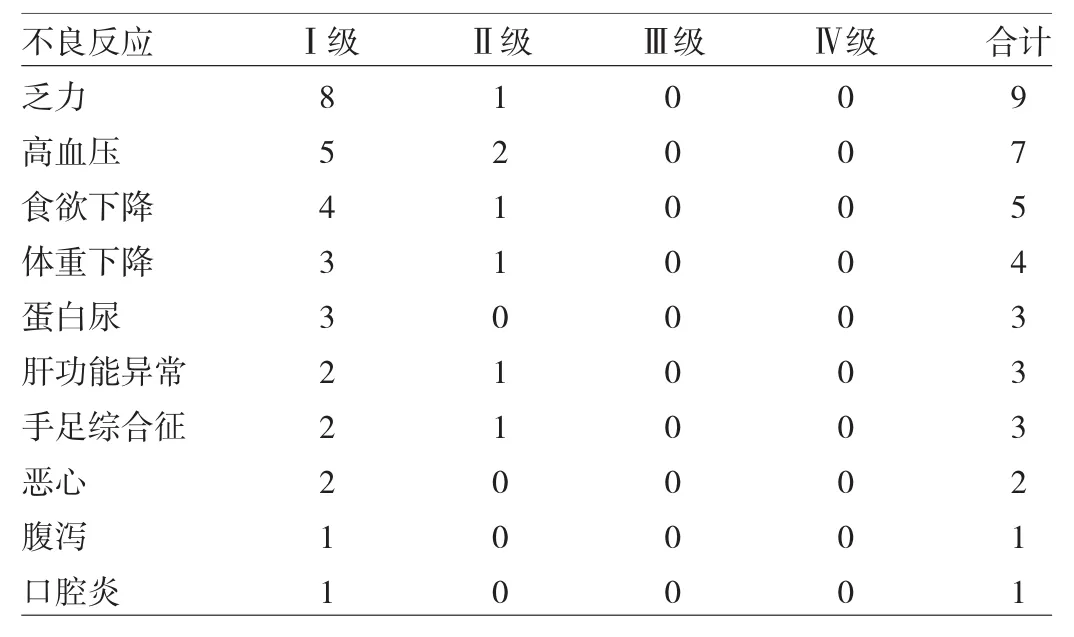
表3 22例复发转移性食管鳞癌患者安罗替尼治疗常见不良反应(例)
3 讨论
安罗替尼作为一种新型的多靶点小分子酪氨酸激酶抑制剂,在抗血管生成、抑制肿瘤细胞增殖和转移等方面具有良好的疗效。目前已在多种实体瘤中开展临床研究,包括非小细胞肺癌、软组织肉瘤、甲状腺髓样癌、食管鳞癌等。基于ALTER 0303的研究结果[7],2018年5月9日,中国食品药品监督管理局正式批准单药安罗替尼用于晚期非小细胞肺癌患者的三线及以上治疗。对化疗后出现进展的晚期食管鳞癌患者,目前临床上尚缺乏的标准治疗方案。
安罗替尼治疗二线及以上晚期食管鳞癌的ALTER1102研究在2019年美国临床肿瘤学会会议上公布了研究数据,这是一项随机、双盲、多中心、安慰剂平行对照的Ⅱ期临床试验,主要评估安罗替尼作为单药治疗在中国二线及以上晚期食管鳞癌患者中的疗效及安全性[8]。该研究共入组165例患者,其中安罗替尼组110例,安慰剂组55例,1例未服药;结果显示安罗替尼组中位PFS较安慰剂组延长1.61个月(3.02个月比1.41个月,HR=0.46,P<0.01),达到了主要研究终点;ORR 分别为7%和4%(P>0.05),DCR分别为64%和18%(P<0.01)。而本研究罗替尼治疗的ORR为9.1%,DCR为77.3%,中位PFS为4.43个月,较ALTER1102研究结果长一些,可能与临床实践中复查时间相对不严格而造成进展评估时间往后延迟有关。本研究有3例患者在二线安罗替尼治疗中联合了其他药物治疗,1例联合替吉奥,1例联合雷替曲塞,1例联合可瑞达免疫治疗,但这3例患者的疗效仅为SD,耐受性均良好。本研究亚组分析发现,PS评分0~1分、无肝转移的患者应用安罗替尼治疗的PFS要长一些。但由于样本量较少,仍需要进一步研究证实。在安全性方面,本研究患者在接受安罗替尼治疗中未出现Ⅲ级及以上的不良反应,仅2例患者因不能耐受而下调剂量至10mg。本研究患者出现的不良反应主要有乏力、高血压、食欲下降、体重下降等。ALTER1102研究结果显示,安罗替尼组Ⅲ级以上不良反应发生率为39%,主要有高血压(16%)、食欲下降(6%)和低钠血症(4%)。目前看来,安罗替尼在食管癌治疗中的安全性尚好,但需要特别注意抗血管靶向药物相关的不良反应。
目前关于食管癌靶向治疗的研究不多,除了安罗替尼,主要的靶向药物还有阿帕替尼、吉非替尼、西妥昔单抗。食管癌的重要通路包括VEGF通路和EGFR通路。食管鳞癌患者EGFR高表达,但是抗VEGF通路的靶向药物(如吉非替尼、西妥昔单抗等)均未取得成功[9-10]。阿帕替尼是抗VEGF靶向药物,小样本单臂研究结果显示,62例食管鳞癌患者阿帕替尼治疗的ORR为24.2%,DCR为74.2%;中位PFS和OS分别为115、209d;Ⅲ、Ⅳ级不良反应发生率为59.7%[11]。该研究结果表明了阿帕替尼在食管鳞癌中应用的疗效,但由于样本量小、不良反应较大,目前中国抗癌协会临床肿瘤学协作专业委员会指南上仅以2B类证据推荐阿帕替尼用于晚期食管鳞癌的二线及以上治疗。免疫治疗是当前热点,近年来有不少研究在食管癌中应用PD-1抑制剂治疗,并取得了较好的疗效。KEYNOTE-028研究纳入23例PD-L1阳性的食管癌患者并给予帕博利珠单抗单药治疗,总ORR为30%,其中鳞癌、腺癌患者的ORR分别为29%和40%[12]。在其他食管癌免疫治疗的研究中,纳武利尤单抗[13]、国产的抗PD-1单抗卡瑞利珠单抗等均展现了食管癌免疫治疗的前景。
综上所述,安罗替尼治疗复发转移性食管鳞癌有效、患者耐受性良好且不良反应相对较小。
——中国居民收入分配中的逆向调节机制

