猪FTO基因多态性与肉质性状的关联分析
杨又兵,卞军平,吴 燕,娄 然,李世豪
(1.河南科技大学 动物科技学院,河南 洛阳 471023;2.洛阳市动物遗传育种重点实验室,河南 洛阳 471023)
脂肪量和肥胖相关基因(fat mass and obesity associated gene,FTO)广泛地分布在动物的各个组织之间,在畜禽的生长发育、能量代谢平衡和脂肪代谢等方面发挥重要的作用[1-2]。首先,FTO基因是在小鼠上克隆出来的[3],随后,Stratakis等[4]在研究人类染色体时发现FTO基因与肥胖相关,Frayling等[5]发现FTO基因的过度表达会提高动物采食量,其他研究者[6-8]发现FTO基因在控制肥胖方面发挥关键作用。在一些生物医学研究领域,猪是研究肥胖相关基因的最好模型,大量研究[9-11]发现,猪的脂肪性状影响着猪的肉质性状。后来,随着FTO基因的深入研究,该基因也被越来越多的学者应用在猪的脂肪沉积和肉品质研究中。例如:Tao等[12]在研究不同品种的猪FTO基因mRNA表达量水平发现品种对猪FTO基因mRNA表达量具有显著影响;Chung[13]研究了FTO基因的SNP位点与韩国牛的肉质性状的关联性,研究表明位于外显子3上的g.125550A>T位点与肉质性状具有显著相关;Fan等[14]在研究巴克夏猪×大白猪资源群体时表明FTO基因第3外显子c.594C>G位点各基因型与肌内脂肪总量存在极显著相关性。

1 材料与方法
1.1 试验动物
从河南省洛阳市豫西黑猪保种场抽取100~120 kg的27头豫西黑猪个体(编号HB),从河南洛阳正大食品有限公司抽取100~120 kg的27头长白猪个体(编号HL),收集血样,-20 ℃保存备用。屠宰测量27头豫西黑猪个体的背膘厚度(BFT)、45~60 min内的pH1、24 h熟化后的pH24、滴水损失,评定其肉色和大理石纹。
1.2 主要试剂和仪器
全血基因组DNA提取试剂盒、2×TaqPCR Master Mix、BstuⅠ限制性内切酶、TaiⅠ限制性内切酶和DL 2 000 bp Maker均来自于鼎国昌盛生物技术有限责任公司(中国北京)。
pHS-3C酸度计:郑州宝晶电子科技有限公司(中国河南)。背膘检测仪:北京天翔飞域科技有限公司(中国北京)。高速台式离心机:上海安亭科学仪器(中国上海)。电泳仪:鼎国昌盛生物技术有限责任公司(中国北京)。梯度PCR扩增仪:BIO-RAD公司(中国上海)。凝胶成像分析系统:BIO-RAD公司(中国上海)。
1.3 引物设计
根据NCBI(https://www.ncbi.nlm.nih.gov/)上已经公布的FTO基因第3外显子(GenBank:FJ668708)和第4内含子的序列(GenBank:AM931150),利用Primer Premier 5.0软件(http://www.premierbiosoft.com/),设计FTO基因第3外显子和第4内含子的引物,由上海生工生物工程股份有限公司合成。第3外显子(c.594C>G)目的片段为240 bp,退火温度为56.8 ℃,引物序列为:Bstu I-F:5′-TGCAGATTGAGACCATCCAG-3′;Bstu I-R:5′-TCTTCCCCATGCCAAAGTAG-3′。第4内含子(g.276G>T)目的片段为397 bp,退火温度为58.4 ℃,引物序列为:TaiI-F:5′-ACAGGCCCTGAAGAGGAAAG-3′;TaiI-R:5′-AGTAACCTGGAGTTCCTGTGG-3′。
1.4 PCR扩增
利用全血基因组DNA提取试剂盒提取DNA,提取步骤参照其说明书,以BstuⅠ-F和BstuⅠ-R为上下游引物进行第3外显子(c.594C>G)序列的PCR扩增,以TaiⅠ-F和TaiⅠ-R为上下游引物进行第4内含子(g.276G>T)序列的PCR扩增。PCR反应体系(20 μL)为: 2×TaqPCR Master Mix 10 μL,上下游引物各0.7 μL(10 μmol·L-1,DNA模板1 μL,加ddH2O至终体积20 μL。PCR扩增条件为:94 ℃预变性4 min;94 ℃变性30 s,退火温度退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4 ℃保存。扩增产物经2%的琼脂糖凝胶电泳,用凝胶成像仪观察扩增条带。
1.5 PCR-RFLP酶切反应
用限制性内切酶对FTO的两个SNP位点进行酶切分型,酶切体系(15 μL):PCR产物10 μL,10×Buffer 2 μL,限制性内切酶(10 U·μL-1)0.5 μL,ddH2O补足至15 μL。反应条件为:BstuⅠ的酶切体系于37 ℃水浴消化3.5 h,用50%的聚丙烯凝胶电泳检测基因型,TaiⅠ的酶切体系于65 ℃水浴消化3.5 h,用2%的琼脂糖凝胶电泳,凝胶成像仪观察记录,判断基因型。
1.6 肉质性状测定
参照1987年制订的肉质评定标准修改方案《猪肉质评定方法》对27个豫西黑猪样本的肉质性状进行评定。背膘厚:用背膘检测仪测定肩部膘厚、胸腰部膘厚、臀部膘厚,取三处平均值;pH值:用pHS-3C酸度计测定45~60 min的pH1,24 h熟化后的pH24;滴水损失:宰后2 h内,取腰椎处背最长肌修整样称取质量m1,在4 ℃下悬挂24 h,用洁净滤纸吸取表层液体后称取质量m2,滴水损失=[(m1-m2)/m1]×100%;用美式比色卡进行肉色和大理石纹评分。
1.7 数据统计分析
用POPGENE 32计算等位基因频率、有效等位基因(Ne)、基因多样性(Shannon’s information index,I)、期望杂合度(expected heterozygosity,He)和Nei氏多样性指数,用PIC-CALC计算多态信息含量(polymorphic information content,PIC),用SPSS 20.0的χ2检验验证c.594C>G位点和g.276G>T位点的Hardy-Weinberg平衡,对各基因型之间的肉质性状数据进行显著性分析,数据结果以X±SD表示。
2 结果与分析
2.1 FTO基因的PCR扩增结果
FTO基因的c.594C>G位点和g.276G>T位点经PCR扩增后,扩增产物用2%的琼脂糖凝胶电泳检测,检测结果见图1和图2,图1和图2中的扩增条带清晰明亮,扩增条带单一,无非特异性条带,可用作下一步的酶切反应。
2.2 FTO基因的PCR-RFLP酶切结果
用BstuⅠ限制性内切酶对c.594C>G位点进行酶切,酶切产物用50%的聚丙烯凝胶进行检测,结果见图3。用TaiⅠ限制性内切酶对g.276G>T位点进行酶切,酶切产物用2%的琼脂糖凝胶电泳检测,结果见图4。图3的BstuⅠ限制性内切酶将c.594C>G位点的扩增产物切割成3个片段(240 bp/156 bp/84 bp),出现两个等位基因C(240 bp)和G(156 bp/84 bp),3种基因型即CC基因型(只240 bp一种条带)、CG基因型(同时出现240 bp、156 bp和84 bp三种条带)和GG基因型(出现156 bp和84 bp两种条带)。图4的TaiⅠ限制性内切酶将g.276G>T位点的扩增产物切割成3个片段(397 bp/275 bp/122 bp),出现两个等位基因G(275 bp/122 bp)和等位基因T(397 bp),3种基因型即GG基因型(出现275 bp和122 bp两种条带)、GT基因型(同时出现397 bp、275 bp和122 bp三种条带)和TT基因型(只397 bp一种条带)。

M,DL2000 bp DNA marker;1~4,豫西黑猪;5~6,长白猪。M, DL2000 bp DNA marker; 1-4, Henan western black pigs; 5-6, Landrace pigs.图1 c.594C>G位点PCR产物扩增结果Fig.1 PCR amplification results of SNPs (c.594C>G)
M,100 bp DNA marker;1~2,豫西黑猪;3~4,长白猪。M, 100 bp DNA marker; 1-2, Henan western black pigs; 3-4, Landrace pigs.图2 g.276G>T位点PCR产物扩增结果Fig.2 PCR amplification results of SNPs (g.276G>T)
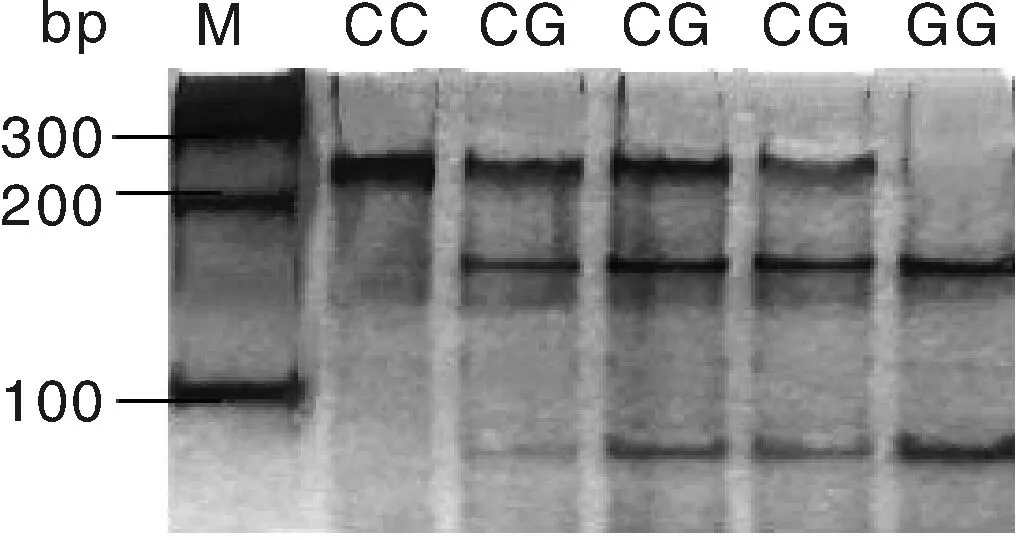
M, 100 bp DNA marker.图3 c.594C>G位点酶切结果Fig.3 Enzyme digestion results of c.594C>G

M, 100 bp DNA marker.图4 g.276G>T位点酶切结果Fig.4 Enzyme digestion results of g.276G>T
2.3 FTO基因的基因型频率与基因频率
表1是FTO基因c.594C>G位点和g.276G>T位点的基因型频率与基因频率。在c.594C>G位点,豫西黑猪和长白猪都有CC基因型、CG基因型和GG基因型3种基因型,优势等位基因为C等位基因,豫西黑猪的CG基因型频率(0.681 8)高于长白猪(0.533 3),CC基因型(0.181 8)和GG基因型(0.136 4)的频率低于长白猪(0.266 7、0.200 0)。三种基因型χ2检验的Hardy-Weinberg平衡检验P=0.320,频率符合Hardy-Weinberg平衡(P>0.05)。在g.276G>T位点,豫西黑猪和长白猪都检测到TT基因型、GT基因型和GG基因型3种基因型,优势等位基因为T等位基因,3种基因型χ2检验的Hardy-Weinberg平衡检验P=0.125,说明g.276G>T位点基因型频率符合Hardy-Weinberg平衡(P>0.05)。
表1FTO基因的基因型频率和基因频率
Table1The genotype frequency and allele frequency ofFTOgene

位点LocusHBHLχ2Pc.594C>G基因型频率Genotype frequencyCC0.181 80.26672.2800.320CG0.68180.5333GG0.13640.2000基因频率Allele frequencyC0.52270.5333G0.47730.4667g.276G>T基因型频率Genotype frequencyGG0.11110.14824.1560.125GT0.62960.4074TT0.25930.4444基因频率Allele frequencyG0.42590.3519T0.57410.6481
2.4 FTO基因的遗传多态性分析
本研究对豫西黑猪和长白猪群体FTO基因的c.594C>G位点和g.276G>T位点进行了遗传多态性分析,分析结果见表2。一般通过多态信息含量(PIC)、杂合度(He)和有效等位基因数(Ne)来衡量一个群体的遗传多态性[19],参照Nagy等[20]的研究,PIC>0.5为高度多态;PIC在0.25~0.50时为中度多态;PIC<0.25时为低度多态。在c.594C>G位点上,豫西黑猪群体和长白猪群体的PIC值分别为0.374 5、0.373 9,两个群体都属于中度多态。在g.276G>T位点上,豫西黑猪群体和长白猪群体的PIC值分别为0.369 4、0.352 1,两个群体都具有多态性,都属于中度多态。在c.594C>G位点上,豫西黑猪的期望杂合度(He)和基因多样性指数(I)分别为0.510 6,0.499 0,较长白猪的期望杂合度(0.514 9)和基因多样性指数(0.497 8)无太大差别。在g.276G>T位点上,豫西黑猪的期望杂合度He(0.498 3)和基因多样性指数(0.682 1)都略高于长白猪在该位点上的期望杂合度(0.464 7)和基因多样性(0.648 6)。
表2FTO基因的遗传多态性
Table2The genetic polymorphic ofFTOgene

位点LocusNeIHeNeiPICc.594C>GHB1.99590.49900.51060.49900.3745HL1.99120.49780.51490.49780.3739g.276G>THB1.95700.68210.49830.48900.3694HL1.83860.64860.46470.45610.3521
2.5 FTO的遗传多态性与豫西黑猪肉质性状的关联分析
本研究将FTO基因c.594C>G位点和g.276G>T位点的多态性与豫西黑猪的肉质性状进行了关联分析,分析结果见表3。在c.594C>G位点,等位基因G能显著提高肉色,CG基因型和GG基因型个体在肉色上显著高于CC基因型个体(P<0.05),在其他性状上3种基因型并没有表现出差异显著性,但从表3可知,等位基因G能增加背膘厚度和提高大理石纹的评分,在背膘厚度和大理石纹上,GG基因型的个体>CG基因型>CC基因型。在g.276G>T位点,TT基因型、GT基因型和GG基因型这3种基因型在背膘厚度、pH1、pH24、滴水损失、肉色和大理石纹上没有显著性差异。但等位基因G能增加背膘厚度,提高pH1和pH24的值,降低滴水损失。在背膘厚度、pH1和pH24上,GG基因型的个体>GT基因型>TT基因型,滴水损失上,TT基因型的个体>GT基因型>GG基因型。
3 讨论
影响肉品质的因素主要有饲养管理、营养水平、屠宰条件和遗传因素,遗传因素中的肉质性状相关基因在影响肉品质方面起着至关重要的作用[21]。FTO基因是影响猪肉品质的一个遗传因素,周波[22]通过原核表达探讨猪FTO基因的组织表达规律表明了FTO基因在一定程度上能显著促进猪脂肪细胞的增殖和分化,影响猪肌内脂肪的沉积。
表3FTO基因不同基因型对豫西黑猪肉质性状的影响
Table3Effect of different genotypes in theFTOgene on meat quality traits

位点Locus基因型Genotype背膘厚度Backfatthickness/mmpH1pH24滴水损失Driploss%肉色Colorscore大理石纹Musclemarblingc.594C>GCC37.67±15.056.26±0.565.84±0.054.00±1.812.75±0.52 b3.00±0.71CG38.42±6.966.69±0.405.93±0.212.36±1.853.54±0.63 a3.09±0.67GG43.52±12.946.46±0.345.90±0.163.93±2.403.63±0.48 a3.25±0.65g.276G>TTT38.34±12.746.55±0.425.85±0.143.43±2.013.45±0.603.20±0.63GT39.00±7.916.59±0.475.94±0.212.68±2.003.36±0.683.00±0.63GG39.50±5.426.92±0.085.97±0.111.12±0.114.00±0.713.75±1.06
同列数据后没有相同字母的表示差异显著(P<0.05)。
The data in the same columns with different letters showed significant difference (P<0.05).
现阶段,改善畜禽的肉质性状是动物育种的一个重要目标[23-24],而脂肪量与肥胖相关基因是影响猪肉肉质性状的一个重要基因,它在动物的各个组织中都能够广泛表达。付言峰等[25]研究了FTO基因对猪脂肪沉积的影响,发现在背肌中FTO基因mRNA的表达量极显著高于其他任何组织,而且FTO基因的表达量越高,脂肪含量就越高。全建平等[26]利用高分辨率熔解曲线(HRM)技术检测了374头杜洛克猪FTO基因的基因型,表明FTO基因的多态性与杜洛克猪的背膘厚、瘦肉率、饲料转化率、体高、体长等性状显著相关。本研究中,在c.594C>G位点的CG基因型和GG基因型个体在肉色上显著高于CC基因型个体(P<0.05),等位基因G能增加背膘厚度和提高大理石纹的评分,促进猪的脂肪沉积。在g.276G>T位点,等位基因G能增加背膘厚度,提高pH1和pH24的值,降低滴水损失。
豫西黑猪作为河南省一个正在大力推广的地方类群,有着它自身独特的优势,但是,由于其生长速度缓慢,养殖户们为了提高短期内的经济效益,对当地的豫西黑猪进行了长期的杂交选育,给豫西黑猪导入了过多的外来血源。昔奋攻等[27]对6个品种的猪的肥胖基因位点进行了RFLP分析,他表示“商品猪大多为瘦肉型猪,中国大部分的地方猪种都为脂肪型猪,具有较强的脂肪蓄积能力”。其他一些研究[28-29]表明,FTO基因对杜洛克群体的背膘性状具有显著影响,但是FTO多态性对猪的脂肪沉积性状的影响在不同地区不同品种的猪之间存在着很大的差异性,这也与Fu等[30]的试验结果相同,即FTO基因多态性与苏钟猪的脂肪沉积性状相关,但是在某些品种的猪上,这种相关性存在很大的差异。例如,FTO基因对杜洛克的脂肪沉积有极大的显著性[31],但是,FTO基因在槐猪背膘厚度这一性状上并不存在显著相关性[32]。在本研究中,c.594C>G位点的G等位基因能够增加猪肉的背膘厚度,改善肉色,提高大理石纹评分,有利于脂肪的沉积,g.276G>T位点的G等位基因能增加猪肉的背膘厚度,有效降低猪肉的滴水损失,大大增加了猪肉的系水能力。但是,豫西黑猪和长白猪在c.594C>G位点的优势等位基因都为C等位基因,在g.276G>T位点的优势等位基因都为T等位基因,这说明了豫西黑猪混入了长白猪的部分血源,它自身的脂肪蓄积能力有所降低。本研究通过对豫西黑猪FTO基因多态性的分析,说明FTO多态性确实与豫西黑猪的肉质性状具有相关性,本研究能够为豫西黑猪的保种选育提供理论依据。
4 结论
在本研究中,FTO基因的c.594C>G位点和g.276G>T位点都具有中度多态性,豫西黑猪在FTO基因c.594C>G位点和g.276G>T位点存在遗传多态性。在c.594C>G位点,CG基因型和GG基因型个体在肉色上显著高于CC基因型个体(P<0.05),G等位基因能够增加猪肉的背膘厚度,改善肉色,提高大理石纹评分,有利于脂肪的沉积。在g.276G>T位点,等位基因G能增加背膘厚度,提高pH1和pH24的值,降低滴水损失,增加了猪肉的系水能力。研究说明,FTO基因的c.594C>G位点和g.276G>T位点可以作为豫西黑猪肉质性状选育的潜在分子遗传标记,可为豫西黑猪群体后代肉质性状的选择提供参考依据。

