碳青霉烯类药物对铜绿假单胞菌生物膜形成及其基因表达的影响
周蓓蓓 王冲 杜佳 周翠 刘海洋 张艺之 周铁丽,*
(1 温州医科大学附属第一医院医学检验中心,温州 325035;2 浙江省肿瘤医院检验科,杭州 310000)
铜绿假单胞菌(Pseudomonas aeruginosa)是社区获得性感染和院内感染的常见条件致病菌,可以引起泌尿道感染、伤口感染、腹腔感染和呼吸道感染等[1]。近年来,抗菌药物的不规范使用甚至滥用导致包括铜绿假单胞菌在内的绝大多数致病菌出现耐药甚至多重耐药的现象,使得可供治疗的有效抗菌药物越来越少,这给临床治疗带来了巨大的挑战[2]。
铜绿假单胞菌具有较强的生物膜形成能力,可引起急慢性感染。有研究表明,至少65%的慢性铜绿假单胞菌感染与生物膜形成有关[3]。细菌生物膜是细菌吸附于惰性物体的内外表面后,细胞不断聚集并分泌一些基质把自身包裹,形成的细菌细胞结构群体,是细菌为了适应环境的一种生存方式,具有很强的耐药性,能够抵抗百倍以上正常药物剂量[4],从而给临床治疗带来了极大的挑战。
碳青霉烯类药物可以与β-内酰胺酶稳定结合,是治疗大部分革兰阴性菌感染的有效药物,为目前治疗铜绿假单胞菌感染的首选药物。Giwercman等[5]研究表明生物膜状态下的铜绿假单胞菌比浮游状态产生更多的β-内酰胺酶。Bagge等[6]也证实了铜绿假单胞菌在生物膜状态时ampC基因的表达上调了150倍。重要的是,碳青霉烯类药物可以显著降低铜绿假单胞菌的生物膜形成能力[3]。
铜绿假单胞菌感染的治疗过程中,生物膜可普遍形成于导管以及医疗装置表面,因此需要更多的研究为临床治疗提供一定的依据。本实验旨在探讨碳青霉烯类药物作用于铜绿假单胞菌生物膜后,对其细胞形态学和基因表达的影响,从而为临床治疗铜绿假单胞菌感染提供基本理论和分子基础。
1 材料与方法
1.1 实验菌株
本研究中的3 株铜绿假单胞菌(菌株编号为TL1552、TL1728和TL947)均分离自温州医科大学附属第一医院临床患者的创面标本,VITEK-2 Compact全自动微生物分析仪进行菌株鉴定和初步药敏试验,其仅对碳青霉烯类药物敏感。
1.2 抗菌药物最低抑菌浓度(mininal inhibotory concentration, MIC)检测
琼脂稀释法检测菌株对头孢他啶、头孢吡肟、阿米卡星、庆大霉素、妥布霉素、环丙沙星、左氧氟沙星、亚胺培南和美罗培南的最低抑菌浓度(MIC),结果判读参照美国临床实验室标准化研究协会(CLSI) 2016(M100-S26)标准[7]。每种药物重复做3次试验。铜绿假单胞菌ATCC27853为药敏试验质控菌株,购自卫生部临床检验中心。
1.3 静态生物膜形成能力检测
参照O'Toole[8]的方法进行生物膜实验。铜绿假单胞菌在含有LB肉汤的无菌96孔细胞培养板中,室温下静态培养过夜。然后,用100mL含有1%葡萄糖和0.3%酪氨酸的M63B1-GCAA培养基进行1:50稀释,置于无菌96孔细胞培养板,37℃,培养24h。将96孔细胞培养板中的培养液弃去,用蒸馏水冲洗两次,去除上层浮游细菌。分别取10μL不同浓度的亚胺培南和美罗培南(5×MIC, 10×MIC)与190μL新鲜配置的含1%葡萄糖的LB肉汤共同加入到96孔细胞培养板中,37℃,培养24h。将96孔细胞培养板中的培养液弃去,用蒸馏水冲洗两次,去除上层浮游细菌。生物膜附着于孔的表面,用125mL含有0.1%结晶紫的染液室温下染色15min。将96孔细胞培养板中的染液弃去,用蒸馏水冲洗两次。用33%的醋酸溶解贴壁细胞的结合色素,随后检测595nm的吸光度。同时进行两个独立的实验,每个实验中每株菌重复做2个复孔,结果取4个复孔的平均值。
1.4 扫描电子显微镜分析
挑取血平板上过夜培养的单个菌落配置1.5×108CFU/mL浊度的菌液。将1cm×1cm无菌盖玻片放入无菌6孔细胞培养板中,取100μL上述菌液和1900μL新鲜配置的含1%葡萄糖的新鲜LB肉汤共同加入6孔细胞培养板中,37℃,培养24h。将6孔细胞培养板中的培养液弃去,用蒸馏水冲洗两次,去除上层浮游细菌。分别取100μL 5×MIC的亚胺培南和美罗培南与1900μL新鲜配置的含1%葡萄糖的LB肉汤共同加入到6孔细胞培养板中,37℃,培养24h。将6孔细胞培养板中的培养液弃去,用蒸馏水冲洗两次,去除上层浮游细菌。将盖玻片放置于含有戊二醛的无菌6孔细胞培养板中4℃固定2h,再用系列梯度浓度(50%、70%、80%、90%、95%和100%)乙醇分别脱水6min,之后将盖玻片放置于无菌6孔细胞培养板中,35℃干燥1~2h。用扫描电子显微镜观察碳青霉烯类药物作用后铜绿假单胞菌的形态学改变。
1.5 RNA提取、转录组测序分析及生物膜相关基因分析
选取铜绿假单胞菌临床分离株TL1552用于转录组测序。提取未经碳青霉烯类药物处理以及经5×MIC亚胺培南或美罗培南处理的TL1552生物膜状态下总RNA。将用于RNA转录组测序文库制备的总RNA经过DNAase处理,之后参照mRNA-Seq Sample Preparmion Kit试剂盒的操作说明进行,构建所需的cDNA文库。转录组文库测序及差异基因分析均由深圳华大基因科技有限公司完成,所用的测序平台是Illumina-HiSeq 2500/4000。将测序所得原始图像的数据转化成序列数据,并采用生物信息学工具对RNA测序数据进行基因注释分析。
1.6 实时荧光定量PCR
提取铜绿假单胞菌总RNA,逆转录成cDNA后用于实时荧光定量PCR分析。应用qRT-PCR的方法来验证碳青霉烯类药物处理后铜绿假单胞菌生物膜形成相关多糖合成基因algD、pslA和pelA表达的差异情况。proC作为内参基因,每个标本的目的基因以及内参基因均做3个复孔。
1.7 统计学分析
所有数据通过SPSS 17.0进行统计分析。对于静态生物膜形成能力试验,用非配对t-检验(双侧检验),P<0.05为有统计学意义。
2 结果
2.1 抗菌药物最低抑菌浓度检测
检测结果显示3株铜绿假单胞菌(TL1552、TL1728和TL947)只对碳青霉烯类药物敏感(MIC为1mg/L),其中TL947对美罗培南MIC为2mg/L,对其他临床常用抗菌药物均耐药。
2.2 静态生物膜形成能力检测
结果发现5×MIC的亚胺培南和美罗培南均能显著地抑制铜绿假单胞菌生物膜的形成(图1)。但是,5×MIC的亚胺培南和美罗培南对已经形成的生物膜却只产生轻微影响,并不能导致其存活力的显著下降,直到10×MIC或者是更高浓度时才出现铜绿假单胞菌生物膜细胞存活力的显著下降(图2)。
2.3 扫描电子显微镜分析

图1 5×MIC碳青霉烯类药物对铜绿假单胞菌生物膜形成的影响Fig.1 Effect of 5×MIC carbapenems on the biofilm formation of P.aeruginosa

图2 10×MIC碳青霉烯类药物对铜绿假单胞菌生物膜形成的影响Fig.2 Effect of 10×MIC carbapenems on the biofilm formation of P.aeruginosa
扫描电子显微镜结果(图3)显示,5×MIC碳青霉烯类药物不能杀死铜绿假单胞菌生物膜细胞,但镜下显示生物膜细胞数量以及形态发生显著改变,包括数量减少、细胞变大、变圆以及空泡化等。为了验证生物膜细胞的变化是否是暂时性改变,本研究将5×MIC碳青霉烯类药物处理后的铜绿假单胞菌生物膜继续在不含抗菌药物的培养基上孵育6h,结果发现生物膜细胞的形态基本上得到了恢复并且存活力也没有显著变化。
2.4 差异基因表达,亚胺培南和美罗培南处理后铜绿假单胞菌的基因功能分析

图3 扫描电子显微镜下铜绿假单胞菌生物膜细胞形态变化Fig.3 Morphological changes of P.aeruginosa biofilm cells under scanning electron microscopy
转录组测序分析显示5×MIC亚胺培南处理后(图4),上调的基因有732个,下调的基因764个,基因功能分析后发现有功能的上调基因有55个,下调的基因72个(表1);5×MIC美罗培南处理后(图5),上调的基因有802个,下调的基因866个,其中具有功能的上调基因有59个,下调的基因69个(表2)。经过碳青霉烯类药物处理后,可引起蛋白质涉及运输、代谢及周转的基因在表达水平上出现总体的上调趋势,大量参与氨基酸转运及代谢的基因如甘氨酸脱氢酶、β-丙氨酸-丙酮酸氨基转移酶、2-异丙基苹果酸合酶LeuA、天冬酰胺合成酶B(AsnB)等表达水平均有所上调,而只有相对较少的参与氨基酸转运及代谢的基因表达水平下调。经碳青霉烯类药物处理后,主要参与生物膜细胞形成、发展的基因表达水平有所下调。此外,还可影响参与细胞应激反应的基因表达水平。
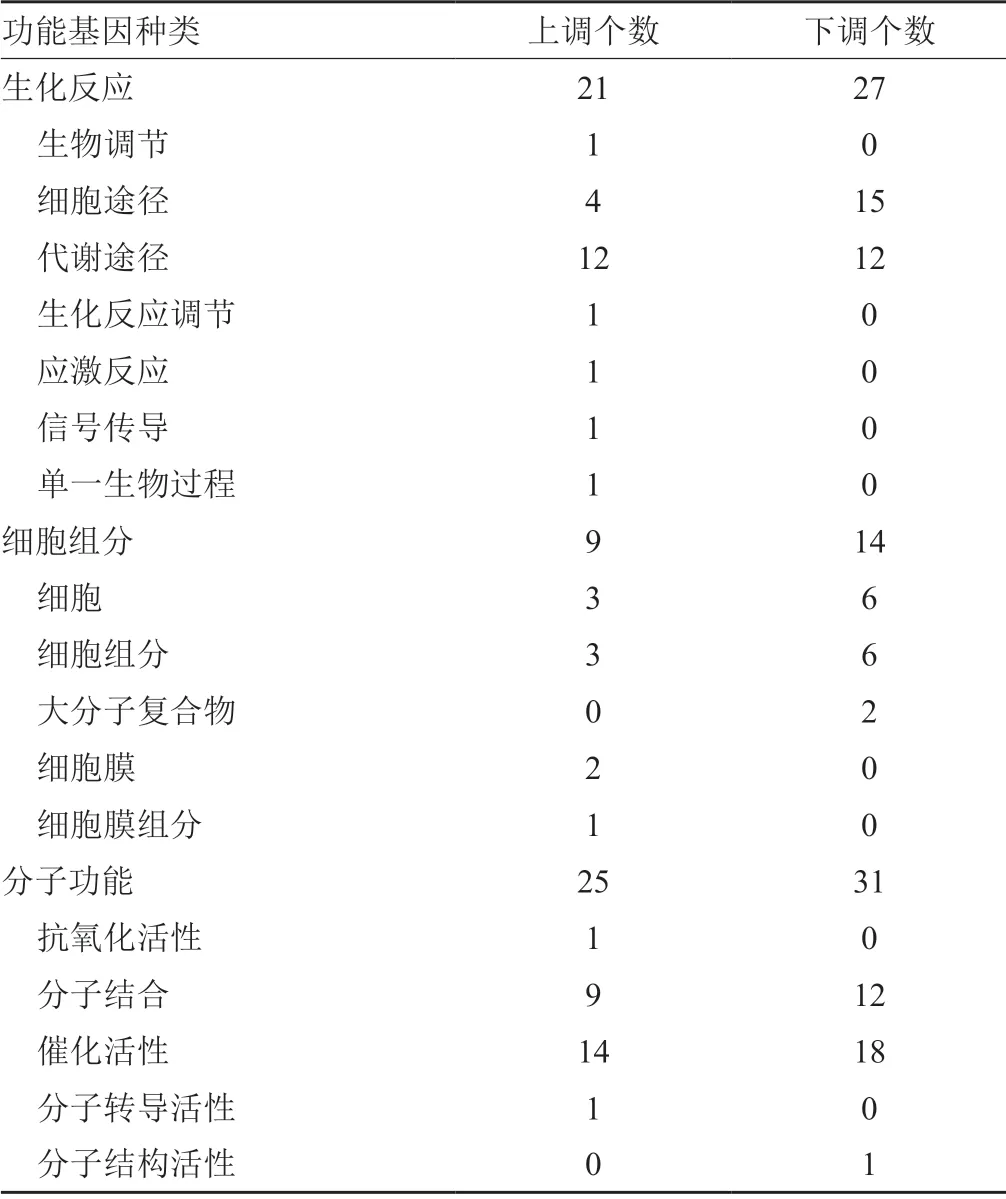
表1 亚胺培南处理后基因功能分析Tab.1 Analysis of gene function after IPM treatment
2.5 实时荧光定量PCR对转录组测序结果的验证

图4 亚胺培南处理后差异基因表达分析Fig.4 Differential gene expression analysis after IPM treatment

图5 美罗培南处理后差异基因表达分析Fig.5 Differential gene expression analysis after MEM treatmen

表2 美罗培南处理后基因功能分析Tab.2 Analysis of gene function after MEM treatment
qRT-PCR结果(表3)显示处理组多糖合成相关基因algD、pslA和pelA的表达量均比校准状态低,这与转录组测序的结果一致。
3 讨论
铜绿假单胞菌是医院感染的重要条件致病菌,能引起人和动物的感染,也是慢性感染的常见致病菌,治疗非常困难[9]。近年来,由于抗菌药物的广泛使用甚至滥用,使得铜绿假单胞菌耐药现象越来越严重;同时,铜绿假单胞菌极易黏附在人体组织或者是医学材料表面进而形成生物膜,引发机体的免疫反应,从而造成组织损伤以及持续性慢性感染,这些都给临床上治疗铜绿假单胞菌引起的感染造成了较大的困难。
静态生物膜形成能力检测结果发现5×MIC碳青霉烯类药物能抑制铜绿假单胞菌生物膜的形成但对已经形成的生物膜影响甚微,表明无论菌株对抗菌药物是否具有耐药性,如果已经形成生物膜感染,治疗都存在较高的难度,因此防止生物膜形成的预防性抗菌药物治疗是至关重要的。同时,扫描电子显微镜结果显示,5×MIC碳青霉烯类药物能导致铜绿假单胞菌生物膜细胞变大、变圆、空泡化以及数量减少,但去除药物后继续孵育发现生物膜细胞形态基本恢复正常,表明了碳青霉烯类药物只能引起生物膜细胞暂时的形态改变,去除碳青霉烯类药物后可使生物膜恢复正常状态,这提示了临床治疗时持续用药的重要性。

表3 碳青霉烯类药物处理后多糖合成相关基因的相对表达量Tab.3 Expressions of polysaccharide synthesis related genes in three P.aeruginosa isolates with carbapenems treatment
转录组测序分析及基因功能分析发现,经过碳青霉烯类药物处理后,可引起涉及运输、代谢及周转蛋白质的基因的表达水平总体出现上调趋势,主要参与生物膜细胞形成、发展的基因表达水平有所下调。qRT-PCR结果发现处理组多糖合成相关基因algD、pslA和pelA的表达量均比校准状态低,这与转录组测序的结果一致。algD基因是编码藻酸盐生物合成酶操纵子上的第一个基因,该基因的转录激活与藻酸盐的合成密切相关[10],研究表明在铜绿假单胞菌生物膜形成过程中藻酸盐可以起到重要作用[11]。pslA是铜绿假单胞菌psl操纵子上的第一个基因,可编码葡萄糖转移酶;pelA是铜绿假单胞菌高度保守序列,研究表明这两个多糖合成相关基因均在铜绿假单胞菌的黏附以及生物膜形成中起到关键作用[12-13]。
此外,有研究表明[14-15]碳青霉烯类药物的主要作用位点为铜绿假单胞菌菌体内的青霉素结合蛋白(PBPs),碳青霉烯类药物处理后,铜绿假单胞菌生物膜细胞呈现出球形改变,这可能是由于碳青霉烯类药物与细胞壁上PBP2结合,抑制了糖苷酶以及内肽酶的作用,这两者可以参与细胞壁黏肽的合成。细胞壁合成被破坏后,进而导致细菌形成了无壁球状体[16]。这个结果从分子水平上解释了扫描电子显微镜下所观察到的铜绿假单胞菌生物膜细胞形态变化。
总之,本研究表明经碳青霉烯类药物处理后的铜绿假单胞菌通过一系列复杂的调控途径,使其生物膜细胞出现短暂的形态学改变。这些结果将为我们治疗由铜绿假单胞菌引起的生物膜感染奠定基础。

