β-catenin和MMP-3在骨性关节炎软骨组织中的表达及临床意义
菅永志,叶林,李跃军,顾培伦,高鹏,羊鹏飞,杨童,王维山,董金波*
(1石河子大学医学院第一附属医院骨科中心,新疆 石河子 832000;2 河南省郑州市骨科医院,河南 郑州 450000;3 河南省三门峡市中心医院,河南 三门峡 472000;4 中国人民解放军69026部队,新疆 乌鲁木齐 830000)
骨关节炎(osteoarthritis,OA)是中老年常见的关节疾病,好发于人体承重关节,主要表现为关节软骨缓慢破坏、关节间隙变窄、关节周围的增生。关节内软骨细胞和细胞外基质的退行性改变造成软骨组织内的成分丢失是造成关节软骨破坏的原因之一。承重区域的软骨因成分改变导致软骨功能下降,进而造成软骨破坏[1]。在骨关节炎的各个发病部位中,以膝关节最容易发病,且疾病负担较重[2]。β-连环蛋白(β-catenin)是Wnt信号通路中的核心分子,广泛分布于软骨组织中的细胞质、细胞核及细胞膜中。β-catenin信号通路的激活虽然对软骨生长发育早期十分重要,但过度的激活会导致关节软骨退变和OA形成[3]。基质金属蛋白酶3(MMP-3)由软骨细胞和滑膜细胞分泌,是MMPS家族的重要成员。它广泛参与蛋白水解活性,包括蛋白聚糖、纤维连接蛋白、层粘连蛋白、凝胶、Ⅳ型胶原和IX型胶原等的降解过程[4-5],是关节软骨损伤的重要因素之一。
本实验通过对临床OA患者及正常膝关节软骨中β-catenin和MMP-3的表达测定,初步探讨其在OA发病过程中的重要作用及二者的相互关系,将有助于OA发生机理的全面认识,为OA的预防、诊断、治疗提供科学的理论基础和实验依据。
1 材料与方法
1.1 研究对象
研究对象选自2017年8月-2018年4月在石河子大学医学院第一附属医院、第三附属医院的行骨科手术的83名患者。术前详细与患者及其家属谈话并签署知情同意书,患者本人及家属自愿捐献废弃的关节软骨用于科学研究,本研究通过了石河子大学医学院第一附属医院伦理委员会审查。2018年4月16日至2018年6月15日在石河子大学医学院病理科免疫组化室进行HE染色及免疫组化试验。
1.1.1 OA的诊断标准
OA的诊断标准需严格按照2007年版《骨关节炎诊治指南》[6]的相关标准(表1)进行诊断,包括病史采集、查体、影像学检查、实验室检查等。

表1 膝关节骨关节炎的诊断标准Tab.1 Diagnostic criteria for knee osteoarthritis
注:综合临床、实验室及X线检查,符合1+2条或1+3+5+6条或1+4+5+6条,可诊断为膝关节骨关节炎。
1.1.2 排除标准
在纳入研究前,完善相关检查,排除患有以下疾病患者:创伤性骨关节炎、肝肾功能异常、恶性肿瘤和全身感染性疾病,以及检测前2个月内使用皮质类固醇的病史。
1.1.3 研究分组
对已经纳入的83例患者依据OA的诊断标准,将83例患者分为OA组和NOA组。OA组取自因骨性关节炎而行人工膝关节置换术(TKA)(图1)或因OA行关节镜治疗的手术患者。入院患者以发放问卷的形式收集OA患者的西安大略和麦克马斯特大学(Western Ontario and McMaster University,WOMAC)骨关节炎指数,见附录。WOMAC骨关节炎指数评分主要涉及疼痛、僵硬和关节功能3个大的方面,3个方面又细分为24个评价指标,每个评价指标各占10分,总分240分。由于WOMAC指数主要关注OA对患者日常生活影响,当患者主观症状越重时,WOMAC骨关节炎指数评分越高,我们可以根据评分高低大致判断患者的OA分度:轻度<80分,中度80-120分,重度>120分,通过收集WOMAC骨关节炎指数评分表,将70例OA患者,分为轻度OA组13例,中度组22例,重度组30例,NOA组13例,取自创伤后导致的截肢或部分软骨脱落使用关节镜可取出的患者。整理患者一般资料(表2)。
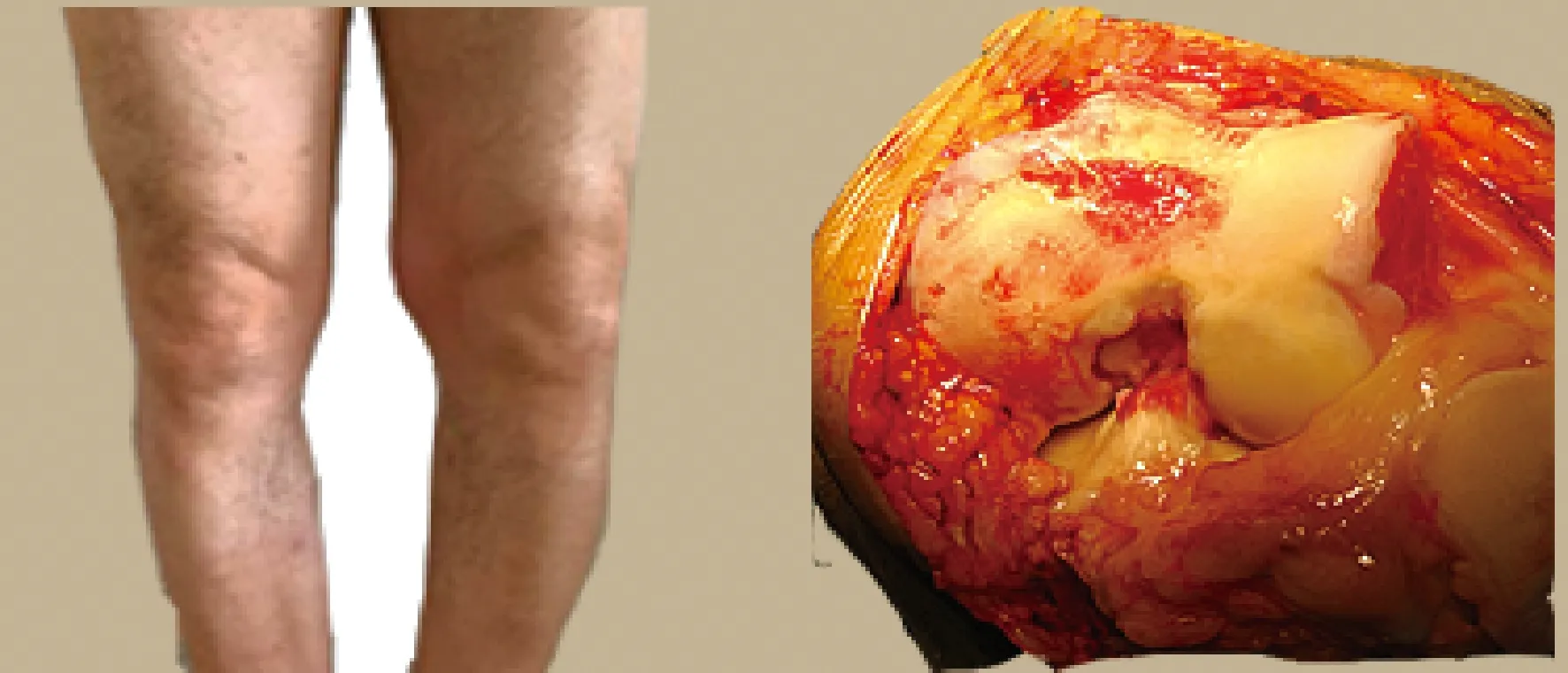
图1 重度OA患者膝关节大体标本及术中髁部软骨面Fig.1 Gross knee specimens and intraoperative ankle cartilage surface in patients with severe OA
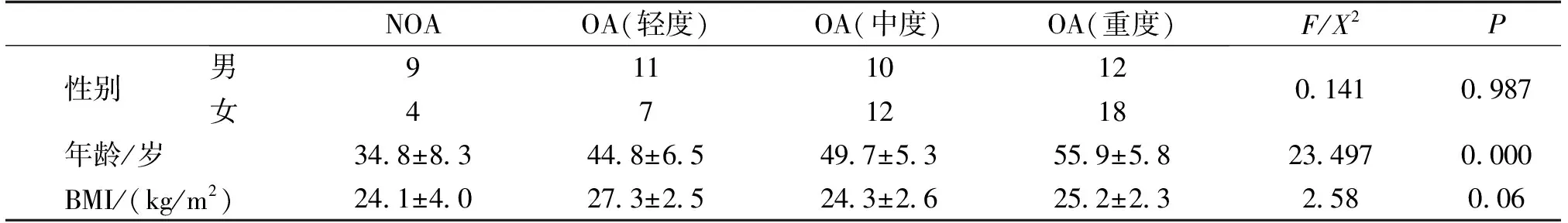
表2 各组基本资料对比Tab.2 Comparison of basic data of each group
1.2 实验方法
1.2.1 抗体
鼠抗人β-catenin单克隆抗体、一抗MMP-3。二抗HRP标记山羊抗兔。
1.2.2 病理切片的制作
(1)取材:将取下的关节软骨组织标本修成0.3 cm~0.5 cm厚度,置于4%多聚甲醛(新配制)固定液中,环境温度为4摄氏。(2)脱钙:置于经DEPC处理的15%-20%EDTA脱钙液中进行常规脱钙4周。(3)脱水:(70%乙醇→80%乙醇→90%乙醇→95%乙醇Ⅰ→95%乙醇Ⅱ→正丁醇→无水乙醇Ⅰ→无水乙醇Ⅱ)各2小时→二甲苯Ⅰ1.5小时→二甲苯Ⅱ2小时,石蜡Ⅰ→石蜡Ⅱ各2小时(60 ℃),同时抽真空。石蜡包埋,4 μm厚连续组织切片,切片放在生物组织展烤烘片。
1.2.3 HE染色
(1)石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、无水乙醇Ⅰ10 min、无水乙醇Ⅱ10 min、95%酒精5 min、90%酒精5 min、80%酒精5 min、70%酒精5 min、蒸馏水洗。(2)苏木素染细胞核:切片入Harris苏木素染3~8 min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨水返蓝,流水冲洗。(3)伊红染细胞质:切片入伊红染液中染色1~3 min。(4)脱水封片:将切片依次放入95%乙醇I 5 min、95%乙醇Ⅱ 5 min、无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ5 min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片,并进行Mankin评分。
1.2.4 MMP-3和β-catenin免疫组化染色
(1)石蜡切片置于65 ℃烘箱中烘片2 h,脱蜡至水,用PBS缓冲液洗3次,每次5 min。(2)切片置于EDTA缓冲液中微波修复,中火至沸后断电,间隔10 min后低火至沸。(3)自然冷却后再次使用PBS缓冲液洗3次,每次5 min。(4)将切片置于3%过氧化氢溶液中,在室温下避光孵育10 min。(5)PBS缓冲液洗3次,每次5 min,甩干后5% BSA封闭20 min。(6)去除BSA液,每张切片加入约50 μL稀释的一抗覆盖组织,4 ℃过夜。(7)PBS缓冲液洗3次,每次5 min。去除PBS缓冲液液,每张切片加50~100 μL相应种属的二抗,37 ℃孵育50 min。(8)PBS缓冲液洗3次,每次5 min。去除PBS缓冲液,每张切片加50~100 μL新鲜配制DAB溶液,显微镜控制显色。显色完全后,蒸馏水或自来水冲洗,苏木素复染,1%盐酸酒精分化(约1 s),自来水冲洗,氨水返蓝,流水冲洗。(9)切片经过梯度乙醇75%、90%、100%、100%,各10 min,脱水干燥,二甲苯透明,自然晾干后中性树胶封固,加盖玻片。苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。
1.3 切片结果的判读
切片结果由石河子大学医学院第一附属医院病理科两名病理专家独立阅片并进行评价。HE染色结果通过Mankin评分进行评价。Mankin评分是在显微镜下从软骨结构、软骨细胞、软骨基质染色以及潮线完整性4个方面对软骨进行计分评价。四方面评分进行相加得出每张切片的Mankin评分,总分在0-3分为正常软骨,4-7分为轻度OA软骨,8-11分为中度OA软骨,12-14分为重度OA软骨。免疫组化评价评价采用半定量积分法[7],即对每张切片的阳性细胞数及阳性细胞着色强度进行计分,同一标本下两者乘积来确定蛋白的表达强度。染色强度评分为不着色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分。阳性细胞率即阳性细胞占计数细胞的比例,每张切片以计数10个40×10倍视野细胞为准进行观察,根据切片上阳性细胞数量的不同分级:无着色细胞或仅有﹤10%观察细胞着色,计为0分;阳性细胞数10%~25%,计为1分;阳性细胞数25%~50%,计为2分;阳性细胞数50%~75%,计为3分;阳性细胞数75%~100%,计为4分。表达强度评分:0、1、2、3、4分为阴性,6、8、9、12分为阳性,分值越高我们认为检测蛋白的表达强度越高。
1.4 统计学分析
2 结果
2.1 大体形态和HE染色后镜下观察的结果
NOA组:可以看到正常软骨面光滑,附有清亮的滑液,质韧,弹性好,呈半透明状态。关节内滑膜健康,无游离体形成,关节软骨边缘整齐,无骨赘和滑膜硬结。镜下可以看到正常软骨细胞排列规律整齐,呈椭圆形或近圆形,软骨表面区域、移行区、辐射区、矿化区各个区域层次明确,潮标清晰完整。轻度OA:外观可以看到软骨表面欠光滑,呈淡黄色,附有淡黄色滑液,质韧,弹性欠佳。有轻度软化灶,可见微小裂纹。滑膜轻度充血,无游离体形成,关节软骨边缘欠整齐。镜下可以看到,表面区软骨细胞稀疏,移行区软骨细胞排列散乱。潮标欠清晰。中度OA:外观可以看到软骨表面毛糙、干燥,呈暗黄色,失去光泽,附有黄褐色滑液。质硬,弹性差。软骨表面有中度软化灶,有小块软骨缺失,裂纹增宽加深。滑膜中度充血,伴增生,部分关节内有大小不一的游离体形成,关节软骨不整齐,有骨赘和滑膜硬结形成。镜下可以看到软骨表面毛糙,表面区软骨细胞排列凌乱,部分表面区和移行区软骨细胞脱落丢失。辐射区细胞排列混乱无原有辐射状,辐射区与移行区界限不清,潮标模糊,不连续。
重度OA:外观可以看到软骨表面粗糙、干燥,呈暗黄色,失去光泽,附有少量黄褐色浑浊滑液。软骨表面有大块软骨缺失,缺失处有骨质裸露,骨质表面有一层类似纤维软骨的软骨面,其余剩余软骨表面有不同程度的裂纹并延伸至骨质表面。滑膜重度充血,伴大量增生,关节内多有大小不一的游离体形成,关节软骨边界不清,有大量骨赘和滑膜硬结形成。镜下可以看到软骨表面粗糙,表面区软骨细胞排列凌乱,大部分表面区和移行区软骨细胞脱落丢失。软骨表面区域、移行区、辐射区、矿化区各个区域层次混乱不清,界限消失,潮标模糊且不连续。
对HE染色的软骨纵切面切片(图2)进行Mankin评分,表明通过临床判断收集的OA组患者的Mankin评分明显高于NOA组(Z=-5.727,P<0.001)(表3),各组软骨Mankin评分,基本与WOMAC骨性关节炎指数评分呈正性同步趋势,表明软骨严重程度与OA病程发展紧密相关,这说明我们收集的标本完全符合实验的要求,为后面进一步探究β-连环蛋白和MMP-3与OA的关系奠定了坚实的实验基础。
表3 不同时期软骨Mankin评分Tab.3 Cartilage Mankin scores at different times
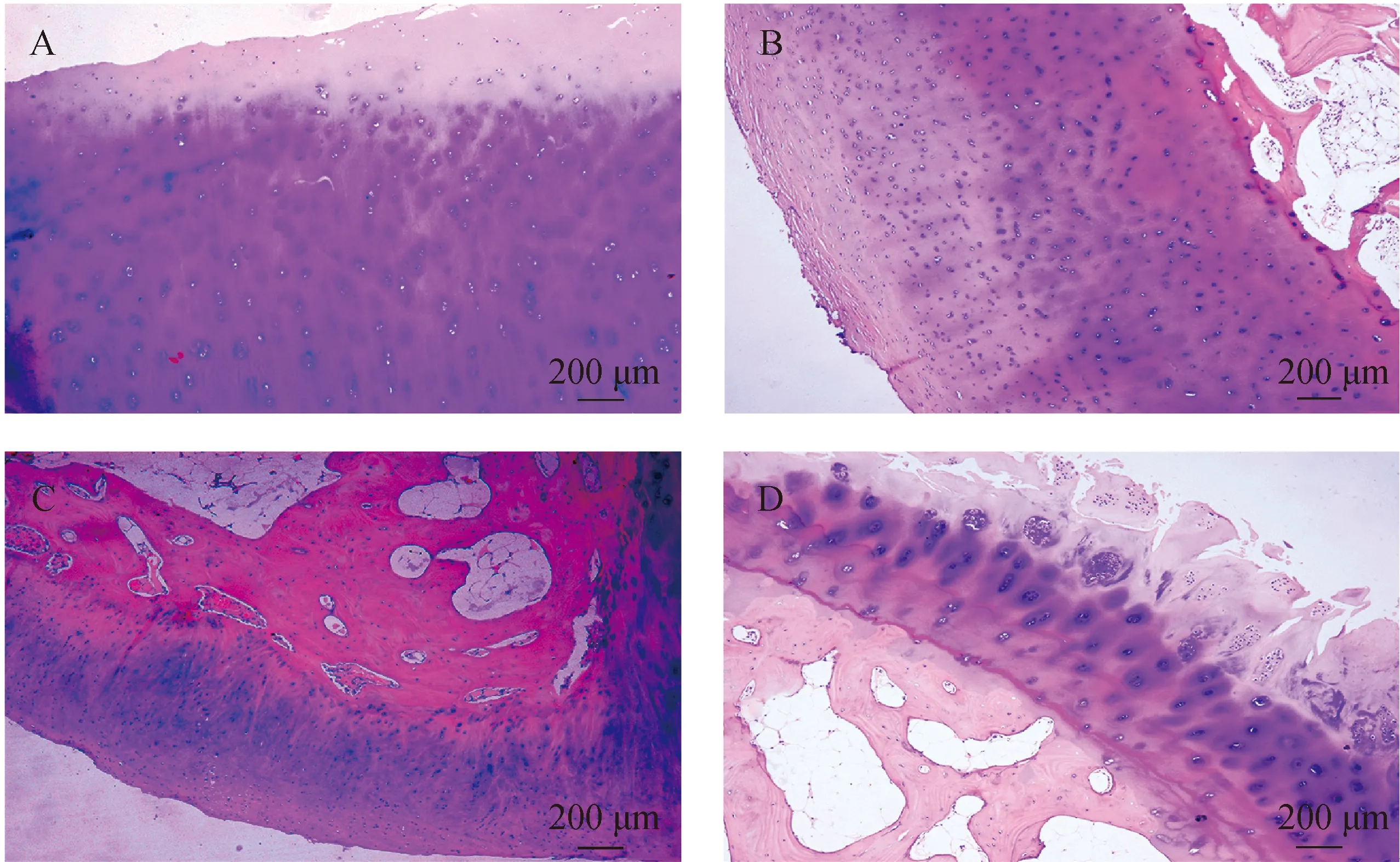
A—正常关节软骨;B—轻度OA;C—中度OA;D—重度OA(40×)图2 正常膝关节及不同程度OA膝关节软骨HE染色结果Fig.2 HE staining results of normal knee joint and different degrees of OA knee articular cartilage
2.2 免疫组化结果
2.2.1 免疫组化法检测软骨组织中β-catenin的表达强度
β-连环蛋白在正常细胞内广泛分布于细胞核、细胞膜、细胞质中。而在OA软骨细胞中多表表达于细胞核内,质内少量表达,在OA软骨细胞外基质中有游离的β-连环蛋白分子(图3)。结果表明,NOA组有2例为阳性,阳性率为15.38%;OA组关节软骨中,轻度OA组10例阳性,阳性率55.56%;中度OA组17例,阳性率77.27%,重度OA组27例,阳性率90.00%。采用卡方检验或确切概率法进行统计分析(P值带有“*”为确切概率法结果,不带的为卡方检验结果),结果OA观察组与非OA对照组软骨组织中β-连环蛋白的表达相比,X2=19.053,差异有统计学意义(P<0.001);NOA与轻度OA组相比较,X2=3.58,差异有统计学意义(P<0.05);NOA与中度OA组相比较,X2=12.612,差异有统计学意义(P<0.001);NOA与中度OA组相比较,X2=22.997,差异有统计学意义(P<0.001);轻度OA与中度OA组相比较,X2=2.128,差异无统计学意义(P=0.145);轻度OA与重度OA组相比较,X2=7.556,差异有统计学意义(P<0.05);中度OA与重度OA组相比较,X2=1.579,差异无统计学意义(P<0.209)(表4)。

A—正常组;B—轻度OA;C—中度OA;D—重度OA(200×)图3 各组软骨组织中β-catenin表达情况Fig.3 Expression of β-catenin in cartilage tissue of each group
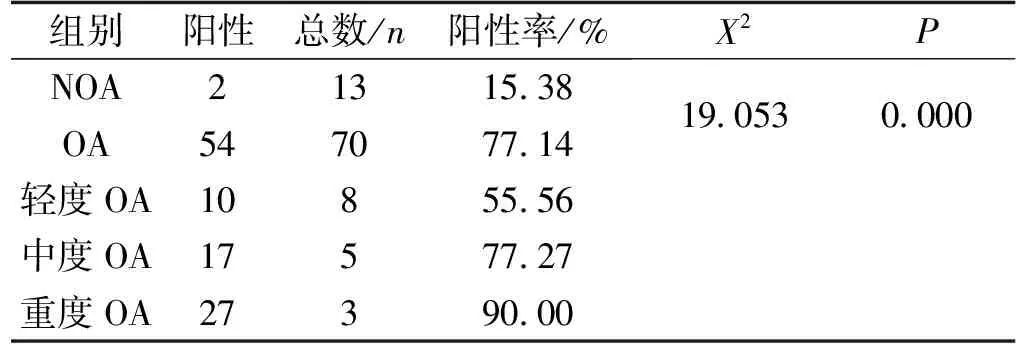
表4 各组β-catenin免疫组化染色结果Tab.4 Results of immunohistochemical staining of β-catenin in each group
2.2.2 软骨组织中MMP-3蛋白表达的免疫组化检测
MMP-3的阳性表达主要集中在细胞质中,呈黄色或棕色颗粒。因OA发病过程中MMP-3作用于细胞外基质中的胶原纤维,所以我们猜测在OA软骨细胞外基质中也存在游离的MMP-3分子。在软骨细胞外基质中应该也能看到颜色变化(如图4)。
结果表明,NOA组有1例为阳性,阳性率为7.69%;OA组关节软骨中,轻度OA组9例阳性,阳性率50.00%;中度OA组14例阳性,阳性率63.64%,重度OA组25例阳性,阳性率83.33%。采用卡方检验或确切概率法进行统计分析(P值带有“*”为确切概率法结果,不带的为卡方检验结果),结果OA组与非OA对照组软骨组织中MMP-3的表达相比,X2=16.803,差异有统计学意义(P<0.001);NOA与轻度OA组相比较,X2=6.183,差异有统计学意义(P<0.05);NOA与中度OA组相比较,X2=10.443,差异有统计学意义(P<0.05);NOA与重度OA组相比较,X2=21.708,差异有统计学意义(P<0.001);轻度OA与中度OA组相比较,X2=0.753,差异无统计学意义(P=0.385);轻度OA与重度OA组相比较,X2=6.050,差异有统计学意义(P<0.05);中度OA与重度OA组相比较,X2=2.626,差异无统计学意义(P=0.105)(表5)。
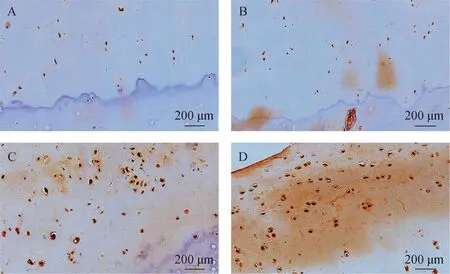
A—正常组;B—轻度OA;C—中度OA;D—重度OA(200×)图4 各组软骨组织中MMP-3表达情况Fig.4 MMP-3 expression in cartilage tissue of each group
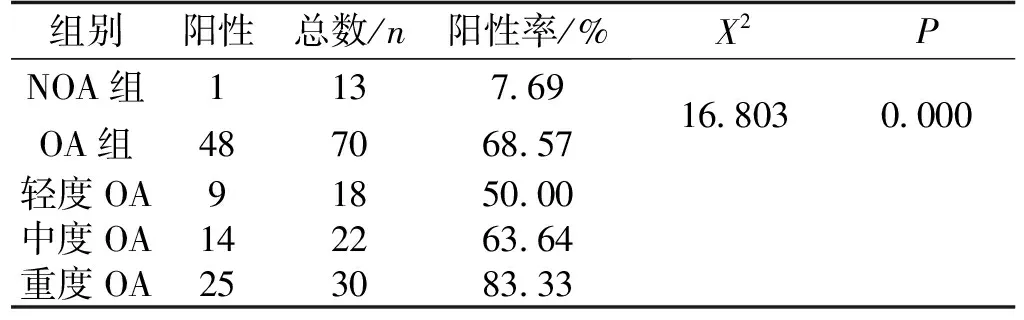
表5 各组MMP-3免疫组化染色结果Tab.5 Immunohistochemical staining results of each group of MMP-3
2.3 统计学分析两种蛋白的相关性
采用Spearman相关分析法我们发现,OA患者软骨组织中β-catenin的表达与WOMAC指数呈现正相关(r=0.787,P<0.001),MMP-3的表达与WOMAC指数同样呈现正相关(r=0.753,P<0.001),结果表明β-catenin、 MMP-3与骨关节炎的病程变化密切相关;同理我们将OA患者软骨组织中β-catenin、MMP-3的表达与Mankin评分做相关分析发现,β-catenin的表达与Mankin评分呈显著正相关(r=0.840,P<0.001);MMP-3的表达与Mankin评分呈显著正相关(r=0.774,P<0.001),说明β-catenin、 MMP-3与OA软骨的病变紧密相关;对β-catenin、 MMP-3在OA软骨中表达强度进行相关分析,发现同样存在呈显著正相关(r=0.891,P<0.001),提示我们两种蛋白可能存在协同作用共同参与骨关节炎的进展过程(图5)。
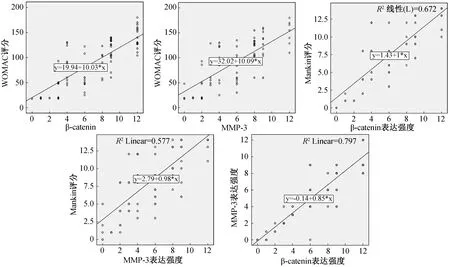
图5 OA软骨组织中β-catenin、MMP-3、WOMAC指数及Mankin评分之间的关系Fig.5 Relationship between β-catenin,MMP-3,WOMAC index and Mankin score in OA cartilage tissue
3 讨论
膝骨关节炎是中老年常见的退行性骨关节疾病,对我国6个城市的居民进行流行病学调查结果中膝骨关节炎总患病率为28.7%,其中男性23.5%,女性32.8%[8]。多种因素与骨性关节炎发生有关,比如年龄、肥胖、性别、吸烟、饮酒等。目前被普遍所接受的观点是膝骨关节炎的病因和发病机制尚未阐明,其治疗在早期因仍然缺乏有效的药物,所以主要依靠局部热敷、烤电、抗炎止痛等对症治疗。因此发病机制的深入研究及研发有效的治疗药物是十分必要的。近年来研究证实,骨关节炎的发病和进展是由力学和生物学因素共同作用下软骨细胞、细胞外基质及软骨下骨3者降解和合成正常偶联失衡的结果。蛋白降解酶学说目前虽然不能解释软骨破坏的全部原因,但是不论软骨的哪个部位以何种形式发生退变,都不能脱离蛋白降解酶的病理作用。此次我们通过实验检测了骨关节炎(OA)和非骨关节炎(NOA)组中β-连环蛋白和MMP-3蛋白的表达,应用统计学分析,探讨β-连环蛋白和MMP-3在OA发病机制中的作用及其相互关系如下。
3.1 OA的发病机制与关节内软骨的关系
关节软骨(articular cartilage AC)存在于关节的表面,在动物进化过程中,为了适应生理负荷而产生一种富有弹性的组织。其主要作用包括关节的承重、润滑、吸收震荡以及传递能量到软骨下骨等[9]我们都知道AC由固体和液体物质组成[10]。一般而言,细胞外基质(extracellu matrix,ECM)和软骨细胞是AC的主要组成部分,ECM包括水、胶原纤维、PG、蛋白质、脂肪、糖蛋白和无机盐。胶原网架和水占据了干重的65%~80%和湿重的50%~80%。
AC结构和功能的改变始终贯穿于OA的整个发展过程,大体标本观察我们可以发现AC的退化最终造成软骨面的剥离和磨损严重,一般在膝关节内髁的上下关节面上的软骨完全消失,软骨下骨质裸露,以及新产生的用来代偿正常软骨作用的类纤维软骨组织,其余部位软骨表面可以看到明显的软骨裂隙。继发性OA中AC的变化往往要比原发性OA中AC的变化要更为复杂。在原发性OA的AC中,胶原纤维随着时间的推移和发展,机械性的退变在OA发病机制中起到至关重要的作用。原发性OA中,随着年龄的变化OA中AC出现相应的结构和细胞代谢的变化。KEMPSON等[11]于1982年发现,30~40岁的人群中AC的抗张力强度随着年龄增大而增强,呈现出正相关性。但往后,年龄越大AC的抗张力强度越弱,并提出AC这一改变是由胶原网架与胶原交联共同退变的结果。与此同时,AC细胞分泌的PGs随着年龄增加不断减少造成胶原网架变硬,变脆,容易出现疲劳性的损伤[12-14]。胶原网架的半径会不断增大,半径增大了的胶原网架柔韧性差,硬度高,再加上AC中含水量不断下降,使得AC中的支架结构不能适应的起软骨反复变形的状态,从而出现动态的失衡。与此同时,针对软骨细胞外基质的炎症因子发挥本身的作用,对软骨基质进行破坏来加快OA的发展,原本不能再生的正常软骨不堪重负,直至毁灭。
3.2 Wnt/β-连环蛋白信号通路与骨关节炎的关系
Sharma等[15]早在1973年就在果蝇的胚胎中首次鉴定出了无翅基因wingless。随后于1982 年,Nusse等[16]对无翅基因进行进一步研究,结果发现,int-1是小鼠乳腺腺瘤病毒(MMTV)致乳腺肿瘤的重要整合位点,后来这项研究证实了这个特殊的基因与果蝇的无翅基因同源,并命名为Wnt基因家族。经典Wnt/β-连环蛋白信号通路的一般过程可概括如下:Wnt→Frizzled→Dsh→β-连环素降解复合物解聚(GSK-3β是主要调节因子)核内β-连环蛋白积累→TCF /LEF1 →下游靶基因转录(如MMP3、MMP13、BMP、c-myc、cyclinD1)[17]。β-连环蛋白是细胞内糖蛋白家族的一员。具有多种功能,广泛分布于细胞膜、细胞质和细胞核。Hartmann等[18]应用鸡卵内接种法首次证明Wnt信号与关节形成早期阶段的关系。Day等[19]人的实验结果和HILL等[20]的实验结果表明,动物关节的形成和发育受Wnt9a和Wnt16蛋白调控的Wnt/β-连环蛋白信号通路和Wnt4调控的非经典Wnt信号通路共同调控。还有SPATER等[21]的研究提出,Wnt信号通路与印第安刺猬蛋白的调控作用似乎在关节软骨发育过程起到相互协同的作用。这些发现表明,动物关节软骨的发育比原来的理论更为复杂。研究证实,一些Wnt蛋白在软骨细胞外基质的合成和分解、骨形成和吸收、软骨和骨生物力学等方面发挥了特殊作用[22]。Yuasa等[23]人提出通过Wnt3A可以激活兔AC的Wnt/β-连环蛋白信号通路,使得MMP-3的基因表达增强。与之相一致,2009年Ge X[24]等人通过IL-1β的作用上调了Wnt-5a的表达使得兔AC中MMP-3表达量升高。人骨关节炎关节软骨中β-连环蛋白的表达也很高,软骨细胞胞外基质破坏的原因可能与β-连环蛋白对MMP-3的表达升高有关。
Zhu M等[25]人研究发现,发现β-连环蛋白的过度表达不仅导致小鼠膝关节OA样改变,而且导致软骨细胞中MMP-9、MMP-13和BMP-2基因呈现高表达状态。与之相一致的是,人骨关节炎关节软骨中β-连环蛋白的表达也很高。软骨细胞胞外基质破坏的原因可能与β-连环蛋白(β-catenin)对MMP-2、MMP-3、MMP-7、MMP-9、MT3MP和ADAMTS5的显著表达有关[26]。PAPATHANASIOU等[27]发现激活W状态下的Wnt/β-连环蛋白信号通路,通过高表达MMPs及蛋白聚糖酶5,使得AC中细胞外基质中的部分蛋白质和胶原网架降解,使AC的结构和功能难以维持。
综上所述Wnt/β-连环蛋白信号通路在OA的发病机制中是十分重要的。β-连环蛋白是经典Wnt信号通路的核心分子。上游分子通过β-连环蛋白传递信号,发挥其作用[28]。结果表明,OA组β-连环蛋白的表达明显高于正常组,与以往文献一致[29]。β-连环蛋白的上调间接提示Wnt/β-连环蛋白信号通路在OA软骨组织中被激活,并诱导下游基因MMP的表达。
3.3 MMP-3与骨性关节炎的关系
基质金属蛋白酶家族 (matrix metalloproteinases,MMPs) 是一个庞大的大家族,它们因其需要金属离子辅助的作用而得名。MMP的成员结构非常相似,大多数MMP由5个功能域组成。基质金属蛋白酶3(MMP-3)由软骨细胞和滑膜细胞分泌,是MMPS家族的重要成员。它广泛参与蛋白水解活性,包括蛋白聚糖、纤维连接蛋白、层粘连蛋白、凝胶、Ⅳ型胶原和IX型胶原等的降解过程[5],是关节软骨损伤的重要因素之一。MMP-3的作用不只是自身有破坏软骨基质的作用,高表达状态下还激活了其他MMPs家族成员,产生级联放大效应,从而加重炎性反应,共同降解关节软骨[30]。
本研究结果表明,OA软骨组织中MMP-3的表达明显高于正常组,与骨关节炎的严重程度呈正相关,与以往报道一致[31]。骨性关节炎患者软骨、滑膜和滑液中MMP-3的表达与骨性关节炎病变的严重程度呈正相关[32]。由此进一步证明,软骨组织中的MMP-3的过量表达可直接或间接通过关节液作用于关节软骨及关节内滑膜,加速OA病程的发展。
3.4 软骨组织中β-连环蛋白和MMP-3的相互关系
研究发现,Wnt/β-连环蛋白信号通路调节MMPS家族基因的表达水平[33]。此外,Wnt-3a在培养兔关节软骨中激活Wnt/β-连环蛋白信号可显著提高明胶酶活性,增加mmp-3和mmp-13的表达[23]。MMP-3是MMPS家族的重要成员。
通过统计分析发现,OA软骨组织中β-连环蛋白和MMP-3的表达相似。两者在OA软骨组织中均有高表达,与关节退变程度呈正相关。通过实验组数据整理与回归分析后发现MMP-3和β-catenin的表达之间呈显著正相关关系,进一步证实了Wnt/β-catenin信号通路的激活上调了MMP-3的表达,加速了病程的发展。但有研究证实两者之间在基因水平并无明显相关性,提示我们MMP-3的表达不仅受单一Wnt/β-catenin信号转导通路调控。可能还有其他方法来调节这种复杂机制的表达,有待进一步研究[32]。总的来说在OA病变过程中β-catenin和MMP-3均发挥着重要的作用,β-catenin在参与OA软骨退变的病理变化过程中可能通过干预Wnt信号通路的方式引起MMP-3表达变化。
通过实验结果,我们认为骨关节炎的发病机制不是单一因素,可能涉及多种细胞信号通路,具有复杂性。关节软骨中β-catenin和MMP-3的表达较非骨关节炎组显著增强,且随着OA不断加重这两种蛋白的表达强度不断增强,这两种蛋白可作为OA早期诊断的依据。OA 软骨组织中β-catenin、MMP-3表达呈显著正相关,提示β-catenin、MMP-3共同参与了OA发生发展中软骨组织的破坏,两者对OA的发生可能存在协同作用。基于Wnt/β-catenin 信号通路的靶点治疗可能在 OA 治疗的关键环节中获得突破,后期需加大样本量选取更多靶点及方向进行研究,使理论更加完善,这是我们后期实验的主要任务。

