湿热泄泻模型大鼠的尿液代谢组学研究
彭晓婷,马琪,张晓松,华永丽*,纪鹏,姚万玲,魏彦明*
(1. 甘肃农业大学动物医学院, 兰州 730070; 2. 西南大学动物科学学院,重庆 402460)
湿热泄泻(dampness-heat diarrhea, DHD)是中(兽)医泄泻疾病常见证型之一,症见腹痛泄泻, 泻下急迫;泄而不爽,粪黏腻恶臭;烦渴,尿色黄无力,舌苔黄腻,脉濡数或滑数[1-3]。DHD四季发病,病因复杂,多有外感湿热毒邪、饮食不洁、外感疫疠、喜食肥甘厚腻等[4-5]。DHD缠绵难治易复发,每年可造成巨大经济损失,因此DHD发病机制的研究意义重大。
代谢组学技术应用广泛,利用代谢组学技术可研究疾病发病机制、发现疾病生物标记物及监测疾病等[6-7]。本研究采用高糖高脂+高温高湿+产肠毒性大肠杆菌复制大鼠湿热泄泻模型,分析湿热泄泻潜在代谢标志物与发病机制的关系,为研究湿热泄泻发病机制提供参考依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级Wistar大鼠20只,雌雄各半,5~6周龄,180~220 g,由兰州大学实验动物中心提供【SCXK (甘) 2015-0006】,饲养条件:温度(22±2)℃、湿度50%±5%、12 h光照12 h黑暗,代谢笼中适应3 d。动物实验程序与福利均符合实验动物伦理学要求(伦理批准编号:GSAU-AEW-2018-0618)。
1.1.2 菌种
产毒性大肠杆菌标准株(O101),由中国微生物菌种保藏管理中心(北京)提供,菌号:CVCC231。
1.1.3 实验试剂与仪器
色谱级甲醇(Tedia,17115181);色谱级甲酸(Merck,H6070170);色谱级乙腈(Merck,10900830);56度红星二锅头(北京红星股份有限公司);蜂蜜(上海冠生园蜂制品有限公司,GB14963);市售猪油;戊巴比妥钠(Sigma-Aldrich,P3761);白细胞介素6(IL-6)、白介素1β(IL-1β)、白细胞介素2(IL-2)及肿瘤坏死因子α(TNF-α)ELISA检测试剂盒(北京奇松生物科技有限公司,QS20180329、QS20180413、QS20180426、QS20180411)。
质谱仪(SYNAPT G2 XS QTOF,Waters,美国);超高效液相色谱仪(2777C UPLC system,Waters,美国);大鼠代谢笼;酶标仪(iMark,BIO-RAD,美国);全自动五分类动物血液细胞分析仪(BC-5300Vet,深圳迈瑞生物医疗电子股份有限公司)。
1.2 方法
1.2.1 动物分组及实验
按本实验室前期建立的湿热泄泻模型复制方法建立湿热泄泻大鼠模型[8]。20只大鼠随机分为对照组(control)与DHD模型组(model),每组各10只。模型复制分三个阶段,共18 d。第一阶段:高糖高脂(HF),10 d,双日禁食,单日饲喂普通饲料,按体重4 mL/200 g灌胃猪油一次。第二阶段:高温高湿(HH),5 d,每天按体重2 mL/200 g灌胃白酒一次,置于高温高湿仓8 h,温度(33±2)℃,湿度(93±2)%。第三阶段:攻毒(EC),3 d,产毒性大肠杆菌(1.06×109CFU/mL)按体重0.2 mL/200 g间隔24 h腹腔注射两次,正常饲养1 d。实验中,模型组大鼠自由饮用蜂蜜水(30%),正常饲养对照组大鼠,灌胃、腹腔注射等体积生理盐水。
1.2.2 样本采集与制备
观察记录大鼠一般行为学变化,包括精神状态、被毛、体温、饮食、尿液与粪便等。
实验结束用1%戊巴比妥钠按体重40 mg/kg腹腔注射麻醉大鼠,腹主动脉采血。回肠与结肠各采1 cm,用4%中性甲醛溶液固定,石蜡包埋,常规 HE 染色,显微照相系统采集照片。
容器内加0.5 mL防腐剂(2% NaN3),收集第10天、第15天、第18天(各阶段末天)对照组和模型组大鼠的尿液,-80℃保存。
尿液样本的制备:各取100 μL尿液样本混合制作QC样本。从所有样本(含QC)各取100 μL加入300 μL甲醇混匀,涡旋30 s,静止1 min后4℃ 25 000 r/min离心10 min,取20 μL上清液与180 μL复溶液混匀,0.22 μm滤膜滤过备用。
1.2.3 指标检测
检测血常规:WBC、RBC、PCV、MO、PLT、LY、HGB。
严格按说明书要求检测细胞因子IL-6、IL-1β、IL-2及TNF-α。
采用SPSS 21.0,组间数据差异显著性采用单因素方差分析(ANOVA),以P<0.05为差异有显著性。
1.2.4 UPLC-Q/TOF-MS/MS分析条件
色谱条件 色谱柱:ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm,Waters,美国);流动相:0.1%甲酸水溶液(A)0.1%甲酸乙腈溶液(B);梯度洗脱条件:0~1 min:99%A;1~3 min:1%~15%B;3~6 min:15%~50% B;6~9 min:50%~95%B;9~10 min:95%B;10~12 min:99%A。柱温:40℃;流速:0.5 mL/min;进样量:10 μL。
质谱条件 正离子与负离子模式应用高分辨串联质谱SYNAPT G2-XS QTOF进行样本分析和数据采集。正离子模式采集条件:毛细管电压0.25 kV,锥孔电压40 V。负离子模式采集条件:毛细管电压2 kV,锥孔电压40 V。数据采集:MSE模式centroid,一级扫描范围:50~1200 Da,扫描时间:0.2 s,20~40 eV能量碎裂母离子采集碎片信息,采集过程中每3 s对LE信号进行实时质量校正,使用QC样品进行控制。
1.3 统计学分析
用Progenesis QI软件对原始质谱数据进行峰提取、对齐、匹配和强度校正等处理,将得到的数据导入MetaboAnalyst在线软件进行多元分析,单变量分析采用t检验和变异倍数分析(Fold change,FC),多变量分析采用正交偏最小二乘法判别分析(orthogonal partial least-squares discriminant analysis,OPLS-DA)。差异代谢物筛选条件:FC ≥ 1.2 或FC ≤ 0.8,q< 0.05,VIP ≥ 1.0。
2 结果
2.1 大鼠临床表现及模型评价
2.1.1 临床表现
实验中,对照组大鼠未表现明显临床症状。HF阶段:DHD大鼠在禁食当日饮水量增加,尿液淡黄量增加;灌服猪油当日尿量减少,拉稀。HH阶段:大鼠移入高温仓后出现精神沉郁、食欲下降、被毛杂乱;移出高温仓后精神明显恢复,粪便湿润成型,色偏黄,部分稀软。EC阶段:大鼠食欲下降、嗜睡、扎堆、体温升高、眼睑红肿、眼部黄白分泌物增多,继而腹泻,大便稀薄色黄、黏腻发臭,肛门红肿、肛周附着粪便,部分大鼠出现黏脓血便,见图1。DHD大鼠临床症状与中(兽)医湿热泄泻临床特征基本相符,通过血常规、炎性细胞因子以及组织病理切片做进一步模型评价。
2.1.2 血常规
与对照组大鼠相比,模型组大鼠WBC、NE、MO、LY、RBC、HGB、PCV等指标均升高,PLT降低(P<0.05),见表1。
2.1.3 细胞因子
与对照组相比,模型组大鼠IL-1β、IL-2、IL-6、TNF-α水平均显著升高(P<0.05),见图2,结合血常规检测结果表明DHD模型大鼠体内有严重炎症反应。

注:A:对照组;B:DHD模型组。图1 大鼠临床症状Note.A: Control group; B: DHD group.Figure 1 Clinical symptoms of the rats

表1 血常规检测Table 1 Results of blood routine test
注:与对照组相比,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
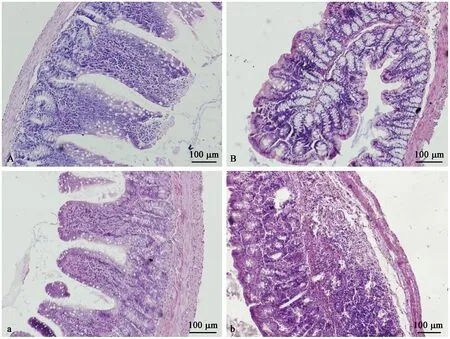
注:A.对照组回肠。a.模型组回肠。B.对照组结肠。b.模型组结肠。图3 回肠与结肠组织的病理变化Note.A, Ileum of a control rat. a, Ileum of a dampness-heat diarrhea (DHD) rat. B, Colon of a control rat. b, Colon of a DHD rat.Figure 3 Histopathological changes of the rat ileum and colon tissues

图2 促炎细胞因子含量Figure 2 Serum inflammatory cytokines levels of the rats
2.1.4 组织病理学
DHD模型大鼠回肠和结肠部分粘膜上皮细胞坏死脱落,偶见中性粒细胞浸润。如图3所示,对照组大鼠肠粘膜上皮完整性较好,模型大鼠回肠肠绒毛部分上皮脱落,隐窝有中性粒细胞浸润,结肠上皮细胞部分坏死脱落,粘膜下层结缔组织结构消失,小肠腺周围有中性淋巴细胞浸润。
2.2 代谢轮廓分析
如图4所示,与对照组相比,模型组大鼠尿液样本峰强和峰型在HF、HH和EC三个阶段都有一定差异,提示DHD模型大鼠尿液中的代谢物在实验中均发生紊乱。
2.3 模式识别分析
代谢数据PLS-DA分析见图5,在正离子模式与负离子模式,对照组大鼠与模型组大鼠尿液样本点在不同阶段分离良好。DHD模型大鼠尿液代谢物变化趋势在HF、HH和EC三个阶段都有差异,表明模型大鼠体内代谢水平因造模因素的影响而发生改变。
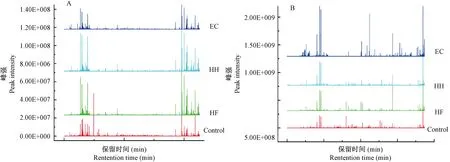
注:A.正离子模式。B.负离子模式。图4 总离子流图Note. A, ESI+ mode. B, ESI- mode.Figure 4 The total ions chromatograms (TIC) showing the urine changes of the rats

注:A: 正离子模式。B: 负离子模式。图5 PLS-DA得分图Note. A, ESI+ mode. B, ESI- mode.Figure 5 The PLS-DA scores
进一步进行OPLS-DA分析,见图6。正离子模式R2Y是0.956、0.877、0.931,Q2是0.925、0.843、0.896,负离子模式R2Y是0.930、0.871、0.928,Q2是0.895、0.834、0.914。模型组大鼠尿液样本点在不同阶段均表现明显分离聚类,说明DHD模型大鼠代谢谱发生改变。利用KEGG、METLIN、HMDB 等数据库共筛选出102个差异代谢物。

注:A:对照组与高糖高脂组。B:对照组与高温高湿组。C:对照组与攻毒组。a:正离子模式。b:负离子模式。图6 OPLS-DA得分图Note. A, Control and HF. B, Control and HH. C, Control and EC. a, ESI+ mode. b, ESI- mode.Figure 6 The OPLS-DA scores
2.4 差异代谢物鉴定
对代谢数据进行样本点间层次聚类分离,如图7所示,与对照组相比,模型组大鼠不同阶段尿液代谢状态在正离子模式和负离子模式均明显偏离。

注:A:对照组与高糖高脂组。B:对照组与高温高湿组。C:对照组与攻毒组。a:正离子模式。b:负离子模式。图7 差异代谢物热图Note. A, Control and HF. B, Control and HH. C, Control and EC. a, ESI+ mode. b, ESI- mode.Figure 7 The heatmap of differential metabolites
不同阶段尿液差异代谢物Venn分析见图8,正离子模式鉴定出差异代谢物57个,14个为两个或三个阶段共有;负离子模式鉴定出差异代谢物20个,5个为两个或三个阶段共有。如表2,有7种差异代谢物为三个阶段共有可作为潜在代谢标志物,分别是5-羟基-N-甲酰甲酰犬尿氨酸、左旋谷酰基-左旋半胱氨酸、左旋甲酰犬尿氨酸、亚油酸、褪黑素、核黄素-5-磷酸和左旋色氨酸。
2.5 代谢通路分析
应用MetaboloAnalyst构建代谢通路,见图9,DHD模型大鼠体内亚油酸代谢、核黄素代谢和色氨酸代谢等代谢通路均发生改变,涉及脂类、能量和氨基酸代谢。
2.6 潜在代谢标志物含量差异分析
将数据归一化处理,以峰强度比较不同阶段潜在代谢标志物相对含量变化,如图10,相较对照组,模型组大鼠尿液样本中褪黑素、亚油酸、左旋甲酰犬尿氨酸和5-羟基-N-甲酰甲酰犬尿氨酸含量明显降低(P< 0.05),左旋色氨酸、核黄素-5-磷酸和左旋谷酰基-左旋半胱氨酸含量明显升高(P< 0.05)。左旋色氨酸、核黄素-5-磷酸和左旋谷酰基-左旋半胱氨酸的含量在实验三个阶段表现明显的升高、降低和再升高变化;5-羟基-N-甲酰甲酰犬尿氨酸、褪黑素、亚油酸和左旋甲酰犬尿氨酸的含量呈现明显的下降、升高和再下降变化。提示模型复制过程中,内源性代谢物相对含量随造模因素改变而改变。
3 讨论
湿热泄泻病因复杂,有外感湿热致内生湿热、饮食不洁、喜食肥甘厚腻或外感疫疠等,病位多在大肠,本实验模型大鼠回肠和结肠粘膜上皮完整性被破坏,表明湿热泄泻可造成肠道损伤,与中医理论一致。现代研究认为“外湿+内湿+生物致病因子”能理想的模拟湿热泄泻的复杂病因及病程[9]。尿液比其他体液易获取,蛋白质、脂质含量较少,基本包含机体各种代谢物及代谢过程,是较为理想的代谢组学研究样本[10]。本实验各阶段模拟不同致病因素,应用尿液代谢组学技术,筛选出核黄素-5-磷酸、左旋甲酰犬尿氨酸、5-羟基-N-甲酰甲酰犬尿氨酸、左旋色氨酸、褪黑素、左旋谷酰基-左旋半胱氨酸和亚油酸等7个潜在代谢标志物,涉及核黄素代谢、色氨酸代谢、亚油酸代谢等代谢通路。

注:A:正离子模式。B:负离子模式。图8 差异代谢物Venny图Note. A, ESI+ mode. B, ESI- mode.Figure 8 The Venn diagram of differential metabolites

注:A:色氨酸代谢。B:亚油酸代谢。C:核黄素代谢。图9 相关代谢通路Note. A, Tryptophan metabolism. B, Linoleic acid metabolism. C, Riboflavin metabolism.Figure 9 The relevant metabolic pathways
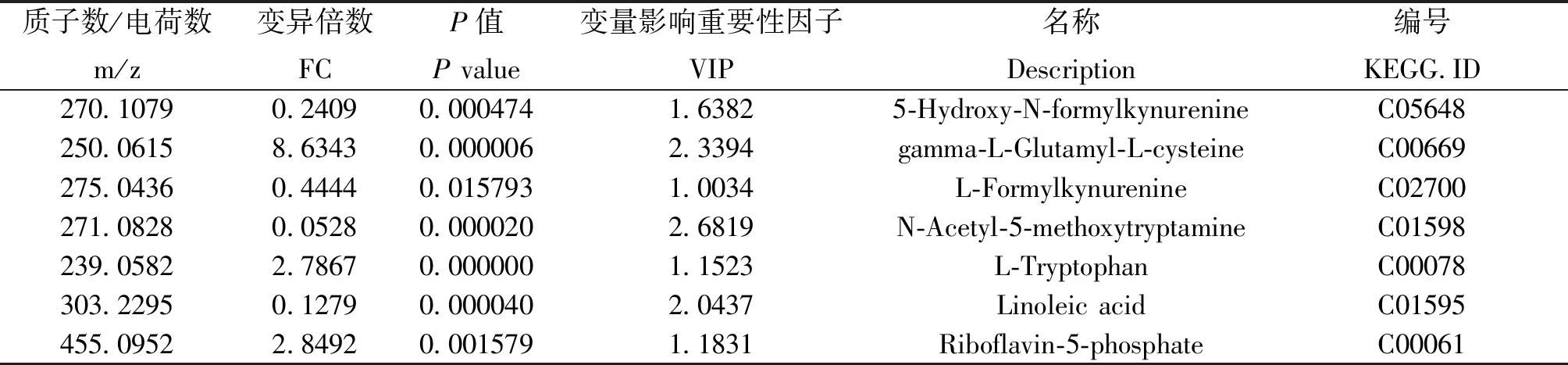
表2 DHD尿液潜在生物标记物

图10 潜在代谢标志物含量变化Figure 10 Changes in the content of potential metabolic markers
3.1 核黄素代谢
核黄素-5-磷酸是体内核黄素存在形式,其含量变化提示核黄素代谢改变。核黄素即VB2,是FMN和FAD两种辅酶的主要活性基因,FMN和FAD参与机体蛋白质、脂质、糖类和核酸代谢[11]。核黄素代谢异常与多种疾病有关,如发热、炎症,研究发现核黄素-5-磷酸含量升高可能是机体发生强烈氧化代谢[12-14]。本研究DHD大鼠尿液核黄素-5-磷酸含量在HF、EC阶段明显上升,表明高糖高脂与攻毒使大鼠发生强氧化代谢。
3.2 色氨酸代谢
左旋甲酰犬尿氨酸、5-羟基-N-甲酰甲酰犬尿氨酸、左旋色氨酸和褪黑素的含量变化反映色氨酸代谢改变。色氨酸是血清素前体,其代谢主要发生在炎症组织,研究表明抗原递呈细胞、巨噬细胞、成纤维细胞和炎性细胞因子通过释放活化的免疫细胞,促进吲哚胺2,3-双加氧酶(IDO)的活化及表达加速色氨酸降解[15-16]。色氨酸代谢与炎症性肠病密切相关,其在胃肠道代谢有三种主要途径[17]。(1)肠道微生物将色氨酸转化为几种分子,包括芳烃受体(AhR)的配体,AhR信号传导被认为是屏障部位免疫反应的关键组成部分,通过作用于上皮细胞更新影响屏障完整性和免疫细胞增殖,对肠内稳态至关重要[18]。(2)IDO在免疫细胞和上皮细胞中的犬尿氨酸途径(KP),通过肠道中KP进行色氨酸代谢由限速酶IDO1介导,产生犬尿氨酸(Kyn)和下游产物,犬尿氨酸代谢产物浓度随胃肠道增加,通过G蛋白偶联受体GPR35表现粘膜保护和免疫调节作用[19-20]。(3)色氨酸羟化酶1(TpH1)在肠嗜铬细胞中的5-羟色胺(5-HT)途径。5-HT是影响肠道信号传导的重要信号分子,间接影响肠道蠕动、分泌、血管舒张和吸收[21]。DHD大鼠尿液色氨酸水平显著降低,三种关键的色氨酸代谢物(Kyn,5-HT和5-HTP)的水平显着增加,表明大鼠肠道蠕动、舒张和吸收均受到影响。
3.3 亚油酸代谢
亚油酸参与细胞生长、凋亡及免疫调控,有降胆固醇和降低心血管疾病与乳腺癌风险的作用[22-23]。亚油酸可生成花生四烯酸,花生四烯酸是某些促炎类物质前体,如PGE2、LTB4、TXA2,促炎类花生酸可促进IL-6、TNF-α、CRP的生成[24-25]。本试验IL-1β、IL-2、IL-6、TNF-α四种促炎细胞因子均升高,结合血常规检测结果提示机体发生炎症反应。DHD大鼠尿液中亚油酸含量明显降低,可能是由于机体炎症反应消耗能量降低亚油酸水平[26]。尿液中亚油酸浓度降低意味着能量供需不平衡,与所致炎症不良结果相关。
DHD可能是动物受外界致病因素影响,体内免疫细胞通过某些途径诱导炎症因子活化,造成体内色氨酸代谢、核黄素代谢与亚油酸代谢等代谢通路发生改变,进而使机体整个代谢系统发生紊乱,从而引起DHD的发病。

