红外热像技术在小鼠阳虚证研究中的运用及其评价体系
钱宏梁,潘志强,方肇勤
(上海中医药大学基础医学院,上海 201203)
中医证候表征的量化研究是学术界探索的重要领域,其中,寒热属性是中医辨别病邪性质、机体的阴阳盛衰及病属外感或内伤的重要依据。寒即畏寒怕冷,临床肾阳不足者可能会出现手足、腰部、膝盖等部位的发凉或怕冷;热即身热感或体温升高,临床阴虚内热者颜面部易出现潮红、烘热或手足心发热。由此可见,中医证候属热性时既有主观性肌肤发热感觉,也会出现客观上体温升高体征,体温升高可以通过温度计准确刻画,然而主观上的肌肤热感则主要通过患者的陈述获得,其模糊性不利于证候的准确判别。
随着红外热像技术的成熟与运用,医学上已有大量红外测温的研究,陈振相等[1]红外热像仪对健康人的面部进行了观测,倪金霞等[2]用红外热成像仪研究健康人各脏腑的温度范围和能量分布。这些探索给中医证候实验研究提供有益的借鉴,有助于寒热信息在证候判别中的定量化。当机体处于热量不足或功能衰减状态下,红外辐射少可能表现出寒证;一旦热量过剩或代谢旺盛时,红外辐射多则可能呈现类似热证。如“阳虚则外寒,阴虚则内热,阳盛则外热,阴盛则内寒”(《素问·调经论》)所言,红外热像技术可以很好地的量化检测体表寒热情况作为评价中医“阳”盛衰程度的手段非常契合,但在实验动物证候模型的研究方面鲜有报道。基于本课题组长期对于实验小鼠的诊法和辨证论治方法学的研究[3-5],本实验围绕小鼠的“阳”盛衰程度开展了对典型的糖皮质激素诱发的药源性证候模型小鼠的探索,通过红外热像技术对小鼠体表头部最高温度、体表尾部最低温度和躯干平均温度3个温度指标进行了研究,兹报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
雄性ICR小鼠,SPF级,120只,体质量(18~20)g,购自上海西普尔-必凯实验动物有限公司【SCXK(沪)2013-0016】。小鼠饲养于上海中医药大学实验动物中心SPF级动物房【SYXK (沪) 2014-0008】。实验动物伦理审批号:SZY201803012。
1.1.2 试剂与仪器
氢化可的松(hydrocortisone,HY),白色结晶粉末,分子量362.46,购自国药集团化学试剂有限公司产品(批号66003632)。醋酸泼尼松龙片(prednisolone)(国药准字H31020771)、醋酸地塞米松片(dexamethasone)(国药准字H31020793)均购自上海上药信谊药厂有限公司。
ThermaCAM P30型红外热像仪器(购自美国FLIR公司)用于检测体表红外温度。
1.2 方法
1.2.1 分组与造模
小鼠适应性饲养,当小鼠体质量稳定至30 g左右,开始实验。
第一批实验:40只分为正常对照组、极低剂量(0.33 mg/(kg·bw))氢化可的松组、低剂量(0.66 mg/(kg·bw))氢化可的松组、中剂量(3.3 mg/(kg·bw))氢化可的松组和高剂量(12.5 mg/(kg·bw))氢化可的松组,每组8只。
第二批实验:40只分为正常对照组、极低剂量(0.25 mg/(kg·bw))泼尼松龙组、低剂量(0.5 mg/(kg·bw))泼尼松龙组、中剂量(2.5 mg/(kg·bw))泼尼松龙组和高剂量(12.5 mg/(kg·bw))泼尼松龙组,每组8只。
第三批实验:40只分为正常对照组、极低剂量(0.0125 mg/(kg·bw))地塞米松组、低剂量(0.05 mg/(kg·bw))地塞米松组、中剂量(0.25 mg/(kg·bw))地塞米松组和高剂量(1.25 mg/(kg·bw))地塞米松组,每组8只。
各组按照相应的药物剂量灌胃,每天1次,连续14 d;正常对照组灌胃等体积的灭菌水。
1.2.2 红外热像仪检测小鼠体表温度的标准化方法
在实验第14天,检测各组小鼠体表红外温度,具体方法如下:
1)将被检测的实验小鼠与红外热像仪至于环境温度22℃的室内,室内移除其他干扰红外热像仪的设备或仪器。
2)开启红外热像仪,设定以下相关参数:FOV视场23(单位:角秒),调色板以红色为主,发射率e为0.97,相对湿度65%,镜头为200 μm近焦镜头,手动聚焦。
3)准备一个10 cm × 6 cm面积的泡沫塑料材质平台供小鼠站立。
4)调整红外热像仪镜头中心与小鼠侧腹部在同一水平,且距离60 cm。
5)将小鼠置于泡沫塑料材质平台上。
6)调整焦距使得小鼠侧面轮廓清晰并使其处于红外热像仪图像中心区域。
7)等待小鼠调整到较好的姿势时,拍摄小鼠红外热像图,并保存图片。
1.2.3 小鼠体表红外温度的评价指标建立
采用ThermaCAM Reporter 2000专业版软件对小鼠红外热像图进行数据分析。通过软件采集三个温度指标进行分析:
1)头部最高温度(即为图1中A小鼠头部区域中的温度最大值)
2)躯干平均温度(即为图1中B小鼠躯干区域的平均值)
3)尾部最低温度(即图1中C小鼠尾根部区域可以选取到的最小值)。

图1 小鼠红外热像图分析数据示意图Figure 1 Schematic diagram indicating the three sites of infrared thermogram analysis data of a mouse
1.3 统计学分析
2 结果
2.1 氢化可的松对小鼠不同部位红外温度影响(阳盛衰程度)
与正常对照组比较,氢化可的松给药14 d后,不同剂量氢化可的松组小鼠头部最高温度、躯干平均温度和尾部最低温度均出现不同程度的下降。其中极低、低、中、高剂量组小鼠头部最高温度出现显著下降(P<0.01);极低、低、中、高剂量组小鼠躯干平均温度出现显著下降(P<0.01);极低、低、中、高剂量组小鼠尾部最低温度出现显著下降(P<0.01),见图2。
2.2 泼尼松龙对小鼠不同部位红外温度影响(阳盛衰程度)
与正常对照组比较,泼尼松龙给药14 d后,极低剂量泼尼松龙组小鼠头部最高温度出现显著下降(P<0.05),躯干平均温度和尾部最低温度未出现显著差异;低、中、高剂量泼尼松龙组小鼠头部最高温度、躯干平均温度和尾部最低温度均未出现显著差异,见图3。
2.3 地塞米松对小鼠不同部位红外温度影响(阳盛衰程度)
与正常对照组比较,地塞米松给药14 d后,不同剂量地塞米松组小鼠头部最高温度、躯干平均温度和尾部最低温度均出现不同程度的下降。其中低、中、高剂量小鼠头部最高温度出现显著下降(P<0.01);低、中、高剂量组小鼠躯干平均温度出现显著下降(P<0.01);低、中、高剂量组小鼠尾部最低温度出现显著下降(P<0.01),见图4。
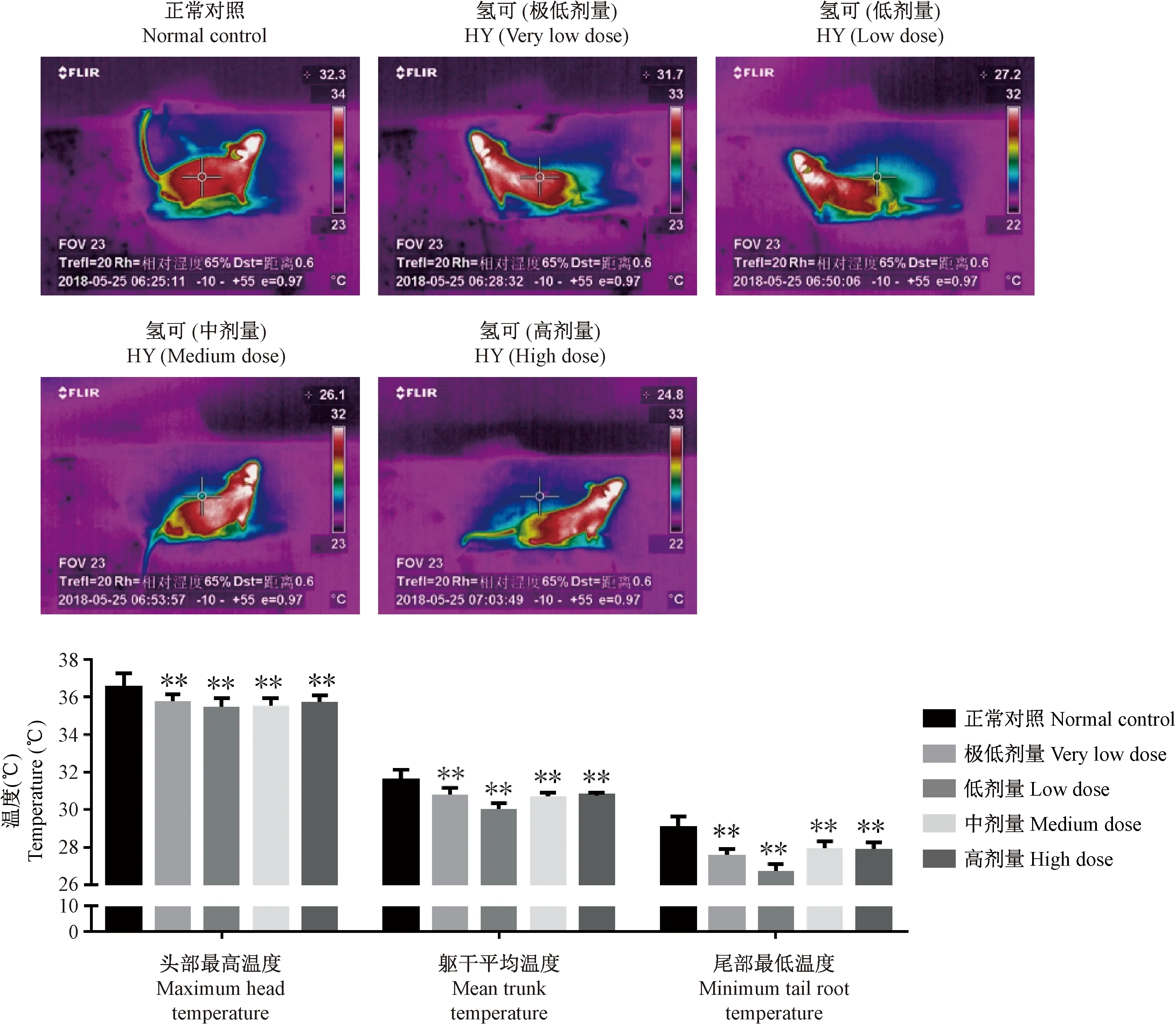
注:不同剂量氢化可的松:极低剂量(0.33 mg/(kg·bw))、低剂量(0.66 mg/(kg·bw))、中剂量(3.3 mg/(kg·bw))和高剂量(12.5 mg/(kg·bw))。与正常对照组比较,*P<0.05;**P<0.01。另“氢可”即氢化可的松。图2 氢化可的松小鼠红外热图以及数据柱状图Note. Different doses of hydrocortisone: very low dose (0.33 mg/(kg·bw)), low dose (0.66 mg/(kg·bw)), medium dose (3.3 mg/(kg·bw)) and high dose (12.5 mg/(kg·bw)). Compared with the normal control group,* P<0.05;** P<0.01.“HY” means hydrocortisone.Figure 2 Infrared heat map and data histogram of the hydrocortisone-treated mice

注:不同剂量泼尼松龙:极低剂量(0.25 mg/(kg·bw))、低剂量(0.5 mg/(kg·bw))、中剂量(2.5 mg/(kg·bw))和高剂量(12.5 mg/(kg·bw))。另“泼松”即泼尼松龙。图3 泼尼松龙小鼠红外热图以及数据柱状图Note. Different doses of prednisolone: very low dose (0.25 mg/(kg·bw)), low dose (0.5 mg/(kg·bw)), medium dose (2.5 mg/(kg·bw)) and high dose (12.5 mg/(kg·bw)). “PL” means prednisolone.Figure 3 Infrared heat map and data histogram of the prednisolone-treated mice
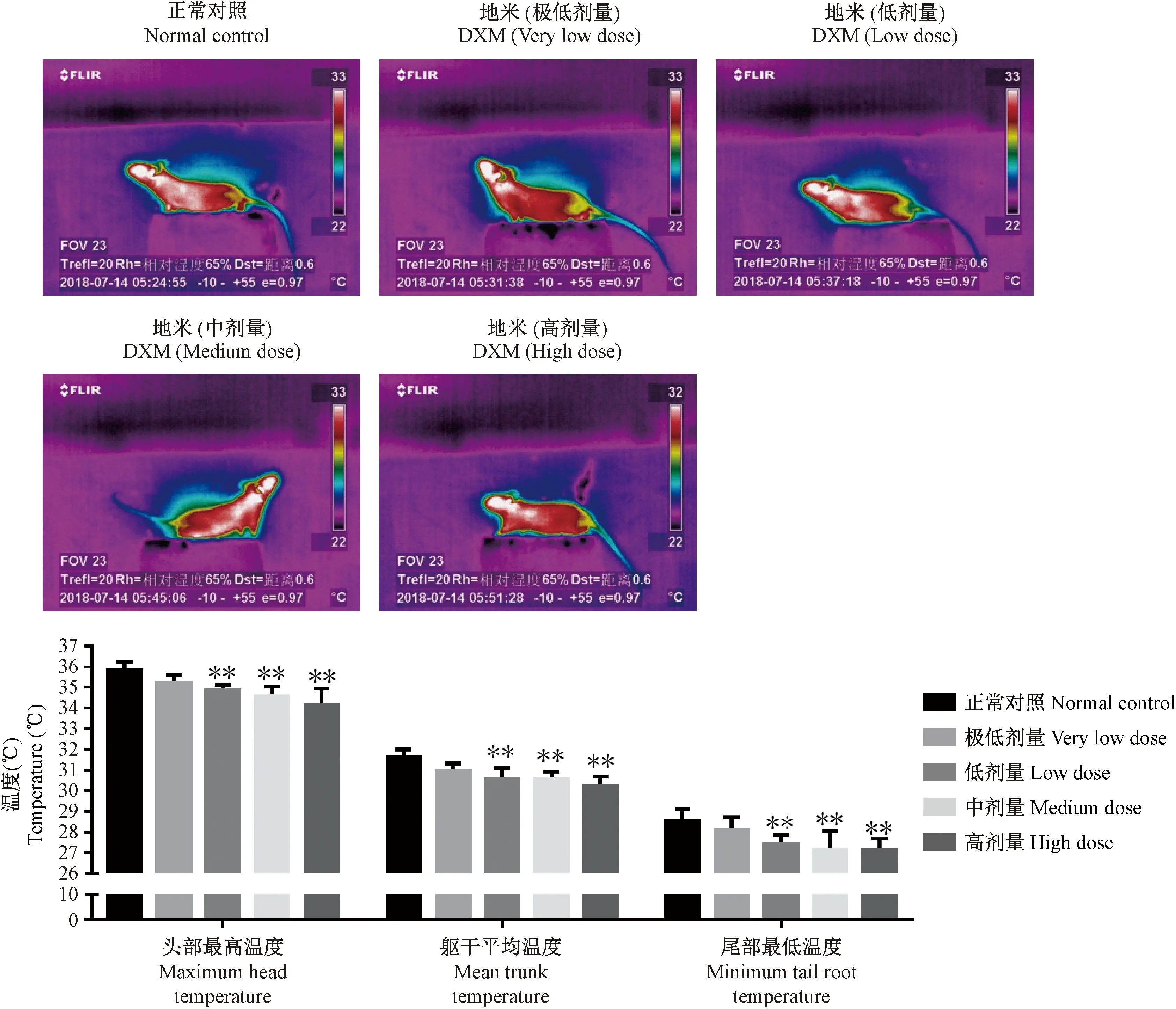
注:不同剂量地塞米松:极低剂量(0.0125 mg/(kg·bw))、低剂量(0.05 mg/(kg·bw))、中剂量(0.25 mg/(kg·bw))和高剂量(1.25 mg/(kg·bw))。另“地米”即地塞米松。图4 地塞米松小鼠红外热图以及数据柱状图Note. Different doses of dexamethasone: very low dose (0.0125 mg/(kg·bw)), low dose (0.05 mg/(kg·bw)), medium dose (0.25 mg/(kg·bw)) and high dose (1.25 mg/(kg·bw)). “DXM” means dexamethasone.Figure 4 Infrared heat map and data histogram of the dexamethasone-treated mice
3 讨论
3.1 红外热像技术简介
红外热像仪利用物体的红外辐射把热能转换成电信号,再扫描成像,然后通过软件可以实现对图像任何点或区域的温度精确分析。由于红外热像技术具有非接触性测温、测温速度快、以热分布图像直观呈现等诸多优点[6],其在军事领域、高压电网工业及农业等领域被广泛运用[7]。近几十年来,红外热像技术在医疗诊断、肿瘤研究、疼痛研究、神经定位、针刺效应及人体异常信息的无创监测等领域得到广泛的应用。
3.2 红外热像技术在中医药证候研究中的实践
由于寒热属性是中医证候的重要特性,虽然临床表现并非所有的“阳”盛衰证候都有体表温度的变化,但体表温度下降是阳虚的基础见证。近年来,有报道红外热像仪在中医证候的量化研究方面进行了尝试,陈振相等[1]用红外热像仪对健康人的面部进行了观测,发现面部诸脏腑面部反映区的红外辐射量有所差异。刘黎青等[8]应用红外热像技术观察不同中医辨证分型的红外舌图特征及冷热温度负荷变化规律。周娴等[9]运用红外热像技术研究中医五脏寒热证素特征与红外热像图之间的关系。李洪娟等[10]则详细论述中医证候理论与热力学理论的内在关联性,阐述采用热力学方法研究中医证候的基本原则、方法、技术、手段,以及热力学方法研究中医证候的特点和优势等,提出证候热力学研究概念。
在动物实验方面也有部分红外热像技术运用的报道,袁永明等[11]对寒证热证大鼠模型的红外热图进行了研究。马小鑫[12]通过红外热像技术在大鼠上的实践建立了中药寒热药性的研究方法。孙丽斌等[13]对红外热图与肿瘤中医证候相关性作了研究。提示红外热像技术是研究中医证候属性的一种有益技术手段。
3.3 本研究采用红外热像技术对糖皮质激素药源性虚证小鼠体表温度的分析
本课题前期做过多次探索,短期(4 d内)使用糖皮质激素药物体重显著下降阴虚见证显著。长期(7 d以上)使用糖皮质激素药物体重下降减缓,体表温度下降等。两周为糖皮质激素影响的主要变化周期,两周后趋于稳定变化不大。实验中三个药物极低剂量即为临床药物参考用量按体重折算到小鼠所得,高剂量参考文献该药物造模常用量。低、中剂量则选取极低剂量和高剂量之间地合适剂量。
本研究运用红外热像技术检测了三种糖皮质激素造模后小鼠的体表温度变化。考虑到所采集图像信息能尽可能全面反映小鼠的体表温度差异,我们选择了拍摄小鼠自然站立状态下侧腹部整体轮廓图像,包括小鼠头面部、颈项部、侧腹部、全尾等区域温度,且背部与腹部的切缘温度可以有效显示。其中,小鼠头部的眼睛区域温度最高、尾部温度通常最低、而侧腹部温度从头到尾逐步降低。根据以上现象,我们选取了头部最高温度、躯干平均温度和尾根部最低温度三个指标进行分析。
结果表明,给予氢化可的松和地塞米松后小鼠头部最高温度、躯干平均温度和尾部最低温度均出现下降,而泼尼松龙对小鼠体表温度影响不明显。另外三批实验中我们也同步检测了小鼠的腋温、旷场活动度、体重等,腋温变化不显著,(故未给出具体数据),旷场活动度有一定程度的下降,体重在给药后下降7 d后下降减缓。另外由于糖皮质激素药理作用复杂,直接作用机体可能造成类似阴虚阳亢征兆,长期使用造成机体出现阳虚见证,具有直接和间接双重影响。中、高剂量下小鼠体表温度略有升高可能是由于氢化可的松直接作用机体造成,但是用药14 d后氢化可的松各剂量组体表温度均显著低于正常对照组是明确的。
基于本研究大量的实验数据,我们认为小鼠头部最高温度、躯干平均温度和尾部最低温度三个指标可以反映出小鼠整体体表温度的变化,且这三个温度指标的变化具有一致性。其中,头部最高温度能更好反映小鼠是否有阳亢见证(是否头部温度过高),中医认为头为诸阳之会,所有的阳经都汇集到头部,小鼠头部体表温度最高符合中医理论;而尾根部最低温度反映小鼠的阳虚见证(是否尾根部温度过低);躯干平均温度则更加反映小鼠整体上的体表温度变化。此外,小鼠的体表最高与最低体温的温差、或头部温度高于平均温度的比值等相关转化指标也有助于深刻揭示温度变化的灵敏性,有待于深入探索。
由此得出结论(1)红外热像技术可以评估实验小鼠 “阳”盛衰程度。(2)氢化可的松和地塞米松可诱发药源性虚证小鼠类似阳虚的外寒征象,且随着用药时间和剂量的增加而小鼠阳虚外寒征象越显著。

