海蓬子发芽富集γ-氨基丁酸和黄酮类化合物的条件优化及关键酶活性的研究
王杰,王笃军,李凤伟,商曰玲,卜雯丽,丁霄霄,余晓红,*
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.盐城工学院海洋与生物工程学院,江苏盐城224051)
海蓬子(Salicornia europaea L.),又名西洋海笋,系藜科(Chenopodiaceae)海蓬子属(Salicornia)盐生性植物[1],种植在海滩盐碱地、盐沼地或轻质沙地,耐受5%NaCl 浓度的海水,可用海水直接灌溉,不与粮食作物争土地,争淡水[2]。海蓬子植株富含矿物质元素、膳食纤维、蛋白质、维生素和氨基酸等营养物质,不仅可以作为蔬菜直接食用,还可以作为一种草药,其具有清热排毒、利尿、减肥、降血脂、活血通络和抗坏血病等功效[3]。
γ-氨基丁酸(γ-aminobutyric acid,GABA)在植物中含量很低,很难从这些天然组织中大量的分离提取[4]。因此,通过生物合成法(植物富集法和微生物发酵法)获得GABA 备受学者关注[5]。研究表明种子发芽过程中发生了大量复杂的生理生化变化,种子中不断产生新酶或被激活,一些大分子物质如淀粉和蛋白质被分解,种子中原来含量低或不具有的功能成分如GABA 等大量富集[6]。发芽过程中,种子中的L-谷氨酸(L-glutamic acid,L-Glu) 在谷氨酸脱羧酶(glutamate decarboxylase,GAD)催化下脱羧形成GABA,而二胺(polyamines,PAs) 经二胺氧化酶 (diamine oxidase,DAO)催化形成氨基丁酸,后环化成吡咯啉,再在吡咯啉脱氢酶(pyrroline dehydrogenase,PDH)作用下形成GABA[7]。有研究表明,大豆正常发芽5 d 后,发芽大豆中GABA 含量是原料的4.19 倍[8]。而目前国内外对于海蓬子发芽富集GABA 的报道基本没有。
黄酮类化合物作为一种生理活性物质,在许多植物和蔬菜中都有发现,Lee 等[9]从海蓬子中提取出了异鼠李素-3-O-β-D-葡萄糖苷和槲皮素-3-O-β-D-吡喃葡萄糖苷两种黄酮类化合物,发现这些物质能够抑制糖代谢,利用这一特性研发出了新的治疗糖尿病的药物。Kong 等[10]进行了进一步研究发现这些物质能大大提升抗氧化酶的生物活性,保护细胞的基因,是一种天然抗氧化剂[11],但以海蓬子种子为材料进行发芽试验富集黄酮类化合物的研究鲜有报道。黄酮类化合物的生成是通过苯丙烷类的合成途径,研究证实苯丙氨酸解氨酶(phenylalanine aminolyase,PAL)、肉桂酸4-羟基化酶(cinnamicacid-4-hydroxylase,C4H),4-香豆酸辅酶 A 连接酶(4-coumarate-CoA ligase,4CL)是苯丙烷类代谢途径的3 个关键酶[12-15]。植物种子萌发后会发生一系列的生理代谢变化,主要表现在细胞生理活性的恢复和复杂的生化代谢,从而使籽粒的营养成分发生重大的变化。周小理等[16]对苦荞麦籽粒进行发芽萌发处理后,发现萌发物中黄酮化合物的含量远远高于苦荞麦种子。
本研究通过单因素和正交试验,研究NaCl、赤霉素、pH 值和温度对海蓬子发芽率、黄酮和GABA 的影响,在最优的培养条件下,探究关键酶活性对发芽过程中GABA 和黄酮类化合物的富集机制,旨在为开发功能性海蓬子食品及发展盐土农业经济提供依据。
1 材料与方法
1.1 材料与试剂
海蓬子种子:盐城绿苑盐土农业科技有限公司;GABA 标准品:青岛捷世康生物有限公司;芦丁标准品、磷酸吡哆醛(pyridoxal5-phosphatemonohydrate,PLP)、谷氨酸、赤霉素、愈创木酚、过氧化物酶、肉桂酸、苯丙氨酸、β-巯基乙醇:上海生工工程股份有限公司;腐胺、还原型辅酶Ⅱ(reduced coenzyme Ⅱ,NADPH)、对香豆酸、三磷酸腺苷(adenosine triphosphate,ATP)、辅酶 A(coenzyme A,CoA)、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP):上海源叶生物科技有限公司;甲醇(色谱纯):上海陆都化学试剂厂。其他试剂均为国产分析纯。
1.2 仪器与设备
UV752N 紫外可见分光光度:上海佑科仪器仪表有限公司;FA1104 电子天平:上海舜宇恒平科学仪器有限公司;PB-20 型pH 计:德国赛多利斯公司;TGL-16M台式高速冷冻离心机:上海卢湘仪离心机仪器有限公司;HY-4 型调速多用振荡器:金坛市城东新瑞仪器厂;Agilent 1290 液相色谱仪:Agilent 公司;150 C 恒温光照培养箱:常州国华电器有限公司。
1.3 方法
1.3.1 发芽工艺
挑选饱满均匀的海蓬子种子,用1%的次氯酸钠消毒15 min 后冲洗至中性,置于铺有两层滤纸的培养盒中,每个培养盒放置1 000 颗种子,样品置于恒温光照培养箱中发芽,每8 h 喷一次培养液。分别测定海蓬子发芽第5 天时的发芽率、GABA 含量以及黄酮类化合物的含量。
1.3.2 单因素使验
NaCl 浓度:分别设置 0、3.5、7.0、10、14 g/L 为 5 个不同的培养液浓度,每个梯度设置3 组平行试验在24 ℃的光照培养箱中培养。
赤霉素(gibberellin,GA3)浓度:在 7.0 g/L 的 NaCl培养液中分别加入 0、5、10、20、30 mg/L 的 GA3、每个梯度设置3 组平行试验在24℃的光照培养箱中培养。
pH 值:调节 7.0 g/L 的 NaCl 培养液 pH 分别为 5、6、7、8、9,每个 pH 值梯度设置 3 组平行试验在 24 ℃的光照培养箱中培养。
温度:将7.0 g/L 的NaCl 培养液培养的种子分别放在 18、20、22、24、26 ℃的光照培养箱中培养。
1.3.3 正交试验
在单因素试验结果基础上,选择NaCl 浓度、GA3浓度、pH 值、温度为考察因素。以发芽率、GABA 含量、黄酮类化合物含量为评价指标,设计无交互作用的正交试验表L9(34),研究各因素及其水平对发芽率、GABA 含量、黄酮类化合物含量的影响,正交试验因素水平见表1。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
1.3.4 最优条件下关键酶活力测定
通过正交试验得到最优培养液组合,在此条件下,对发芽 7 d 内的 GAD、DAO 和 PAL、C4H、4CL 活力进行测定。
1.4 测定指标和方法
发芽率:按照GB/T 3543.4-1995《农作物种子检验规程发芽试验》测定;黄酮含量测定:亚硝酸钠-硝酸铝比色法;GABA 含量测定[17]:称取0.2 g 发芽海蓬子干粉溶于5 mL 质量分数为8 %的三氯乙酸溶液,在40 ℃水浴振荡 2 h,离心分离,上清液经 0.45 μm 滤膜过滤后用于测定GABA 含量。GABA 测定采用柱前邻苯二甲醛(O-phthalaldehyde,OPA)衍生化反相高效液色谱法来检测GABA。高效液相色谱(high performance liquid chromatography,HPLC) 条件:检测器波长为338 nm,色谱柱为 C18ODS 反相柱(250 mm×4.6 mm,5 μm),色谱柱温度 25℃;流动相比例为 0.1 mol/L 磷酸缓冲液(pH 值为6.0)52 %,甲醇46 %,四氢呋喃2 %,使用前经0.22 μm 微孔滤膜过滤,超声波脱气后使用,流动相流速为1 mL/min;GAD 酶活力测定:参考Xu 等[18]的方法;DAO 酶活力测定:参考 Xing 等[19]的方法;PAL 酶活力测定:参考陈雷等[20]的方法;C4H 酶活力测定:参考 Lamb 等[21]的方法;4CL 酶活力测定:参考Koopmann 等[22]的方法。
1.5 数据统计与分析
每组试验设3 次重复,取平均值;采用IBM SPASS Statistics 19.0 软件对数据进行处理和方差分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 NaCl 浓度对发芽率的影响
NaCl 浓度对种子发芽率的影响见图1。
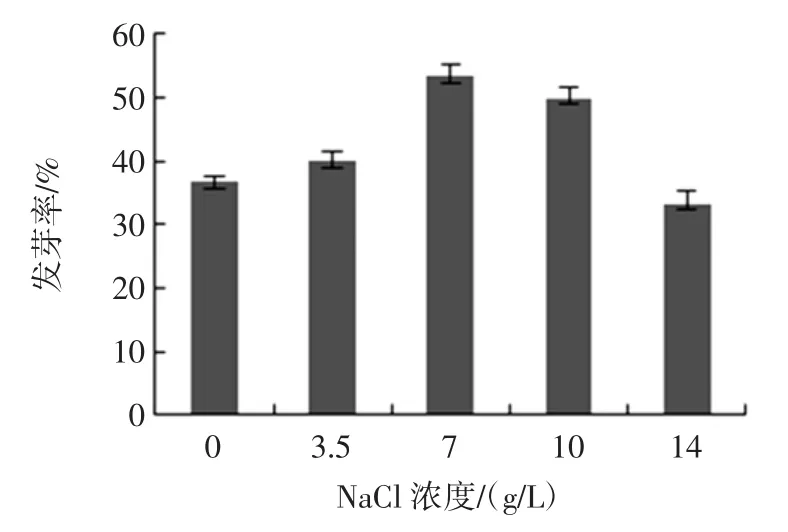
图1 NaCl 浓度对种子发芽率的影响Fig.1 Effect of NaCl concentrationon on the seed germination rate
由图1 可知,当 NaCl 浓度在 0 g/L~20 g/L 时,海蓬子种子的发芽率逐渐上升,对于一定浓度的NaCl,促进了种子发芽,这是因为海蓬子属于盐碱地植物,有一定的耐盐性,低浓度的盐刺激了种子的生长。当NaCl 浓度在7 g/L 时,种子的发芽率达到最大,当NaCl浓度大于7 g/L 时,种子的发芽率逐渐降低,这是因为高浓度的盐抑制了种子的活性,使种子处于休眠状态[23]。因此,NaCl 浓度选择在 7 g/L~10 g/L 为宜。
2.1.2 GA3浓度对发芽率的影响
GA3浓度对种子发芽率的影响见图2。
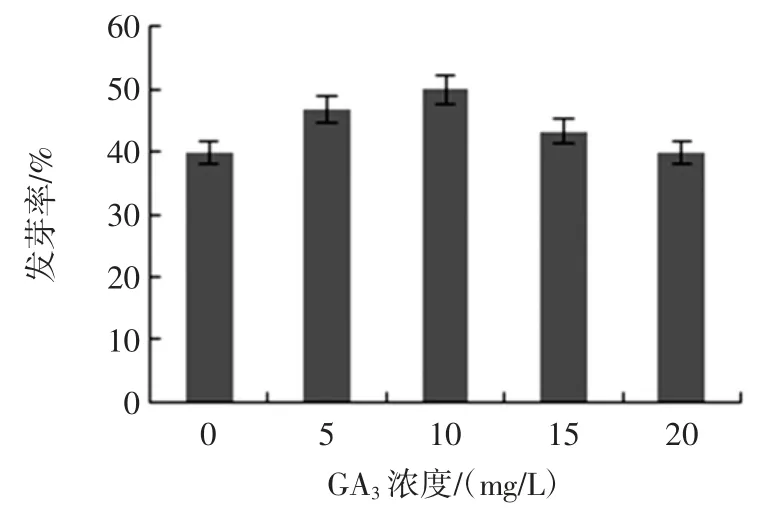
图2 GA3 浓度对种子发芽率的影响Fig.2 Effect of GA3 concentrationon on the seed germination rate
由图2 可知,当 GA3浓度在 0 mg/L~10 mg/L 时,海蓬子种子发芽率缓慢升高,在10 mg/L 达到最大值50 %,随着GA3浓度的逐渐增大,发芽率呈现缓慢下降的趋势,这是由于GA3作为一种高效植物生长调节剂,它能迅速打破种子、块茎和鳞茎等器官的休眠状态,促进发芽生长、发芽、开花、结果,但是高浓度的GA3反而会抑制种子发芽[24]。因此,GA3浓度控制在10 mg/L 最佳。
2.1.3 pH 值对发芽率的影响
pH 值对种子发芽率的影响见图3。

图3 pH 值对种子发芽率的影响Fig.3 Effect of pH on the seed germination rate
由图3 可知,随着pH 值的升高,海蓬子种子的发芽率呈现先增后降的趋势,较低或较高的pH 值都会对种子发芽起到抑制作用,当pH 值为8 时,种子发芽率最高,为50%,因为海蓬子属于耐盐碱性植物,弱碱性条件下,对其生长发育起到一定的促进作用。因此,种子发芽pH 值以8.0 为宜。
2.1.4 温度对发芽率的影响
温度对种子发芽率的影响见图4。

图4 温度对种子发芽率的影响Fig.4 Effect of temperature on the seed germination rate
由图4 可知,当培养温度为18 ℃~22 ℃时,种子的发芽率逐渐升高,温度为22 ℃时发芽率达到最大值为50%。但是随着温度的升高,发芽率逐渐降低,这是因为较高的温度导致酶活性降低,一定程度上抑制了种子的萌芽[25]。故发芽温度为22 ℃~24 ℃为宜。
2.2 正交试验结果
在单因素试验结果基础上,选择NaCl 浓度、GA3浓度、pH 值、温度为考察因素,以发芽率、GABA 含量、黄酮类化合物含量为评价指标,进行L9(34)正交试验,正交试验结果见表2。
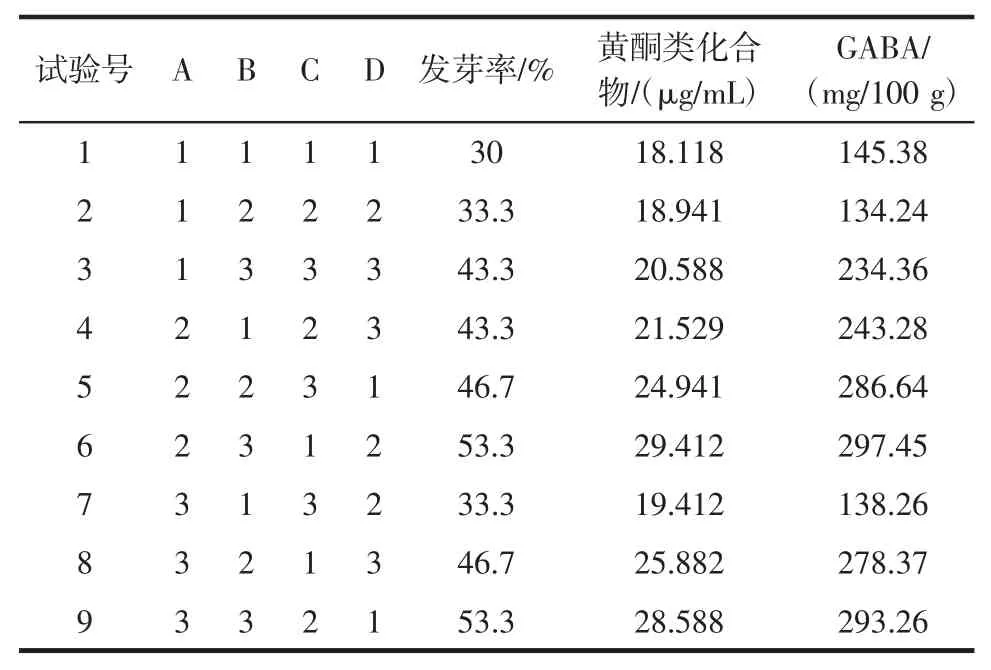
表2 正交试验结果Table 2 Results of orthogonal test
正交试验发芽率直观分析见表3。

表3 正交试验发芽率直观分析Table 3 Germination rate intuitive analysis of orthogonal test
由表3 可知,RB>RA>RD>RC,表明 pH 值对发芽率的影响最大,NaCl 浓度次之,其他依次是温度,GA3浓度。
正交试验发芽率方差分析见表4。

表4 正交试验发芽率方差分析Table 4 Germination rate variance analysis of orthogonal test
由表4 可知,影响种子发芽的各因素显著次序为pH 值>NaCl 浓度>温度>GA3浓度,其中 NaCl 浓度和pH 值均有显著性影响。
正交试验黄酮类化合物直观分析见表5。

表5 正交试验黄酮类化合物直观分析Table 5 Flavonoids intuitive analysis of orthogonal test
由表5 可知 RB>RA>RC>RD,表明 pH 值对黄酮类物质富集含量影响最大,NaCl 浓度次之,其他依次是GA3浓度,温度。
正交试验黄酮化合物方差分析见表6。

表6 正交试验黄酮化合物方差分析Table 6 Flavonoids variance analysis of orthogonal test
由表6 可知,影响种子发芽的各因素显著次序为pH 值>NaCl 浓度>GA3浓度>温度,其中 NaCl 浓度和pH 值均有显著性影响。
正交试验GABA 直观分析可知见表7。
由表7 可知,RA>RB>RD>RC,表明 NaCl 浓度对黄酮富集含量的影响最大,pH 值次之,其他依次是温度、GA3浓度。
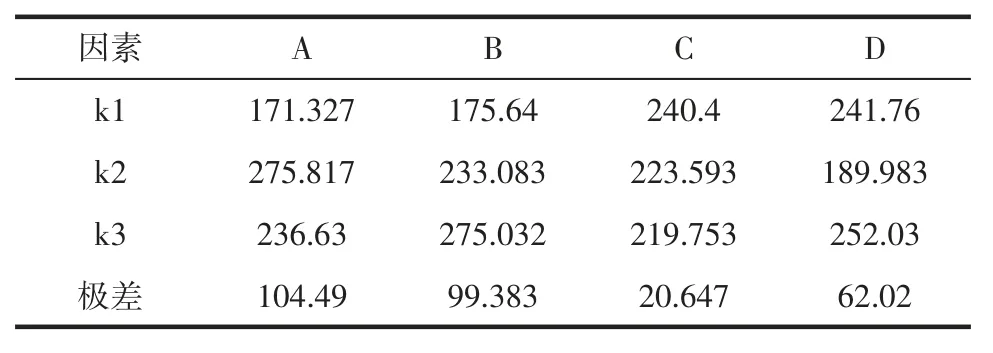
表7 正交试验GABA 直观分析Table 7 GABA intuitive analysis of orthogonal test
正交试验GABA 方差分析见表8。
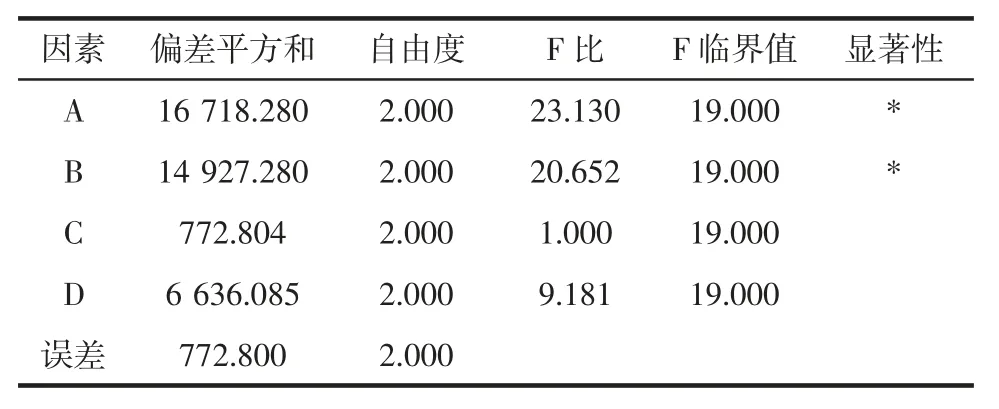
表8 正交试验GABA 方差分析Table 8 GABA variance analysis of orthogonal test
由表8 可知,影响种子发芽的各因素显著次序为NaCl 浓度> pH 值>温度>GA3浓度,其中 pH 值和 NaCl浓度均有显著性影响。
通过正交试验获得海蓬子种子发芽的最优培养液组合为 A2B3C1D3,即 NaCl 浓度为 7 g/L,pH 值为 8,GA3浓度为5 mg/L,温度24 ℃。但在正交设计表中并没有该组合的试验,按此组合补充验证试验,如表9。

表9 验证试验结果Table 9 Results of verification experiments
在此条件下,海蓬子在第5 天时种子发芽率为59.28%,黄酮类化合物含量为31.601 μg/mL.,GABA含量为311.34 mg/100 g,高于正交试验组合,因此此条件为最佳。
2.3 最优条件下关键酶活性变化
发芽过程中GAD、DAO 活性的变化及GABA 含量的变化见图5、图6、图7。
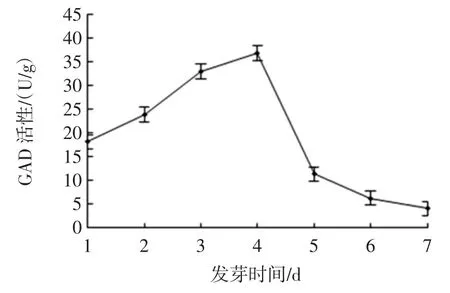
图5 发芽过程中GAD 活性的变化Fig.5 Changes of GAD enzyme activity during germination

图6 发芽过程中DAO 活性的变化Fig.6 Changes of DAO enzyme activity during germination
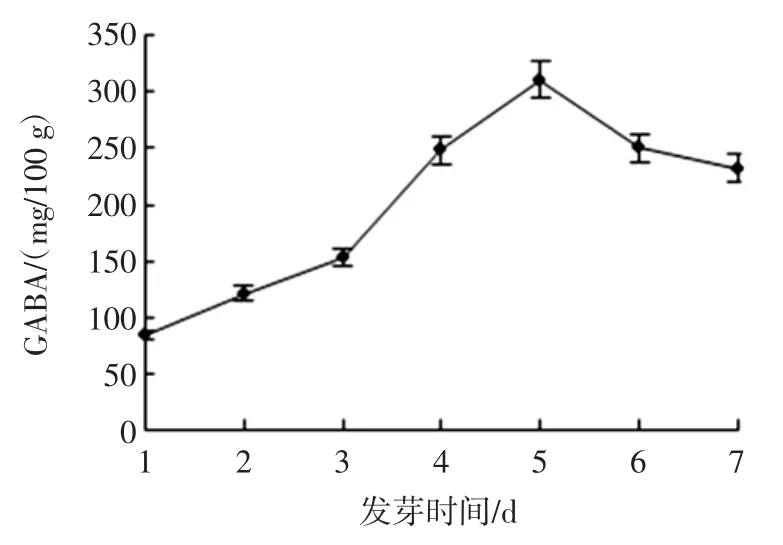
图7 发芽过程中GABA 含量的变化Fig.7 Changes of GABA content enzyme activity during germination
由图5、图6 和图7 可知,最优条件下发芽的海蓬子GAD 和DAO 活性较对照显著提高,培养4 d 时,GAD 和DAO 活性较对照提高了3.10 倍和2.97 倍,结合表3,GABA 的变化趋势与 GAD 和 DAO 相似,GABA 在第5 天含量达到最大值,而GAD 和DAO 活性在第4 天达到最大,这可能是因为种子中的谷氨酸在GAD 和DAO 酶的催化作用下生成GABA 有一定的作用时间。本研究结果与前期文献报道结果一致。白青云等[26]研究表明盐胁迫条件可以使粟谷中GAD 活性增加,植物体内游离态多胺(polyamines,PAs)含量升高,PAO、DAO 活性也随之升高GABA 得以富集。苏国兴等用NaCl 处理大豆幼苗,发现大豆根系GABA 含量随着GAD 活性的提高而提高[27]。
发芽过程中PAL、C4H、4CL 活性的变化及黄酮类化合物含量的变化见图8、图9、图10、图11。
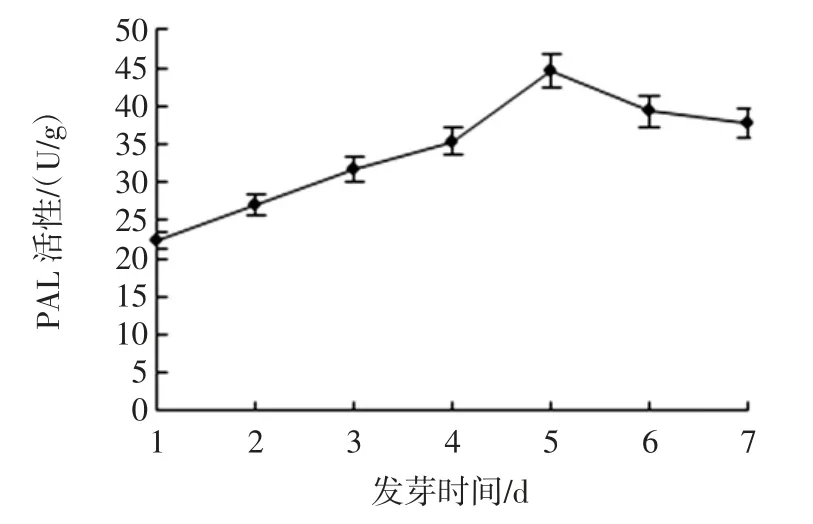
图8 发芽过程中PAL 活性的变化Fig.8 Changes of PAL enzyme activity during germination

图9 发芽过程中C4H 活性的变化Fig.9 Changes of C4H enzyme activity during germination
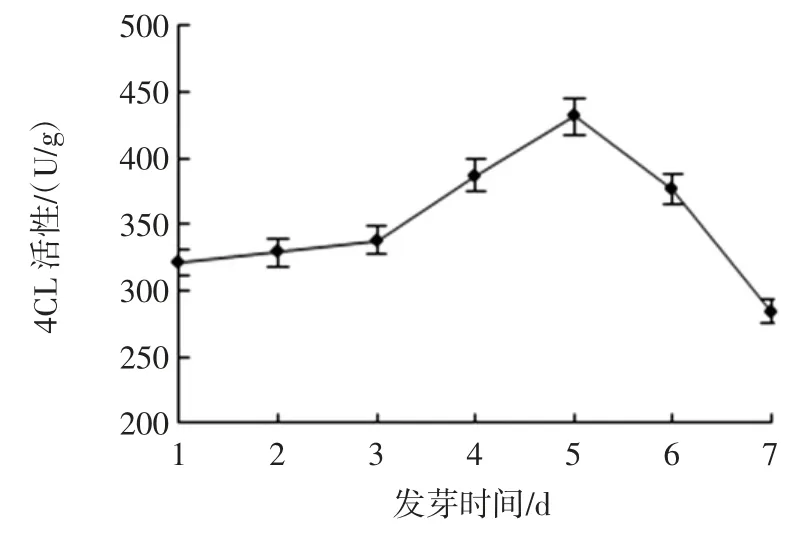
图10 发芽过程中4CL 活性的变化Fig.10 Changes of 4CL activity during germination

图11 发芽过程中黄酮类化合物含量的变化Fig.11 Changes of flavonoids content during germination
由图8、图9、图10 和图11 可知,最优条件下发芽的海蓬子PAL、C4H 和4CL 活性较对照显著提高,培养 5 d 时,PAL、C4H 和 4CL 活性较对照提高了 1.92倍、1.48 倍和1.52 倍,结合表2,黄酮的变化趋势与PAL、C4H 和4CL 酶活性变化一致,在第5 天含量达到最大值。PAL、C4H 和4CL 是苯丙烷类代谢途径的关键酶,可有效调节与之相应的黄酮类化合物等次生代谢产物的合成,而黄酮类化合物是种子发芽过程中对外界环境适应的结果[28]。这与周小理等研究苦荞麦发芽结果一致,苦荞麦进行萌发处理可激活PAL 活性,使得苯丙烷类代谢途径增强,进而黄酮类物质的合成也增加[29]。Suzuki 等[30]研究发现,PAL 活性不仅受植物内源物质的调控,光照、温度、病原菌和植物激素等外源条件同样能影响其活性,刺激次级代谢产物黄酮的生成。
3 结论
本研究通过单因素试验探讨了NaCl 浓度、GA3浓度、pH 值、温度对海蓬子发芽率的影响,经正交试验,以发芽率,黄酮、GABA 含量变化为指标确定了海蓬子最佳的培养条件为NaCl 浓度为7 g/L,pH 值为8,GA3浓度为5 mg/L,温度24 ℃,在此条件下,海蓬子种子发芽率为59.28%,黄酮富集含量为31.601 μg/mL,比发芽初期增加了2 倍,GABA 富集含量为311.34 mg/100 g,比发芽初期增加了3.5 倍。对比最优条件和纯水培养条件的关键酶活性,GAD 和DAO 酶活力呈现先升高后下降的趋势,在第4 天达到最大值,较对照提高了3.10 倍和2.97 倍,对GABA 积累有协同作用;PAL,C4H,4CL 酶活力呈现先升高后下降的趋势,在第5 天达到最大值,较对照提高了1.92 倍、1.48 倍和1.52 倍,与黄酮类化合物含量变化趋势一致。海蓬子在盐碱性条件发芽过程中,GABA 和黄酮类物质均有所增加,但是对于如GaCl2、ABA 等其他盐胁迫条件有待进一步的深入研究。本研究为海蓬子发芽富集活性物质机理提供理论依据以及对开发发芽海蓬子产品具有重要意义。

