不同营养筛查方法对胃癌胃切除患者适用性的对比
韩 菲,卞晓洁,陈大宇,葛卫红*,管文贤
1 徐州医科大学鼓楼临床学院,徐州 221004;南京大学医学院附属鼓楼医院2 药学部,3 胃肠中心,南京 210008
胃癌是常见的恶性肿瘤之一,预后相对较差,严重威胁人类健康[1]。中国胃癌发病例数和死亡例数分别占全球胃癌发病和死亡的42.6%和45.0%,在全球183 个国家中发病率和死亡率分别位于第5位和第6 位[2]。手术是胃癌首选的治疗方案。营养不良是影响外科患者临床结局的重要因素[3],在胃癌患者中营养不良的比例占87%,恶液质的发病率高达65%~85%,超过了其他所有肿瘤,营养不良及恶液质发病率均占所有肿瘤的第一位[4]。与所有营养不良一样,胃癌相关性营养不良也会削弱放化疗的疗效,提高药物不良反应风险,降低骨骼肌质量和功能,增加了术后并发症及院内感染的机会,提高发生率和病死率,延长住院时间,恶化患者的生活质量,增加了医疗费用[5]。总之,营养不良与预后不良密切相关[5]。因此,针对胃癌患者实施全程化合理、规范的营养管理与营养支持尤为重要,而在营养支持实施之前,一套适合于评估此类患者营养风险和营养状况的评估方法显得更为重要。
本研究采用NRS 2002、PG-SGA 来评估胃癌胃切除患者术前营养风险,并结合人体成分分析等多项指标,对比NRS 2002 和PG-SGA 两种筛查方法在胃癌胃切除患者中的适用性,最终为临床合理营养支持方案提供依据。
1 材料与方法
1.1 研究对象
本研究回顾性调查2018 年5 月至7 月在南京大学医学院附属鼓楼医院普通外科胃癌胃切除患者,共91 例纳入研究。患者年龄为26~83(60.83±12.149)岁,其中男性70 人,女性21 人。
1.2 纳入标准和排除标准
1.2.1 纳入标准 术前经胃镜、组织病理活检确诊为胃癌且行胃切除手术者。
1.2.2 排除标准(1)入院治疗期间发现合并有其他恶性肿瘤的患者;(2)术中发现转移灶或者不能按照术前计划行胃癌胃切除转而姑息治疗的患者。
1.3 数据采集
收集以下数据:患者性别、年龄、住院时间、手术时间、出院时间、术前白蛋白、术后并发症、营养状况相关数据。评估方法为:营养风险筛查2002(NRS 2002);患者主观整体评估(PG-SGA);人体成分分析。
1.3.1 营养风险筛查2002(Nutritional Risk Screening 2002,NRS 2002)NRS 2002 是2003 年丹麦与瑞士学者及欧洲肠内肠外营养学分会特别工作组提出的一种营养筛查方法,该法的循证医学依据可靠且简便易行的方法[6]。中华医学会肠外肠内营养学分会推荐在住院患者中使用NRS 2002 作为营养筛查的首选工具。该方法主要包括3 项内容:(1)营养受损状况评分(0~3 分);(2)疾病严重程度评分(0~3 分);(3)年龄评分(0~1 分)。3 项评分相加得出总分(0~7 分),以总得分≥3 分判定为存在营养风险,<3 分为无营养风险。
1.3.2 患者主观整体评估(patient-generated subjective global assessment,PG-SGA)该方法是在主观整体评估(subjective global assessment,SGA)的基础上发展起来的[7]。临床研究提示,PG-SGA 是一种有效的肿瘤患者特异性营养状况评估工具,因而得到美国营养师协会(American Dietetic Association,ADA)等单位的广泛推广与应用。PG-SGA 包括详细的病史及身体评估参数,每个部分的分值为0~4 分,最后算出总得分。主要有4 个方面:(1)体质量丢失的评分;(2)疾病和年龄的评分;(3)代谢应激状态的评分;(4)体格检查评分。总得分:0~3 分为无营养风险(A 级);4~8 分为存在轻度或可疑营养风险(B 级);≥9 分为重度营养不良(C 级)。一般将PG-SGA 评分为B 级或C 级的患者认定为存在营养风险或营养不良。
1.3.3 人体成分分析(Body Composition Analysis)该方法是一种通过电学方法进行人体组成成分分析的技术,众多研究证实,该方法能客观、准确地测定人体组成,且安全无创伤,技术成本和技术难度低,可重复性好,因此逐渐被用于临床上营养状况的评估[8]。在本研究中,使用韩国Inbody 公司生产Inbody 720 人体成分检测仪,在入院24 h 内测量患者的身体水分含量、肌肉量、去脂体重、体脂肪、骨骼肌、浮肿等营养相关指标。
1.4 统计学处理
各项指标按NRS 2002 与PG-SGA 营养风险分级对比,通过SPSS 20.0 进行分析,符合正态分布的计量资料多组比较采用方差分析,不符合正态分布的采用Mann—Whitney U 检验,计数资料比较采用卡方检验,一致性分析采用Kappa 检验,相关性采用Kendall 分析。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基础资料
在纳入的91 例患者中,NRS 2002 评分≥3 分的有39 例,营养风险率为42.9%;PG-SGA 评分4~8 分(B 级)的有44 例,≥9 分(C 级)的21 例,营养风险率(B+C 级)为71.4%。见表1。
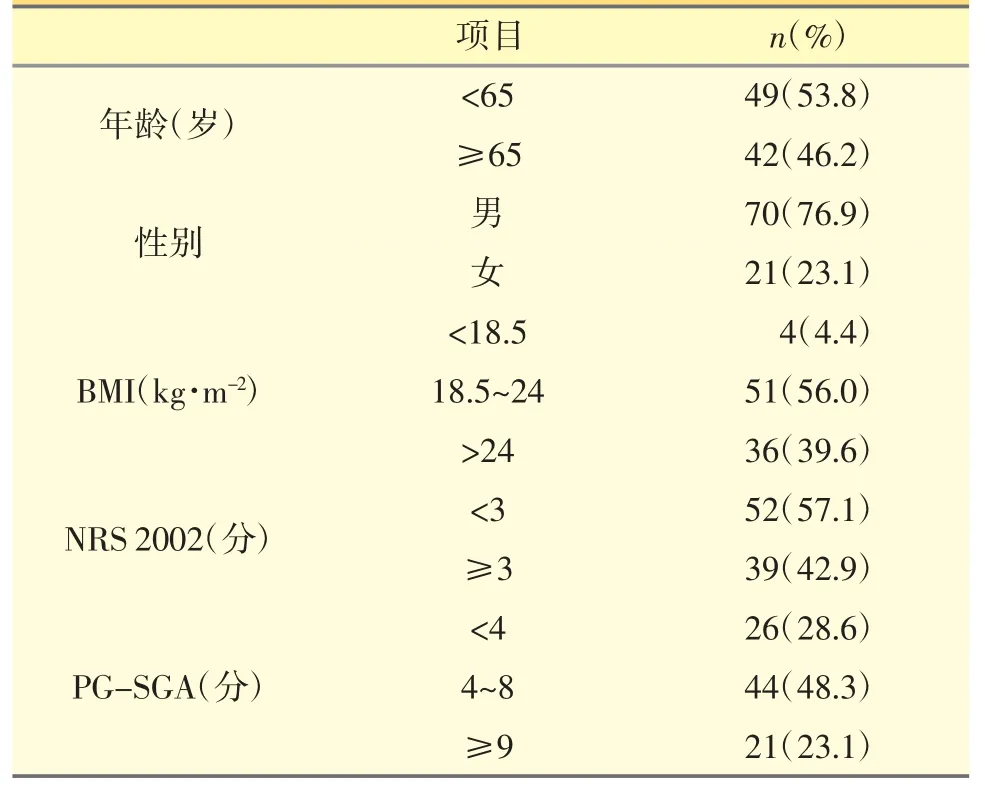
表1 患者基础资料
2.2 NRS 2002 与PG-SGA 的一致性检验
两种评估的一致性检验Kappa=0.188(P<0.05),提示两种筛查方法的一致性较差,结果见表2。
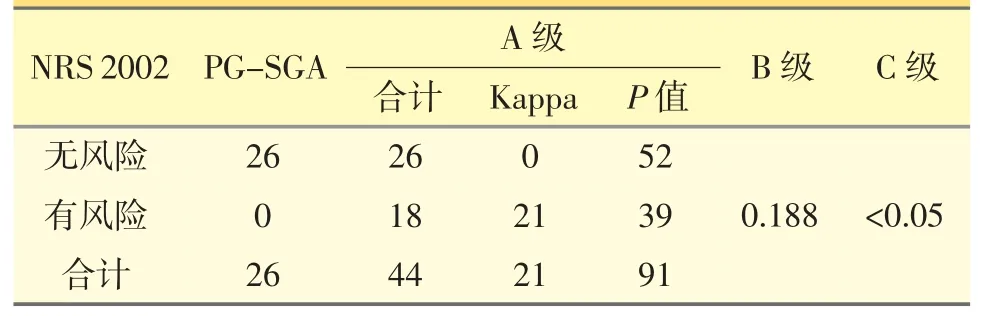
表2 NRS 2002 与PG-SGA 一致性检验结果
2.3 NRS 2002、PG-SGA 营养评估结果
根据NRS 2002 评分将患者分为无风险和有风险两组。有营养风险组BMI、术前白蛋白、身体水分、肌肉量、去脂体重、骨骼肌、上臂周长、上臂无脂周长、基础代谢率等,明显低于无营养风险组,差异均有统计学意义(P<0.05),而与浮肿相关的指标——细胞外液率和细胞外水分率明显高于无营养风险组,差异均有统计学意义(P<0.05);两组之间体脂肪、内脏脂肪2 项差异无统计学意义(P>0.05),结果见表3。
根据PG-SGA 评分将患者分为3 级组:A 级组(无营养风险)、B 级组(轻度或可疑营养风险)、C 级组(重度营养不良)。随着营养风险或营养不良程度的增加,患者术前白蛋白、身体水分、肌肉量、去脂体重、骨骼肌、上臂周长、上臂无脂周长、基础代谢率等,明显低于营养风险或营养不良程度较轻的组,差异均有统计学意义(P<0.05),而与浮肿相关的指标——细胞外液率和细胞外水分率等,明显高于营养风险或营养不良程度较轻的组,差异均有统计学意义(P<0.05);3 组之间BMI、体脂肪、内脏脂肪3项差异无统计学意义(P>0.05),结果见表4。
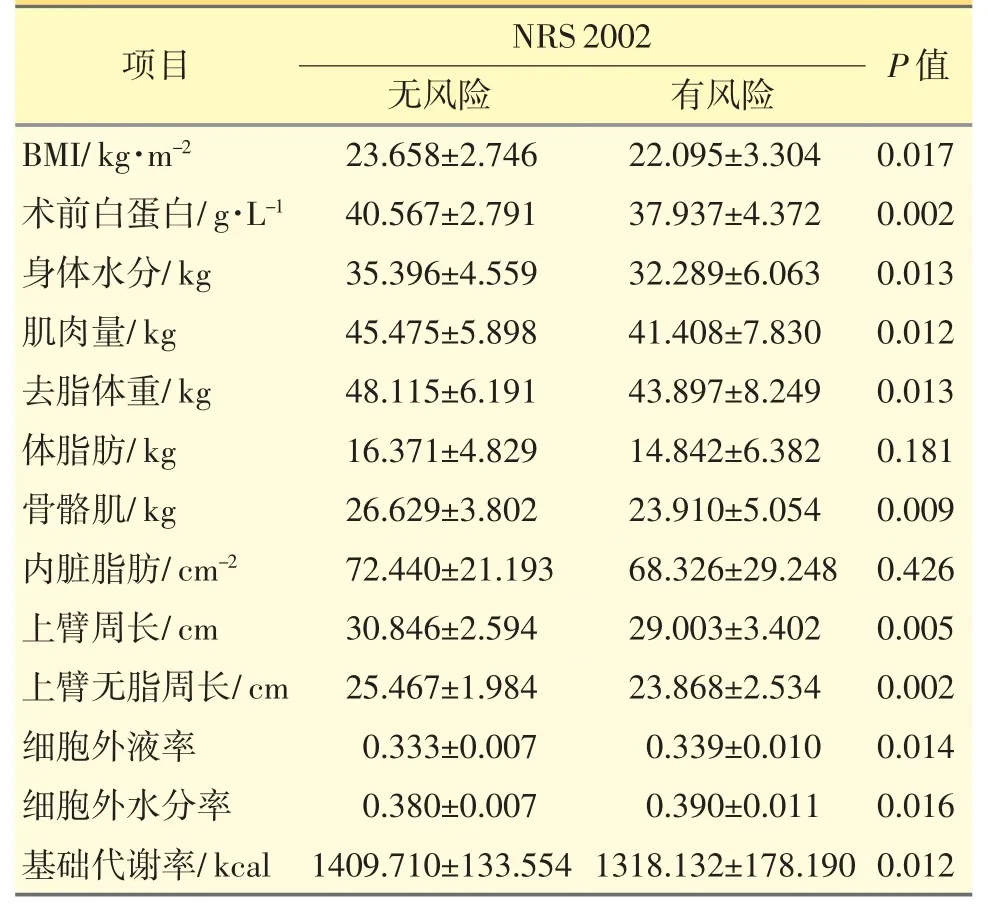
表3 NRS 2002 中不同营养风险组人体成分分析结果对比
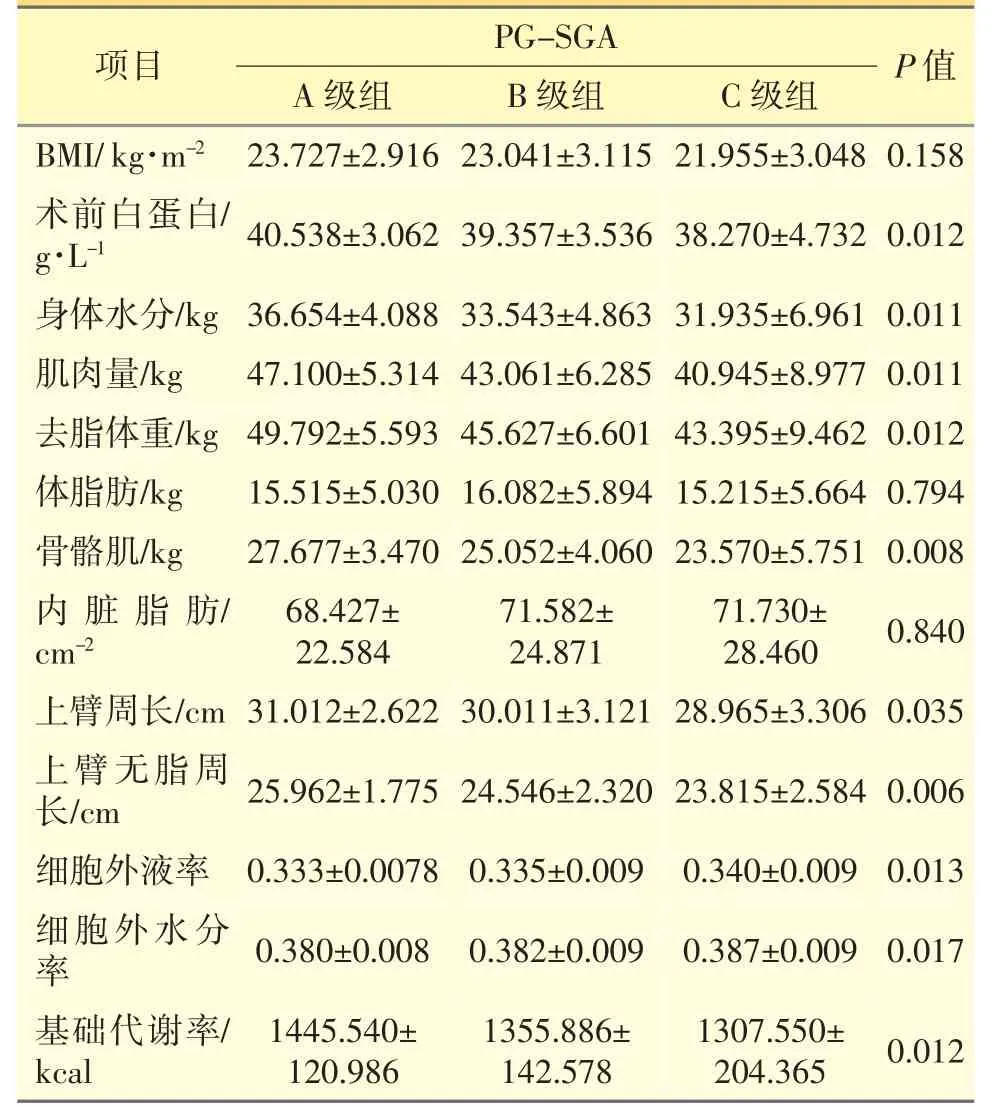
表4 PG-SGA 中不同营养风险组人体成分分析结果对比
2.4 NRS 2002、PG-SGA 评分与人体成分分析指标相关性的对比
将所有患者NRS 2002、PG-SGA 评分与人体成分进行线性相关分析,结果显示,这两种评分与身体水分、肌肉量、去脂体重、骨骼肌、上臂无脂周长、基础代谢率均呈负相关(P<0.05),而与反映浮肿的指标——细胞外液率和细胞外水分率呈正相关(P<0.05);但是NRS 2002、PG-SGA 评分与人体成分分析指标的对比,相关性一般,结果见表5。
2.5 NRS 2002、PG-SGA 与总住院天数、术后住院天数的关系
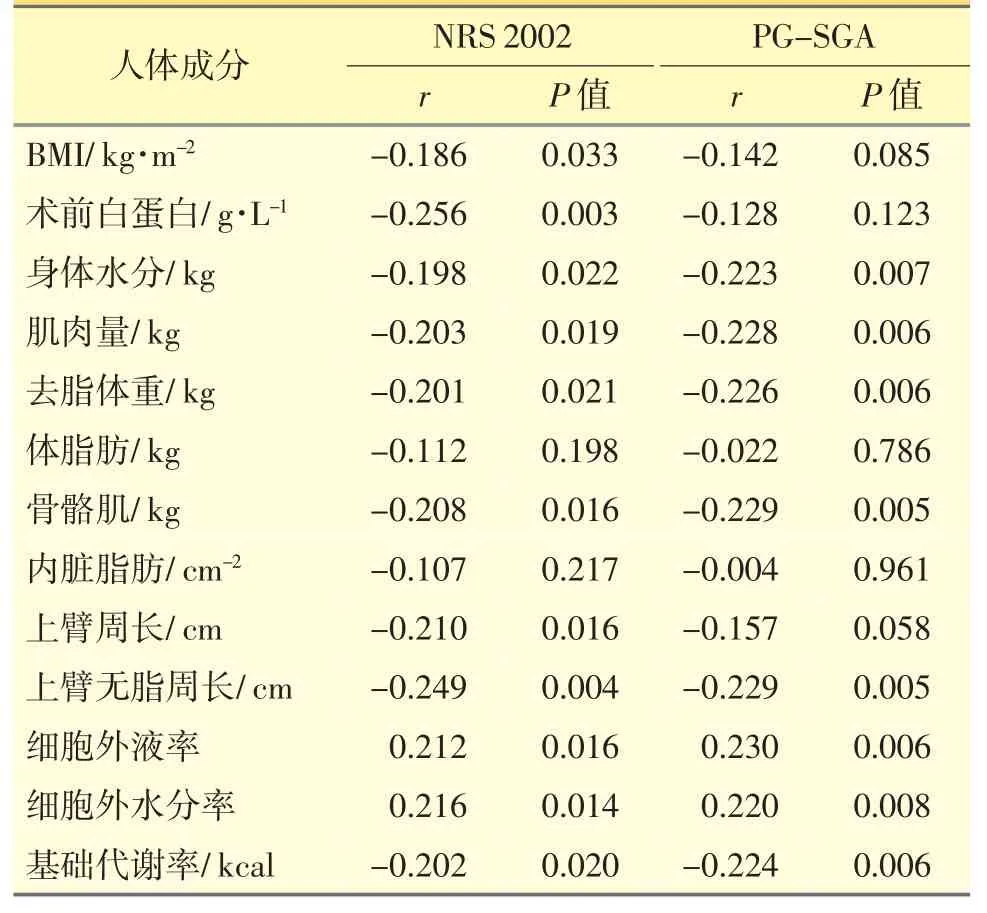
表5 NRS 2002、PG-SGA 评分与人体成分指标的相关性对比
根据NRS 2002、PG-SGA 筛查评估后,比较不同营养风险分级的总住院天数、术后住院天数,显示无统计学差异,P 值均>0.05,结果见表6。
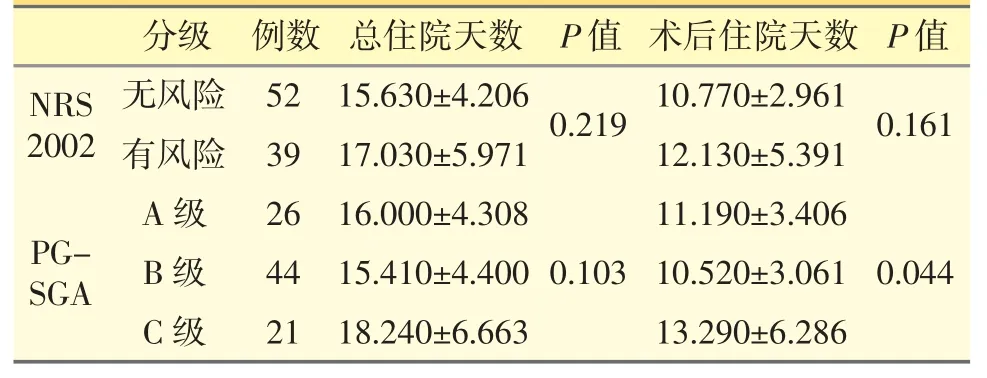
表6 不同营养风险分级的总住院天数、术后住院天数比较
2.6 NRS 2002、PG-SGA 与术后并发症的关系
根据NRS 2002、PG-SGA 筛查的结果,比较有无营养风险分组后、患者术后并发症发生的例数,结果见表7。
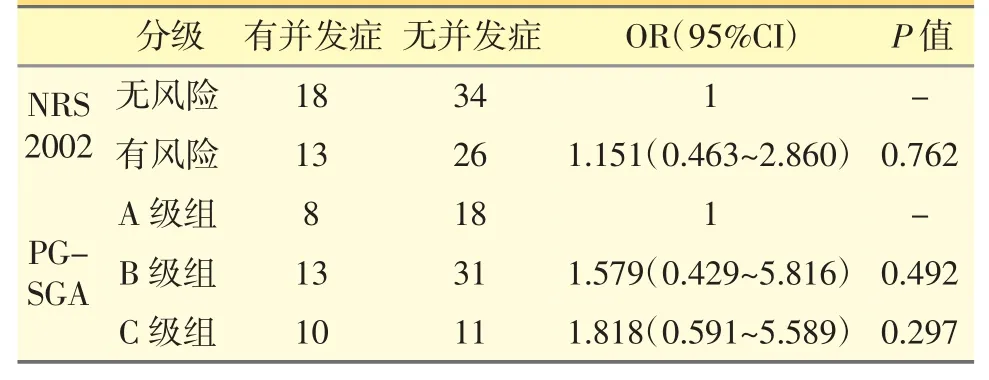
表7 有、无营养风险分组后患者术后并发症的比较
3 讨论
3.1 NRS 2002 与PG-SGA 对营养风险的判断
在纳入的91 例患者中,NRS 2002 筛查后存在营养风险的有39 例,PG-SGA 筛查后存在营养风险的有65 例(B+C 级),Kappa 检验提示,两种筛查方法一致性较差(Kappa=0.188)。由数值上可知,PGSGA 营养风险的筛出率高于NRS 2002,这与其他文献报道一致[9,10]。不难想象,由于NRS 2002 筛查首先是了解患者3 个月内是否出现体重下降以及一周内是否出现摄食减少,临床上很多患者是短期内出现相关症状或者体检发现异常,随即通过就诊,在完善一系列检查后诊断为胃癌,所以近期并未出现体重和饮食的变化,同时在年龄的评分上,NRS 2002 是超过70 岁加1 分;而PG-SGA 除了了解患者体重和饮食的变化,还将饮食情况细化,较为全面地反映肿瘤病人的营养状况,并且年龄超过65 岁、诊断为癌症各加1 分。因此,PG-SGA 营养风险的筛出率高于NRS 2002 是可以理解且符合临床实际的。
3.2 NRS 2002、PG-SGA 与人体成分分析等营养指标的关系
研究结果显示,NRS 2002 不同营养风险分组中BMI、术前白蛋白、身体水分、肌肉量、去脂体重、骨骼肌、上臂周长、上臂无脂周长、浮肿、基础代谢率有统计学差异,而体脂肪和内脏脂肪无统计学差异;与NRS 2002 不同的是,PG-SGA 不同营养风险分组中BMI 无统计学差异,其余都与NRS 2002 一样。因为NRS 2002 评分中包含BMI 这一项目,而PG-SGA 并未涉及,所以统计结果会显示这样的差异。在本研究中,两种筛查方法结合人体成分分析的结果都提示,术前白蛋白、身体水分、肌肉量、去脂体重、骨骼肌、上臂周长、上臂无脂周长、浮肿、基础代谢率等指标都与患者的营养状况相关。
人血白蛋白是由585 个氨基酸组成的单链蛋白质,由肝脏合成,其血清中的含量不仅是患者的营养指标,更是影响其并发症发生率和死亡率的重要指征。肿瘤患者由于自身代谢的需求,机体处于营养不良状态,白蛋白会低于正常值。在本研究中,两种筛查结果显示,存在营养风险的患者术前白蛋白水平低于无营养风险的患者,这与长期以来将白蛋白作为一项重要的营养评估指标的认识是一致的。
肿瘤患者的营养不良以蛋白质-能量不足、营养不良最常见,骨骼肌作为人体最大的蛋白质库,以各种形式贮存着人体约60%的蛋白质。肌肉量、去脂体重、骨骼肌、上臂周长和上臂无脂周长这5个指标都是对机体肌肉水平的反映,各指标的下降,提示营养不良的患者机体更易呈消耗性表现,造成肿瘤患者身体虚弱,生活质量下降[11]。在本研究中,患者被评定为存在营养风险的,以上5 个指标都出现不同程度的下降,这与文献报道的结果是一致的[11]。
徐东平等[12]研究提示,人体成分指标可以有效反映患者营养不良或存在营养风险的情况。将NRS 2002、PG-SGA 评分与人体成分进行线性相关分析,结果提示,这两种评分与身体水分、肌肉量、去脂体重、骨骼肌、上臂无脂周长、基础代谢率均呈负相关,即以上指标越低,评分就越高,患者的营养状况越差;而与反映浮肿的指标——细胞外液率和细胞外水分率呈正相关,这两种指标越低,评分就越低,患者出现浮肿的可能性就越低。NRS 2002、PG-SGA评分越高,身体水分、肌肉量、去脂体重、骨骼肌、上臂无脂周长、基础代谢率相比较其他指标,下降越明显,与此同时,细胞外液率和细胞外水分率升高越明显,提示胃癌胃切除患者营养不良会首先表现在以上指标的变化上。
在本研究中,NRS 2002、PG-SGA 评分与人体成分指标总体相关性一般;但是与水分、肌肉、浮肿等指标有发展为相关性较好的趋势。
3.3 NRS 2002、PG-SGA 与住院天数、术后并发症的关系
在本研究中,NRS 2002、PG-SGA 营养风险组的总住院天数和术后住院天数都较无营养风险组要长;NRS 2002 无营养风险组出现并发症的有18 例,占本组人数的34.6%,有营养风险组出现并发症的有13 例,占本组人数的33.3%;PG-SGA 中A 级出现并发症的有8 例,占本组人数的30.8%,B 级出现并发症的有13 例,占本组人数的29.5%,C 级出现并发症的有9 例,占本组人数的47.6%。住院天数、术后并发症虽无明显统计学差异,但无营养风险组的总体情况还是比有营养风险组要好,这可能是由于本研究样本量较小或与患者的疾病进程有关。
综上所述,NRS 2002、PG-SGA 以及人体成分分析在预测评价胃癌胃切除患者术前营养状况有一定的意义。在本研究中,NRS 2002、PG-SGA 的一致性较差,说明两种评分在单独使用上都存在不同的优势或缺陷,因此在临床实践中应该联合应用,相互补充,这符合2018 年胃癌诊疗规范中关于营养支持治疗的推荐意见[13]。同时,本研究结果提示,NRS 2002、PG-SGA 与人体成分指标中的身体水分、肌肉量、去脂体重、骨骼肌、上臂无脂周长、基础代谢率均呈负相关,与反映浮肿的指标——细胞外液率和细胞外水分率呈正相关,提示胃癌胃切除患者营养不良会首先表现在以上指标的变化上。但在相关性研究时,只有少量指标提示有良好的相关性趋势,所以期望临床上能有大样本的研究,深入分析评分与人体指标的相关性,以此更好地预测患者的营养状况,为围术期甚至出院后家庭营养支持提供可靠的依据。