高温酸性脂肪酶产生菌Acinetobacter sp. Lip-55的筛选、鉴定及其酶学性质研究
陈贵元,刘林波,桑鹏,杨力权*
1(大理大学 基础医学院,云南 大理,671000)2(云南省昆虫生物医药研发重点实验室,云南 大理,671000)3(大理大学 农学与生物科学学院,云南 大理,671003)
脂肪酶(lipase,E.C3.1.1.3) 全称为酰基甘油水解酶(triacylglycerol acylhydrolases),是一类既可水解长链脂肪酸甘油酯生成甘油和长链脂肪酸又可逆向合成的酶类[1]。脂肪酶还是一类具有多种催化功能的酶,能在油-水界面上(异相系统)催化甘油三酯及不溶于水的酯类进行水解和醇解反应,或是在有机体系(有机相系统)中进行酶促合成和酯交换反应[2]。脂肪酶广泛分布于动物、植物和微生物体内,其中以微生物类脂肪酶居多。研究发现,产脂肪酶的微生物有荧光假单胞菌、黑曲霉菌、根霉菌、毛霉圆柱假丝酵母菌、圆弧青霉黏质色杆菌和枯草杆菌[3]。脂肪酶可以催化脂水解、醋交换、醋合成等反应,因而在食品、化妆品、皮革、生物柴油等领域均具有广泛应用。
嗜热脂肪酶和普通脂肪酶相比具有耐高温的特点。嗜热脂肪酶主要分离自一些特殊环境中的微生物,例如热泉、深海热液、废水处理厂等特殊环境微生物。在商业上也因为其在高温下具有较高的反应效率,可以减少微生物污染的可能性,降低反应溶液的黏度,提高底物的溶解度等特点,受到越来越多的重视,并且已经有很多嗜热脂肪酶已经被纯化、克隆和进行性质的研究,并且被运用于洗涤剂和生活污水等方面[4]。
由于高温脂肪酶具有重要的作用及价值,筛选产高温脂肪酶的菌株成了一项重要的工作。本实验以弥渡热泉土样为材料,筛选出产高温脂肪酶的菌株,并对其分类鉴定及酶学性质进行研究,为脂肪酶的发酵工业新备选菌株的开发应用提供资源,为进一步开发利用该菌株提供基础,也为进一步获得产脂肪酶基因的研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 土壤样品
土壤样品来自大理弥渡县石夹泉热泉的底泥,热泉水温55℃。
1.1.2 仪器与设备
CX31型显微镜,奥林巴斯;754型紫外可见光分光光度计,上海菁华仪器公司;DL-8000C高速冷冻离心机,上海安亭科学仪器公司;BPH-9052型恒温培养箱,上海一恒科学仪器有限公司;THZ-82型水浴恒温摇床,常州国华电器有限公司;YXQ-LS-50II型高压蒸汽灭菌锅,上海博迅医疗生物仪器股份有限公司;JJ-CJ-2F型超净工作台,苏州净化设备有限公司;ABI2720型PCR扩增仪,美国ABI;DYCP-31DN型电泳仪,北京六一生物科技有限公司。
1.1.3 试剂
酵母抽提物、蛋白胨,英国进口;琼脂粉,西班牙进口分装;三丁酸甘油酯、NaCl、结晶紫、碘、乙醇、孔雀绿、番红,国产分析纯试剂。DNA抽提试剂盒、PCR扩增试剂盒、胶回收试剂盒和DNA分子量标准品,北京天根生物技术有限公司。
1.1.4 培养基[5-6]
富集培养基(g/L):蛋白胨5,酵母粉1;自然pH值。
筛选培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,三丁酸甘油酯2,琼脂粉20;自然pH值。
LB液体培养基(g/L):蛋白胨10,酵母粉5,NaCl 10; pH值7.0。
基本发酵培养基(g/L):葡萄糖5,蛋白胨20,K2HPO41,(NH4)2SO41,MgSO40.5,橄榄油10,自然pH值。上述培养基均在121 ℃,0.1 MPa下灭菌20 min。
1.2 实验方法
1.2.1 菌株富集
称取石夹泉热泉底泥2 g于45 mL的无菌蒸馏水中,150 r/min,振荡15 min。在无菌条件下,用移液枪吸取5 mL悬液于50 mL的富集培养基中,将接种好的富集培养基置于43 ℃,转速为150 r/min的水浴恒温振荡培养箱中振荡培养24 h。
1.2.2 菌株初筛
将富集好的菌液稀释至10-3、10-6、10-9倍,用移液枪分别吸取稀释的菌液150 μL接种在筛选培养基平板上,涂布均匀。于37 ℃,倒置培养24 h。观察菌落周围若有透明圈出现,说明该菌株能产生脂肪酶。
1.2.3 菌株复筛
将初筛得到的菌株取少量接种于种子瓶(LB液体培养基),55 ℃,培养24 h后,将种子液按2%的接种量接入到发酵培养基,55 ℃,150 r/min水浴摇床培养1周。离心取上清测酶活。
酶活测定:参照文献[7]的方法进行。配制对硝基苯棕榈酸酯(p-NPP)底物溶液(10mmol/L)和对硝基苯酚(p-NP)标准溶液(1 mmol/L):将p-NP标准溶液用1 mol/L的Na2CO3溶液稀释成10,20,30,40,50,60,70,80,90,100 μmol/L 10个梯度,分别取1 mL,再分别加入0.5 mol/L的三氯乙酸1 mL和0.5 mol/L的NaOH 3 mL,混匀后410 nm处测定吸光度,绘制对硝基苯酚标准曲线。
取20 μLp-NPP底物溶液,加入780 μL Tris-HCl缓冲液,37 ℃预热5 min后加入200 μL酶液,反应10 min后加入0.5 mol/L的三氯乙酸1 mL,混匀后放置5 min终止反应,再加入0.5 mol/L的NaOH 3 mL调pH值,(将200 μL蒸馏水替换200 μL酶液,其他条件不变,即得空白),于410 nm处测定吸光度。对照标准曲线算出生成的p-NP浓度,进而计算出酶活力。在一定条件下,每分钟释放出1 μmol对硝基苯酚的酶量定义为1个酶活力单位(U)。
(1)
式中:X为脂肪酶活力,U/mL;c为对硝基苯酚浓度,μmol/L;V为酸碱调节后的反应液终体积,mL;V′为酶液的用量,mL;t为作用时间,min。
1.2.4 菌株鉴定
(1) 形态学、生理生化特征
产酶菌株的形态观察及生理生化实验参照文献[8]的方法进行。
(2) 16S rRNA基因序列测序和分析
根据北京天根生化科技有限公司提供的试剂盒以及说明书进行DNA的提取。使用通用引物 27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′扩增细菌 16S rDNA。扩增条件为:预变性94 ℃,5 min,变性94 ℃,30 s,退火50 ℃,45 s,延伸72 ℃,100 s,最后延伸72 ℃,5 min,循环30次,将PCR产物加入预先制备好的0.8%的琼脂糖凝胶中,140 V,电泳1 h,琼脂糖凝胶回收根据北天根生化科技有限公司提供的试剂盒以及说明书进行PCR产物回收。将PCR回收产物送广州英潍捷基(上海)贸易有限公司测序,将获得的序列提交GenBank (http: / /www. ncbi. nlm. nih. gov),根据BLAST数据库中细菌16S rRNA基因序列进行相似性比较分析,利用MEGA 5.0软件进行系统进化分析。
1.2.5 菌株最适生长温度
按接种量为1%的菌种于LB液体培养基中,置于不同的温度(25、31、37、43、49、55 ℃)下摇床培养24 h,然后在波长600 nm处测定各个温度下菌株生长的吸光值,以确定菌株的最适生长温度。
1.2.6 酶学性质
(1)温度对酶活的影响
将酶液分别在4~75 ℃条件下测定脂肪酶的活力。
(2)pH值对酶活力的影响
在最适酶活温度下,配制不同pH值的反应缓冲液,检测不同的pH值对脂肪酶活力的影响。
(3)酶的热稳定性
将1 mL酶液分别置于不同的温度(4、25、37、55、75 ℃)下保温,在保温15、30、60、90、120 min时测定酶活。以保温0 min温度下所测得的酶活为对照组,其余温度下所测得的酶活与其相比,并计算相对酶活,用相对酶活绘制出酶的热稳定性曲线。
(4)金属离子对酶活力的影响
将1 mL的酶液和10 μL浓度为0.1 mol/L的金属离子(Ca2+、Fe2+、Mn2+、Cu2+、Zn2+、Mg2+、K+)混匀,将其放置到4 ℃冰箱过夜,第2天测定各组酶活力。以未加入金属离子的酶液反应体系作为对照组,测定和观察金属离子对酶活力的影响。
2 结果与分析
2.1 产酶菌株的筛选
根据水解圈直径与菌落直径比值的大小。筛选出3株产高温脂肪酶菌株. 其中1号菌株水解圈直径与菌落直径比值(R1 /R2)最大。经复筛发现3株菌均为分泌型脂肪酶产生菌,且1号菌株酶活最高,达到46.11 U/mL,与初筛的结果相符。因此,选择1号菌株作为后续实验研究菌株,命名为Lip-55,其产生的水解圈如图1所示。

图1 Lip-55菌落产生的水解圈Fig.1 The hydrolysate circle produced by Lip-55 colony
2.2 菌种鉴定
2.2.1 形态学、生理生化特征
Lip-55在LB培养基上37 ℃培养72 h后,菌落呈淡黄色,不透明,圆形隆起,黏稠,不易挑取。革兰氏染色为阳性,菌体呈球杆状(图2),无芽孢。

图2 Lip-55的革兰氏染色(100×)Fig.2 The gram staining of Lip-55
对Lip-55的生理生化特性进行研究,发现V-P实验为弱阳性;甲基红实验结果、吲哚实验、明胶实验结果均为阴性;乳糖发酵实验结果为阴性;葡萄糖发酵实验、蔗糖发酵实验结果均为能利用糖,但不产气。
2.2.2 16S rRNA基因序列及系统发育分析
16S rRNA基因测序,所获得的序列长度为1 439bp,将Lip-55的16S rRNA基因序列与GenBank数据库中的序列进行同源性比对,发现Lip-55与不动杆菌属的16S rRNA基因序列自然聚类,Lip-55的16S rRNA基因序列与15条相似性较高的序列构建系统发育树见图3,从图中可以看出Lip-55与Acinetobactersp. strain W1(KX622562.1)的菌株聚为一群,相似性也最高,为99.82%,表明Lip-55与Acinetobactersp.的亲缘关系最近。

图3 基于16S rRNA基因序列相似性的菌株Lip-55与15株细菌的系统进化树Fig.3 The Phylogenetic tree of Lip-55 and other 15 strains based on 16S rRNA
根据Lip-55的形态学及生理生化特征观察,结合《伯杰氏细菌鉴定手册》(第八版)[9],以及Lip-55 16S rRNA基因序列及系统发育树,将Lip-55初步鉴定为不动杆菌属(Acinetobactersp.)的1株菌,命名为Acinetobactersp. Lip-55。
2.3 菌种的最适生长温度
按照实验方法,在波长600 nm处测定不同温度培养下LB培养基的吸光值,以600 nm处的吸光值为纵坐标,温度为横坐标做温度—吸光值关系曲线,结果如图4所示。
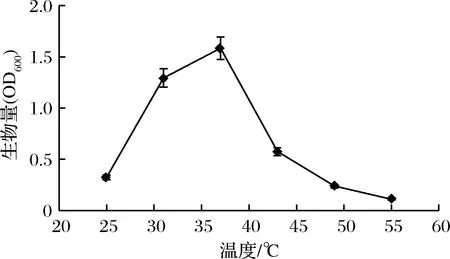
图4 Lip-55菌株生长曲线Fig.4 The growth curve of Lip-55 strain
由图4可知,25~37 ℃菌体的生长量随着温度的升高而增加,37 ℃时,LB培养基在600 nm处的吸光值最高,表明37 ℃是菌株的最适生长温度。37 ℃以后,菌体生长量随着温度的升高而下降,菌株在55 ℃下菌体还能生长,表明菌株属于典型的耐高温菌。
中国食品工业协会常务副会长刘治曾公开表示,对食品工业而言,精准的政策和制度安排、有效市场机制的构建,将最大程度地激发出食品企业的活力,加快淘汰落后产能,扩大优质产能,改善有效供给和中高端供给,实现产业结构的优化升级。
2.4 菌株Lip-55的脂肪酶性质
2.4.1 对硝基苯酚标准曲线
根据制作对硝基苯酚标准曲线的方法,制作出的对硝基苯酚标准曲线线性回归方程为y=0.003 6X+0.000 6,线性相关系数R2=0.990 5,表明线性比较好,可供后续酶活测定使用。
2.4.2 温度对酶活的影响
按照实验方法,在不同温度下测定酶的活性,以酶活力为纵坐标,温度为横坐标做温度—酶活关系曲线(图5)。

图5 温度对Lip-55脂肪酶活性的影响Fig.5 Effect of temperature on the activity of Lip-55 lipase
由图5可知,低温能抑制酶的活性,但不能使酶失活,在4 ℃的条件下,脂肪酶仍具有活性,但活性较低。4~55 ℃,随着温度升高,酶活力增加,在55 ℃时,酶活力达到最大值46.1 U/mL。在55 ℃之后,随着温度升高,脂肪酶活力反而降低。酶在其最适温度范围内,活性最高、酶促反应速率最大。超过最适酶活温度,反应速度反而下降[10-11]。表明该脂肪酶的最适反应温度为55 ℃,属于典型的耐热脂肪酶,脂肪酶的最适反应温度一般在30~50 ℃[12],许多利用脂肪酶的工业催化过程都要求较高的反应温度,如纸浆脱脂脱墨、皮革脱脂、牛奶脱脂生产等,本研究获得的脂肪酶最适催化温度为55 ℃,表明该脂肪酶具有潜在的工业应用价值。
2.4.3 脂肪酶的最适反应pH
由图6可知,酶活随着反应液pH的增大呈现先增大后减小的趋势,在pH 5.5附近达到最大值,继续增大反应体系pH,该脂肪酶活力反而下降,可能是碱性条件影响了酶与底物的结合,或者是碱性环境下,脂肪酶蛋白质的结构和稳定性都遭到了破坏。因此该酶的最适反应pH值为5.5,属于酸性脂肪酶。酸性脂肪酶可作为饲用酶制剂应用于饲料工业,还可作为药物治疗消化功能不足的疾病[13]。该酶的最适反应pH值为5.5,表明该脂肪酶具有潜在的饲料加工及药用价值。

图6 pH对Lip-55脂肪酶活性的影响Fig.6 Effects of pH on the activity of Lip-55lipase
2.4.4 脂肪酶热稳定性
按照实验方法进行实验,测定其各个温度下不同时间点脂肪酶的酶活,以保温0 min温度下所测得的酶活为对照组,其余温度下所测得的酶活与其相比并计算相对酶活,用相对酶活绘制出酶的热稳定性曲线,结果如图7所示。

图7 Lip-55脂肪酶的热稳定性Fig.7 Thermostability of Lip-55 lipase
由图7可知,脂肪酶在25 ℃以下,Lip-55脂肪酶能够在长时间内保持相对稳定的酶活。表明该酶可在较低的温度下保存,酶在75 ℃保温120 min,相对酶活损失近90%,菌株产生的酶虽然是高温脂肪酶,但酶在较高的温度下,酶活性随着保温的时间延长而降低,可能是高温使酶蛋白的分子结构遭到破坏,酶表现出热稳定性较差的特性。
2.4.5 金属离子对酶活力的影响
本实验中将加有金属离子的稀释酶液在4℃保温过夜,以未加入金属离子的酶液反应体系作为对照组,测定各种金属离子对酶活力的影响结果,如表1所示。

表1 金属离子对Lip-55纤维素酶活的影响Table 1 The effect of metal ions on Lip-55 Lipase activity
由表1可知,Ca2+、Zn2+和Mg2+对脂肪酶的活力有一定的抑制作用,Ca2+、Zn2+和Mg2+可能与该脂肪酶的活性中心基团相结合,抑制酶的活性中心与底物结合,使酶活性降低。K+、Mn2+、Fe2+、Cu2+均对该脂肪酶有一定的促进作用,其中Fe2+对Lip-55脂肪酶酶活促进作用较为明显,因此,该脂肪酶在应用过程中,可以根据需要在反应体系中添加K+、Mn2+、Fe2+、Cu2+提高酶活力。
3 结论
脂肪酶是一类广泛应用于工业领域的生物催化剂,具有重要的应用价值。脂类水解酶广泛存在于动物、植物和微生物中,由于动植物脂肪酶作用底物的范围窄,体外活性和产量都很低,所以现在工业上所用的脂肪酶都来源于微生物[13-17]。本实验采用传统鉴定方法结合分子生物学技术对菌株进行鉴定,最终确定该菌株在分类和进化中的地位。在工业生产中,耐热酶与常温酶相比具有诸多优势:(1)工业生产中,能降低系统冷却要求,减少能耗;(2)可通过热处理简化酶的提纯,降低制备酶的成本;(3)使酶便于运输和储藏。因此,广泛开展细菌脂肪酶,特别是嗜热细菌脂肪酶的研究具有重要意义。嗜热细菌(Thermophilicbacteria)通常指能在55℃以上生长的细菌,主要分布于火山口、堆肥、温泉和工厂废水排放口附近。嗜热细菌所产的酶往往具有极强的耐热性,在工业生产中具有巨大的应用价值[18]。本实验从大理弥渡白总旗热泉筛选到1株能向胞外分泌高温脂肪酶的菌株,经初步鉴定为不动杆菌,命名为Acinetobactersp.Lip-55。菌株最适生长温度为37 ℃,菌株在55℃仍能生长。酶学性质研究表明,最适作用温度为55℃,与沈晓莉等报道的嗜热脂肪酶S3具有相似的酶学特性[19],最适pH值为5.0,为酸性脂肪酶。酶在25 ℃以下能在较长时间内保持稳定,Ca2+、Zn2+和Mg2+对Lip-55脂肪酶的活力有一定的抑制作用,Mn2+、K+、Fe2+、Cu2+均对Lip-55脂肪酶活力起促进作用,其中Fe2+的促进效果最为明显。该脂肪酶在大多数金属离子存在下均展现出较好的催化活性,表明该脂肪酶在处理含有金属离子的制革废水方面具有潜在的应用价值。本研究可为脂肪酶发酵工业新型菌种资源的筛选和开发应用提供基础。

