早期胚胎停育绒毛滋养层细胞病理学变化
朱旗,董艺超,张璐,马旭* ,夏红飞*
(1.国家卫生健康委科学技术研究所遗传优生中心,北京 100081;2.北京协和医学院研究生院,北京 100730)
早期胚胎停育,又称稽留流产(missed abortion,MA),是孕早期胚胎停止发育或死亡、并滞留在宫腔内未自然排出的一种特殊情况的自然流产[1]。既往研究表明,许多危险因素参与了胚胎停育的发生,如胎儿的染色体异常,母体在孕早期受到物理、化学因素的不良影响,母体自身的健康状况如感染、生殖器畸形、内分泌失调、自身免疫疾病等。然而,该疾病的发病机制目前尚未完全明确。
据报道,绒毛滋养层细胞出现异常,子宫内环境改造不足可以引发妊娠早期终止[2]。绒毛膜是由滋养层和胚外中胚层构成的膜,在胚胎植入过程中,滋养层细胞迅速增生并分化为内层的细胞滋养细胞和外层的合体滋养细胞。滋养层细胞有节制地侵入母体子宫蜕膜,对母体子宫蜕膜进行改造,以维持母胎界面的适度环境。妊娠早期,血管的生成和维持是胚胎发育以及胎盘形成的基础。血管内皮生长因子(vascular endothelial growth factor,VEGF)是内皮细胞的特异性生长因子,可增加滋养层细胞的增殖、侵袭能力,在调节滋养层细胞侵入方面发挥重要作用[3-4],已成为胚胎停育发病机制研究中的热点。滋养层细胞表达细胞角蛋白19(cytokeratin-19or keratin-19,CK19)以及波形蛋白(Vimentin)[5-6],通过观察这两种蛋白的表达来研究MA胎盘中的滋养层细胞和间质细胞组成,了解胎盘细胞的变化。细胞凋亡是个体发育过程中由基因编码的细胞主动死亡过程,对调控机体发育、维护内环境稳定起着重要作用。本研究拟通过检测MA患者胎盘绒毛的VEGF、CK19和Vimentin表达以及细胞凋亡情况,来探讨MA绒毛滋养层细胞的病理学变化,为临床上MA的筛选、诊断及治疗提供一定的理论基础。
资料与方法
一、研究对象
选择2011年12月至2013年12月于河北石家庄第六医院门诊就诊的260例MA患者(孕周<12周)作为研究对象,年龄19~46岁,孕8周前B超检查提示胚胎发育良好,可见原始心管搏动,孕8~12周经临床诊断为MA。选择同期该院自愿行人工流产的正常早孕孕妇(孕周<12周)作为对照组,共396例,年龄17~48岁,B超提示胚胎发育正常。
排除标准:服用紧急避孕药物;生殖系统结构、内分泌、凝血功能异常;糖尿病、心血管疾病、系统性红斑狼疮、甲状腺功能异常等其他全身性疾病病史;妊娠期疾病如高血压、糖尿病等疾病;孕前期及孕期接触有毒有害物质;自身或者其配偶染色体异常;不良生活习惯如抽烟、酗酒、吸毒等;母儿血型不合、多胎妊娠等。
所有样本均在征得患者知情同意下进行采集,其使用和处理均按国家卫生健康委科学技术研究所伦理委员会相关管理和监督条例及标准进行,取得伦理委员会决议(2011第06号)同意。
取MA组及对照组患者的胎盘绒毛组织送至北京龙迈达科技公司制成组织阵列芯片,样本按≤25岁、26~30岁、31~34岁、≥35岁年龄区间分组,每组随机挑选10对(病例及对照)进行分析。
二、方法
1.免疫组化:免疫组化采用二步法染色,VEGF、CK19及Vimentin鼠抗人单克隆抗体均购自美国Santa Crutz公司,工作浓度1∶50。山羊抗小鼠IgG二抗(工作浓度1∶50)、DAB显色试剂均购自北京中杉金桥公司,染色步骤按说明书进行,PBS代替一抗做阴性对照。使用H-score评分法对免疫组化阳性信号进行判定:H-score=Σpi(i+1),式中pi表示阳性细胞数量占切片中所有细胞数量的百分数,i代表着色强度[7]。每个样本随机挑选3个高倍视野(×400)进行观察,应用ImageJ软件中的IHC Profiler插件对每张图片的阳性信号进行评分判定[8],细胞内呈深棕黄色计为3分,呈现棕黄色计为2分,呈现淡黄色计为1分,均无着色计为0分。H-score得分越高,反映阳性结果表达量越高。
2.细胞凋亡检测:采用Tunel检测法,DeadEndTMColorimetric Apoptosis Detection System 试剂盒购自美国Promega公司,实验流程严格按照说明书进行。将经过二甲苯脱蜡、无水乙醇水化的组织切片放到4%多聚甲醛中固定,用20μg/ml的蛋白酶K进行透化处理,再次固定之后使用平衡缓冲液平衡,随后用生物素化的核酸混合液在37℃下标记60min,清洗之后用0.3%的 H2O2封闭,最后经DAB显色,至淡棕色背景为止。用高压消毒过的水代替rTdT酶设置阴性对照,阳性染色物胞核呈棕黄色。高倍镜下随机观察3个视野(×400)计数阳性细胞,凋亡指数(apoptosis indexes,AI)=阳性细胞数/细胞总数。
三、统计学分析
应用Graphpad Prism 7.0统计分析软件对数据进行分析,两组间比较采用t检验,多组间比较采用ANOVA分析。P<0.05表示差异有统计学意义。
结 果
一、两组绒毛滋养层细胞中VEGF表达水平比较
本研究检测了MA组及对照组绒毛组织中VEGF的表达,发现MA组和对照组绒毛组织中均有VEGF表达,主要定位于滋养层细胞的细胞质及间质细胞中(图1)。对阳性结果进行统计分析,MA组绒毛滋养层细胞中VEGF表达水平显著低于对照组(P<0.01)。≤25岁、26~30岁、31~34岁、≥35岁年龄分组中MA组的VEGF表达量均低于对照组,其中≥35岁分组中MA组与对照组有统计学差异(P<0.05)(表1)。
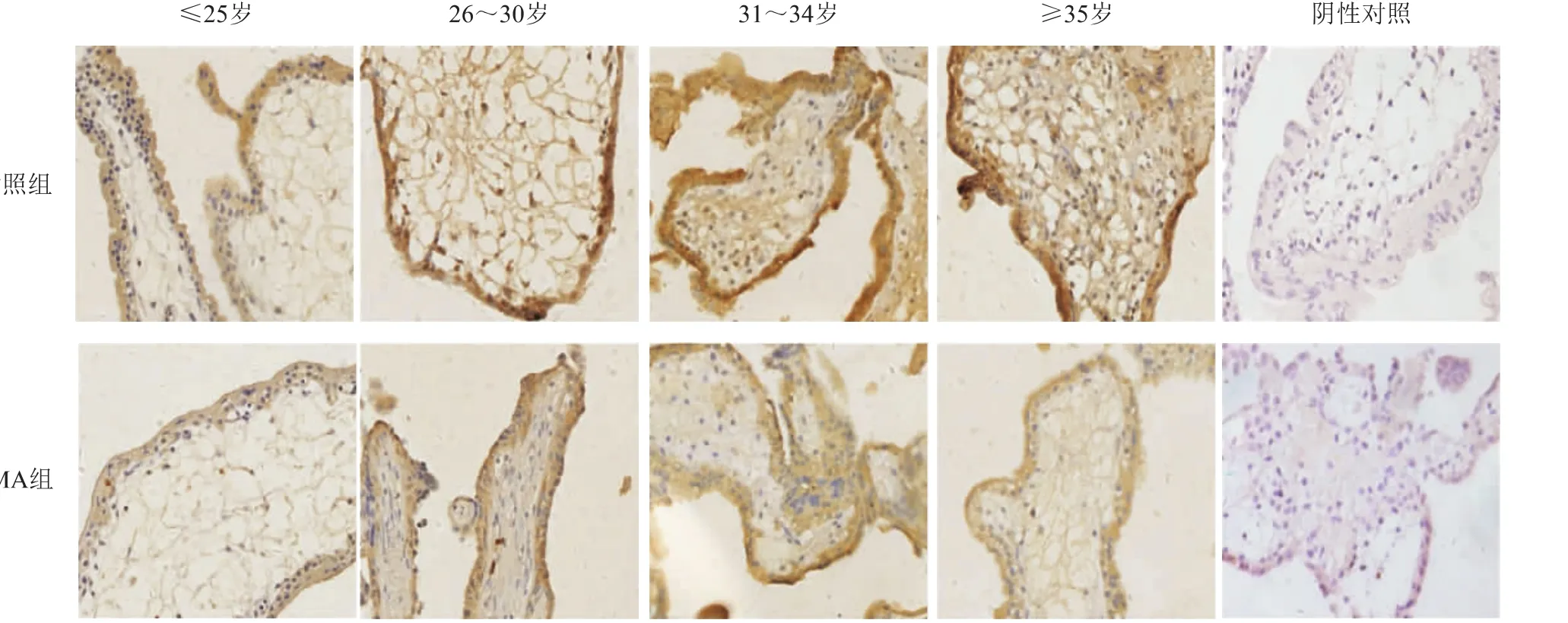
图1 VEGF在正常早孕绒毛和MA绒毛组织中的表达(免疫组化,×400)

表1 对照组和MA组绒毛滋养层细胞VEGF表达水平比较(n=10)
二、CK19和Vimentin在对照组和MA组绒毛组织中的表达变化
CK19反映滋养层细胞分布情况,Vimentin反映绒毛间质细胞的分布情况。本研究检测了MA组及对照组中CK19和Vimentin的表达。结果显示,MA组和对照组均可见CK19表达,主要分布于细胞滋养细胞和合体滋养细胞中(图2),且在MA组及对照组中的表达水平无显著性差异(P>0.05)(表2);Vimentin在MA组及对照组中均有表达,主要位于间质细胞中,滋养层细胞偶有弱阳性表达(图2),Vimentin在MA组中的表达水平略高于对照组,但两组之间无统计学差异(P>0.05)(表3)。

表2 对照组和MA组绒毛滋养层细胞CK19表达水平比较(n=10)

表3 对照组和MA组绒毛滋养层细胞Vimentin表达水平比较(n=10)

图2 CK19和Vimentin在正常早孕绒毛和MA绒毛组织中的表达(免疫组化,×400)
三、MA患者绒毛滋养层细胞凋亡情况
为了了解MA患者及正常早孕绒毛滋养层细胞的凋亡情况,本研究利用Tunel法检测了两组绒毛组织中的细胞凋亡,结果显示,对照组和MA组的绒毛滋养细胞,包括合体滋养细胞和细胞滋养细胞、间质细胞均可见细胞凋亡发生(图3),MA组绒毛滋养层细胞的凋亡指数显著高于对照组(P<0.001)(表4)。

表4 对照组和MA组绒毛滋养层细胞凋亡指数的比较

图3 Tunel法检测细胞凋亡(×400)
讨 论
一、胚胎停育胎盘绒毛滋养层细胞入侵情况
胎盘与母体相接触的绒毛滋养层细胞是一种具有侵袭能力的内皮细胞。VEGF作为一种特异性血管内皮生长因子,可促进滋养细胞增殖、浸润以及绒毛血管的形成,是调节胎盘血管生成和螺旋动脉重塑的重要因子[9-10]。VEGF异常表达可引起胚胎种植、胎盘形成等障碍,是造成自发流产的重要原因[11]。本研究通过检测MA患者绒毛及正常早孕绒毛滋养层细胞中VEGF的表达水平,分析MA绒毛组织及正常早孕绒毛组织中的滋养层细胞侵入程度差异。结果显示,MA滋养层细胞中的VEGF表达量相对较低,这与多项研究中自然流产胎盘组织的 VEGF表达水平较低这一结果[12-14]相一致,提示MA患者绒毛滋养层细胞VEGF的低表达与这一疾病的发生相关。由此推测,妊娠期滋养层细胞表达的VEGF特异性促进滋养层细胞的增殖及迁移,促进了滋养层细胞对子宫蜕膜的侵袭,而MA患者绒毛滋养层细胞的VEGF表达水平低下,导致滋养层细胞的增殖迁移能力异常,侵袭能力下降,对子宫内膜和肌层的侵入程度不足,未能形成充足的胎盘血管以维持胚胎的供血,最终导致MA发生。
二、滋养层细胞和绒毛间质细胞分布情况
细胞角蛋白Cytokeratin是一种发现于上皮细胞胞浆内的细胞骨架蛋白,起构建细胞纤维骨架并进一步参与细胞分化的作用[15]。CK19已经成为一种常见的肿瘤检测标记物[16],在肿瘤细胞中特异性表达。CK19是否也在MA过程中特异性表达,尚未有明确报道。波形蛋白Vimentin是一种Ⅲ型中间丝蛋白,表达于间充质细胞和部分外胚层细胞,在正常上皮细胞中不表达,是间叶组织来源细胞的标记。上皮细胞间质细胞转化(epithelial-mesenchymal transition,EMT)是有极性的上皮细胞向可以在细胞基质间移动的间质细胞转变的一个可逆过程,细胞滋养层细胞的迁移侵润途径类似于EMT过程[17]。本研究显示正常早孕绒毛组织及MA患者绒毛组织中均有CK19以及Vimentin的表达,CK19主要分布于滋养层细胞中,而Vimentin主要表达于绒毛间质细胞中,MA组和对照组之间未见CK19及Vimentin的表达差异,提示MA发生过程中滋养层细胞和间质细胞分布没有差异。这可能与早期妊娠中胎盘绒毛的侵袭转移和融合这一动态EMT过程有关,在滋养层细胞发生侵袭转移的开始会有一部分滋养层细胞丢失上皮细胞特征,转变为间质细胞;而滋养层细胞发生融合时会分化出表现上皮细胞特性的新的合体滋养细胞,随着细胞形态的动态改变,CK19和Vimentin表达量也处于不稳定的变化过程中,推测由此造成了本研究中未观察到MA组和对照组间CK19和Vimentin表达量的显著性差异。
三、胎盘细胞凋亡情况
正常妊娠存在一定程度的滋养层细胞凋亡,过度凋亡会影响细胞侵袭及血管新生,进而影响胚胎植入和生长并造成流产[18-19]。本研究显示在 MA患者绒毛及正常早孕绒毛滋养层细胞中均存在细胞凋亡,说明细胞凋亡参与妊娠胎盘绒毛的发育,调控胎盘绒毛组织结构的改建,抑制绒毛滋养层细胞对子宫的过度侵袭。对比两组之间的凋亡指数,MA组绒毛滋养层细胞的凋亡情况较对照组严重,提示滋养层细胞凋亡异常与MA的发生密切相关。这一结果与目前许多文献报道相符,推测滋养层细胞大量凋亡导致滋养层细胞的增殖与凋亡平衡打破,使绒毛生长受限、侵袭不足,从而阻碍孕卵发育,引发 MA[20-22]。
综上所述,本研究显示VEGF在胎盘绒毛滋养层细胞中的低表达及绒毛滋养层细胞凋亡指数增加与MA发生密切相关,提示胎盘血管生成减少和滋养层细胞过度凋亡是造成MA的部分原因,为临床上通过检测患者绒毛组织的VEGF表达水平及细胞凋亡情况,有针对性的对患者进行监护和治疗,预防MA发生这一方案提供了一定的理论基础。进一步研究引起VEGF低表达及细胞凋亡异常的分子作用机制,有助于解释MA发生的具体原因,进而为预防和治疗稽留流产找到解决方案。

