胀袋酱油中污染细菌的鉴定分析
麻颖垚,郭天文,岳跃成,袁再顺,王勇,胡萍*
(1.贵州大学 酿酒与食品工程学院,贵阳 550025;2.贵阳味莼园食品有限公司,贵阳 550600)
酱油是中国传统的调味品,是以豆类作为原料,经制油、发酵等程序酿造而成,具有独特的风味,有助于促进食欲[1];腐败微生物的存在不仅会影响酱油的外观与口感,还会产生一系列腐败现象[2],如产气、胀瓶甚至爆瓶等现象,影响酱油的品质,进而造成严重的经济损失[3]。酱油成分富含氨基酸、糖类、酸类等极易被微生物利用的物质,在贮藏过程中的温度发生变化时,一些污染菌,特别是产气类杂菌便会利用酱油成分产生气体,影响酱油的品质与货架期,对企业造成巨大损失[4,5]。
PCR-DGGE可以快速、准确探索环境中微生物多样性和群落结构[6],胡萍等[7,8]利用该技术对真空包装火腿中的微生物检测发现主要细菌为清酒乳杆菌和弯曲乳杆菌;Kim等[9]通过该技术鉴定出中国豆酱中的主要菌种为芽孢杆菌。
本实验针对某公司酿造酱油产品出现胀瓶、胀袋现象,利用PCR-DGGE技术对胀瓶、胀袋酱油中的细菌群落组成进行分析并鉴定主要污染菌群,为酱油的质量安全控制提供了依据,为解决酱油胀袋问题提供了参考。
1 材料与方法
1.1 主要材料与设备
1.1.1 试验样品
样品采自某调味品生产股份有限公司,共5个样,储存于4 ℃下备用,其中A样品与D样品胀气程度一般,C样品胀气较严重,而B样品与E样品严重胀气。
1.1.2 主要试剂
溶菌酶、丙烯酰胺、去离子甲酰胺、甲叉双丙烯酰胺、Tris-平衡酚、TE缓冲液(pH 8.0):北京Solarbio公司;溴化乙锭(EB):美国Sigma公司;PCR引物试剂:由上海捷瑞生物技术有限公司合成;Go Taq Green Master Mix(2X):美国Promega公司;2000 bp DNA Marker与6×loading buffer:大连Takara有限公司;无水乙醇:重庆川东化工有限公司;实验所用其他无机试剂、有机试剂(均为分析纯):市售。
1.1.3 主要仪器
P型移液枪 法国Gilson公司;LDZX-50KBS灭菌锅 上海申安医疗器械厂;S1000TMThermal Cycler PCR仪、Gel DocXR凝胶成像系统、DcodeTMUniversal Mutation Detection System电泳仪 美国Bio-Rad公司;Micro 17R微量高速冷冻离心机 美国Thermo Electron公司;DK-98-Ⅱ电热恒温水浴锅 天津市泰斯特仪器有限公司;BC/BD-270SH海尔冰柜 青岛海尔股份有限公司;LX-100迷你离心机、HW-80A漩涡混合机 江苏省海门市麒麟医用仪器厂;HPX-9082MBE数显电热培养箱 上海博讯实业有限公司医疗器械厂;HZQ-X100恒温振荡培养箱 太仓市实验设备厂;Master-E实验室超纯水机 上海市和泰仪器有限公司;洁净台 苏州市金净净化设备科技有限公司。
1.1.4 试剂的配制
母液50×TAE:准确称取Tris 242 g,加入800 mL去离子水,充分搅拌溶解,然后加入57.1 mL冰醋酸,混匀后加入ddH2O定容至1 L,室温保存。
溶菌酶(50 mg/mL):准确称取0.05 g溶菌酶粉末,完全溶解于1 mL无菌双蒸水中。
琼脂糖(1.2%):称取0.225 g琼脂糖加入20 mL 1×TAE缓冲液中,微波炉加热时完全溶解。
10% SDS:称取10 g SDS,加入90 mL去离子水,加热68 ℃,加入HCl调节pH至7.2,定容至100 mL。
1×TAE:用母液50×TAE稀释,20 mL母液与980 mL去离子水混合。
0.5×TAE:用母液0.5×TAE稀释,10 mL母液与990 mL去离子水混合。
CTAB裂解液:Tris 100 mmol/L,EDTA 10 mmol/L,2% CTAB(W/V)pH 8.0,高压灭菌,室温保存。
1.2 试验方法
1.2.1 样品中总DNA的提取方法
样品中总DNA的提取方法参照文献[10,11]:取2 mL样品置于2 mL离心管中离心,富集3次,收集沉淀,取上述沉淀加入300 μL溶菌酶(浓度为50 mg/mL),混匀后置于37 ℃水浴1 h;然后加入10% SDS 200 μL后置于60 ℃水浴20 min;再加入NaCl,同时加入CTAB裂解液600 μL,置于65 ℃水浴15 min;将上述混合溶液以12000 r/min离心6 min后吸取上清液加入等体积25∶24∶1(Tris-饱和酚∶氯仿∶异戊醇)再次以12000 r/min离心6 min;吸取上清液加入等体积的24∶1(氯仿∶异戊醇),以12000×g离心6 min后收集上清液转入新的离心管,加入1/10 NaAc(醋酸钠)于4 ℃下沉淀3 h后取出,12000×g离心10 min,倒掉上清液,使用冰乙醇洗涤DNA,置于超净台无菌风干后转入PCR管,加入50 μL TE缓冲液于-20 ℃保存。
1.2.2 PCR扩增
参照文献[8]和文献[11]有所改动,采用嵌套式PCR进行扩增。
第一轮扩增:使用27F[12](AGA GTT TGA TCC TGG CTC AG)和1492R(GGT TAC CTT GTT ACG ACT T)通用引物进行16S rDNA全长扩增。反应体系(25 μL):1.5 μL模板DNA,引物(1 μmol/L)各2.5 μL,Go Taq Green Master Mix(2X)12.5 μL,双蒸水6 μL。PCR反应程序:95 ℃预变性2 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min,25个循环,最终72 ℃延伸2 min。
第二轮扩增:使用GC-338F[13](GC夹-ACT CCT ACG GGA GGC AGC AG)和518R(ATT ACC GCG GCT GCT GG)引物以第一轮PCR产物进行扩增,反应体系为25 μL(同上)。PCR反应程序:94 ℃预变性5 min;94 ℃退火温度从65 ℃降至55 ℃,每个循环降低0.5 ℃,退火时间为3 s,72 ℃延伸1 min,20个循环;恒定退火温度下进行94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,10个循环。
第三轮扩增:使用不含GC夹的引物338F(ACT CCT ACG GGA GGC AGC AG)和518R引物对第二轮PCR产物进行Reconditioning PCR,减少PCR过程中产生的异构二聚体[14],反应体系为25 μL(同上)。PCR反应程序:94 ℃预变性5 min,94 ℃变性1 min,55 ℃退火45 s,72 ℃ 1 min,共5个循环,72 ℃延伸5 min。
1.2%琼脂糖凝胶电泳检测PCR产物。
1.2.3 变性梯度凝胶电泳(DGGE)分析
采用Bio-Rad DcodeTMUniversal Mutation Detection System对样品16S rDNA的V3区扩增产物进行电泳,电泳条件:8%聚丙烯酰胺凝胶,变性剂梯度30%~60%(100%变性剂含有7 mol/L尿素和40%甲酰胺),凝胶置于0.5×TAE缓冲液中,先在200 V下预电泳10 min,然后85 V恒电压下电泳16 h,溴化乙锭(ethidium bromide,EB)染色后放于凝胶成像仪内拍照。
1.2.4 回收条带及DNA测序
将EB染色的DGGE胶片放置于紫外灯下,无菌操作切下DGGE胶上不同位置的条带,分别放入2 mL离心管中,加入20 μL无菌双蒸水,在4 ℃下过夜。取1.5 μL为模板DNA进行16S rDNA V3可变区域扩增(条件PCR第二轮扩增),PCR产物经DGGE后证明与所割条带位于相同的迁移位置,再割胶回收,4 ℃过夜后取2 μL为模板DNA扩增(条件PCR第三轮扩增),1.2%琼脂糖凝胶电泳检验,送至生工生物工程(上海)有限公司进行测序。登录NCBI将所得序列与数据库中的已知序列进行相似性比对。
2 结果与讨论分析
2.1 结果
胀袋酱油细菌DGGE指纹图谱结果见图1。
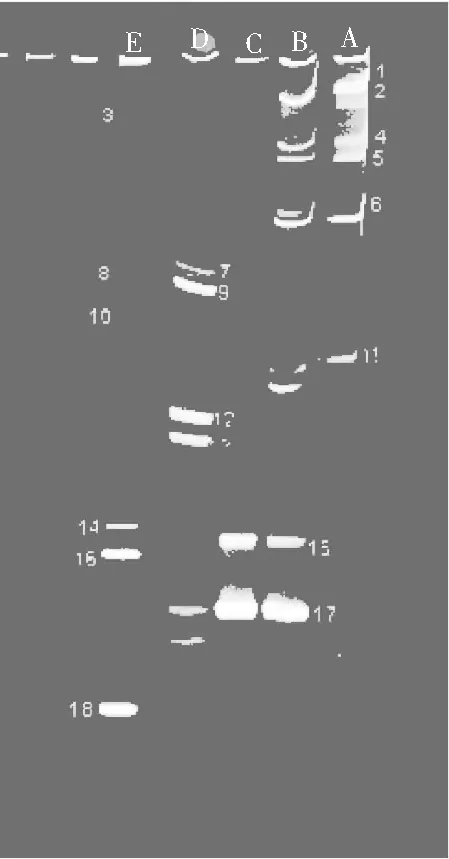
图1 细菌DGGE指纹图谱Fig.1 DGGE fingerprint spectrum of bacteria
注:一个泳道代表一个样品,泳道中每一条亮带代表一种细菌,不同位置的条带代表不同种类,条带越亮,所代表的种属细菌相对含量越多。
由图1可知,不同包装工艺的胀袋酱油所分离出的条带各不相同,样品条带总共18条,其中条带1,2,6,15,16,17,18在5个样品中较亮,条带17最亮,样品中细菌多样性丰富;经NCBI数据库Blast比对,条带所代表的细菌鉴定结果见表1。

表1 样品条带测序结果Table 1 Band sequencing results of samples
由图1和表1可知,样品中共分离出了不同亮度的18条条带,回收条带的同源性均在93%~99%之间,具有较丰富的细菌种群;其中2,4,5,6为样品A,B共有条带;15为B,C样品共有条带,B样中15号菌种含量较少;17为B,C,D样品共有条带,D中17号菌种含量较少;条带1~18所代表的微生物见表1。
DGGE图谱显示,A样品条带中1,2,6最亮,其次是4,5,11,表明A样品中优势菌为嗜盐乳杆菌(Lactobacillushalopiluus)和Lactobacillusparafarraginis1,其次是不可培养乳杆菌1(UnculturedLactobacillussp.)、破布子乳杆菌1(Lactobacilluspobuzihii)和乳酸杆菌属3(Lactobacillussp.);B样品条带中17最亮,其次是2,6,最后是4,5,11,表明B样品中优势菌为破布子乳杆菌4(Lactobacilluspobuzihii),其次是嗜盐乳酸杆菌(Lactobacillushalopiluus)和Lactobacillusparafarraginis1,最后是不可培养乳杆菌1(UnculturedLactobacillussp.)、破布子乳杆菌1(Lactobacilluspobuzihii)和乳酸杆菌属3(Lactobacillussp.);C样品条带中17最亮,其次是15,表明C样品中优势菌为破布子乳杆菌4(Lactobacilluspobuzihii),其次是嗜酸乳杆菌(Lacobacillusacidipiscis);D样品条带中9,12最亮,其次是7,13,最后是17,表明优势菌为食窦魏斯氏菌(Weissellacibaria)、白葡萄球菌(Staphylococcusarlettae),其次是Weissellaconfusa、不可培养细菌(UnculturedBacterium),最后是破布子乳杆菌4(Lactobacilluspobuzihii);E样品条带中18最亮,其次是16,最后是3,8,10,14,表明优势菌为Lactobacillusparafarraginis2,其次是破布子乳杆菌3(Lactobacilluspobuzihii),最后是乳酸杆菌属1(Lactobacillussp.)、乳酸杆菌属2(Lactobacillussp.)、Lactobacillusparafarraginis1和破布子乳杆菌2(Lactobacilluspobuzihii)。

图2 菌株的系统发育树Fig.2 Phylogenetic tree of strains
通过菌株系统发育树的构建结果(见图2),可将测序结果分为3个类别:类别I为不可培养乳杆菌(UnculturedLactobacillussp.)、Lactobacillusparafarraginis、Weissellaconfusa、乳酸杆菌属(Lactobacillussp.)、白葡萄球菌(Staphylococcusarlettae)、破布子乳杆菌(Lactobacilluspobuzihii)、不可培养细菌(UnculturedBacterium),包含条带有4,6,7,3,8,12,11,5,13;类别II为食窦魏斯氏菌(Weissellacibaria)、破布子乳杆菌(Lactobacilluspobuzihii)、嗜酸乳杆菌(Lactobacillusacidipiscis)、嗜盐乳杆菌(Lactobacillushalopiluus),包含条带有9,17,15,1,2;类别III为破布子乳杆菌(Lactobacilluspobuzihii)、Lactobacillusparafarraginis,包含条带有16,10,14,18。
2.2 讨论分析
本研究利用PCR-DGGE技术在对5个不同的胀袋酱油样品进行分离鉴定,检测出了不同强度和数量的条带,通过结果可看出胀袋酱油中细菌组成较为丰富,并鉴定出多种细菌,有破布子乳杆菌(Lactobacilluspobuzihii)、嗜盐乳酸杆菌(Lactobacillushalopiluus)、嗜酸乳杆菌(Lactobacillusacidipiscis)、食窦魏斯氏乳酸杆菌(Weissellacibaria)和白葡萄球乳酸杆菌(Staphylococcusarlettae)等。樊君等人在对胀袋、胀瓶酱油中产气微生物的传统分离中发现了一株产气非芽孢的短杆菌,张小丽[15]在对胀袋酱油中产气微生物进行传统分离时也发现了一株非芽孢的短杆菌,经鉴定指出该菌为破布子乳杆菌,革兰氏阳性菌,属于兼性厌氧型微生物,并指出胀袋酱油中的产气微生物之一即为破布子乳杆菌;李娜在对胀罐酱油中污染微生物进行分离鉴定时发现胀罐酱油中的破布子乳杆菌含量高于正常酱油含量;杨卓等[16]对广州某酱油厂的胀罐酱油进行产气菌研究时,通过16S rDNA测序发现产气菌为破布子乳杆菌,并发现该菌株只有在酱油中培养才会出现产气现象;破布子乳杆菌最早发现于台湾的一种名为破布子的食物中,主要用于食品破布子的发酵[17],破布子乳杆菌属于植物乳杆菌的一种,不是致病菌,但该菌大量存在于酱油中会导致酱油胀罐,严重影响酱油的质量。在本研究的5个胀袋、胀瓶酱油样品中均发现了破布子乳杆菌的存在,并且在胀袋严重的样品B,C,E中破布子乳杆菌的浓度最高,综上可以推断出破布子芽孢杆菌为胀袋酱油的主要污染微生物。
在胀袋酱油中,除破布子乳杆菌(Lactobacilluspobuzihii)以外,还发现了嗜酸乳杆菌(Lactobacillusacidipiscis)、嗜盐乳酸菌(Lactobacillushalopiluus)、Lactobacillusparafarraginis、乳酸杆菌属(Lactobacillussp.)、食窦魏斯氏乳酸杆菌(Weissellacibaria)、Weissellaconfusa、白葡萄球乳酸杆菌(Staphylococcusarlettae),这些菌株在酱油生产过程中均存在:在Yasushi等[18]对酱油生产过程中微生物区系变化的研究中,在酱油曲中发现了食窦魏斯氏乳酸杆菌(Weissellacibaria)、Weissellaconfusa的存在,而且在酱油的生产过程中发现乳酸杆菌属为优势微生物,并且在酱油发酵第6周时还发现了白葡萄球乳酸杆菌(Staphylococcusarlettae);而嗜酸乳杆菌最初是从泰国的发酵鱼食品中分离筛选出的[19],并且作为日本传统发酵鱼食品的优势菌株被检测出[20];嗜盐乳酸菌在酱油生产中的存在可以赋予酱油良好的风味,罗立新等[21]从传统酿造工艺的中国酱油发酵酱醪中分离筛选出嗜盐乳酸菌,并且该菌株与Lactobacillusparafarraginis在四川泡菜中也被分离出[22]。
本实验中所采用的酱油样品均为包装完成样品,而在结果中除发现部分污染细菌外,还发现了一些制曲、发酵过程中的微生物,说明工厂车间的灭菌效果不佳;2005年,郭天文等通过传统培养方法检测发现引起酱油产气的细菌污染源于自然环境中,即使车间封闭仍会有外来微生物的污染,并指出对酱油进行超高温瞬时杀菌能达到商业杀菌的目的,有效杀死酱油中的产气微生物,控制酱油的胀袋、胀瓶现象。
3 结论
PCR-DGGE可以不通过传统分离培养的方法直接检测样品中微生物的种类,此方法可以快速、准确探索样品中微生物多样性和群落结构的变化,本实验利用该方法检测出胀袋、胀瓶酱油中的污染微生物多样性丰富,主要为乳酸杆菌属,经鉴定,分析其产气微生物主要为破布子乳杆菌(Lactobacilluspobuzihii),除此之外,还发现一些来源于酱油曲和发酵过程中的微生物,如食窦魏斯氏乳酸杆菌、Weissellaconfusa和白葡萄球乳酸杆菌,很可能是酱油生产过程中灭菌不彻底造成的,因此在酱油生产各环节中,除了工厂车间灭菌之外,更应严格把控酱油产品的灭菌过程,避免灭菌不彻底引起的胀袋、胀瓶等严重影响产品品质的现象出现。

