可见光促进下N-芳基丙烯酰胺甲基化合成3-甲基-3-乙基氧化吲哚
孙焕,蒋玥,杨莹莎,李云云,路明坤,刘吉开*
(1中南民族大学 药学院,武汉 430074; 2 中南民族大学 民族药学国家级实验教学示范中心,武汉 430074)
环系骨架在药物分子中广泛存在.环系的存在深刻影响着分子的性质,如电子分布、三维结构等,将其引入到药物分子当中,可显著改变分子的亲油性、极性,决定化合物的活性、代谢稳定性、毒性等[1].统计结果显示,在FDA批准的1086种小分子药物当中,含氮杂环化合物有640种,占比高达59%[2].氧化吲哚因其在天然产物、生物活性化合物和候选药物中广泛存在受到了合成化学家的极大关注[3-5](见图1).其中3,3-二取代氧化吲哚因3位手性中心的存在而备受关注.
从N-芳基丙烯酰胺出发通过串联环化反应实现3,3-二取代氧化吲哚的构建是最为直接高效的合成策略之一[6].由于甲基是生物活性分子中最普遍的官能团之一,甲基化是有机化学中最常见的转化之一[7,8].近年来,可见光促进[9]下N-芳基丙烯酰胺的自由基氧化1,2-烷基化反应取得了一定进展(见图2)[10,11]. 2013年, XIE等[12]以羧酸为烷基自由基来源、PhI(OAc)2为自由基引发剂,在可见光促进下通过N-芳基丙烯酰胺的串联加成/环化反应实现了3,3-二烷基取代氧化吲哚的合成.同年, FU等[13]以N-芳基丙烯酰胺和芳基重氮盐为底物,Ru(bpy)3Cl2为光氧化还原催化剂,实现了3位芳基取代的吲哚-2-酮类化合物的合成.此外,过氧化物如过氧化二异丙苯(DCP)[14]、二叔丁基过氧化物(DTBP)[15],二甲基亚砜(DMSO)[16]也可作为甲基自由基前体在可见光促进下实现3-甲基-3-乙基氧化吲哚的高效合成.本文在前人研究基础上,以过氧化苯甲酸叔丁酯(TBPB)为氧化剂,在可见光促进下通过N-芳基取代的丙烯酰胺类化合物的串联自由基加成/环化反应,实现了3-甲基-3-乙基氧化吲哚类化合物的合成.

图1 活性氧化吲哚类化合物Fig.1 Selected active molecules containing oxindole skeleton

图2 N-苯基丙烯酰胺甲基化Fig.2 Methylation of N-arylacrylamide
1 实验部分
1.1 仪器与试剂
磷酸氢二钾、过氧化苯甲酸叔丁酯(麦克林);fac-Ir(ppy)3(安耐吉),未经任何纯化处理直接使用;试剂盒溶剂纯化参照Purification of Laboratory Chemicals (W.L.F.Armarego, Christina Li Lin Chai, Elsevier Inc. 2009);薄层硅胶板采用GF254(60-F250, 0.2 mm, 青岛海洋化工厂),用UV(波长254 nm)显色;快速柱层析用青岛海洋硅胶60(200~300 mesh ASTM),以乙酸乙酯和石油醚为洗脱剂.
1H NMR和13C NMR采用Bruker Advance-600(1H: 600 MHz,13C: 150 MHz)核磁共振仪测定,用CDCl3位溶剂;高分辨质谱由中南民族大学药学院分析仪器中心完成,使用ESI为离子源.
1.2 3-甲基-3-乙基氧化吲哚类化合物的合成
称取N-芳基丙烯酰胺衍生物(0.1 mmol),fac-Ir(ppy)3(0.001 mmol,摩尔浓度 1 %),K2HPO4(0.2 mmol),TBPB(0.2 mmol)于干燥的反应管中,加入1mL DMSO溶剂后封口.蓝光LED灯(6W)照射下室温搅拌12 h.反应结束后,TLC检测,旋蒸浓缩,并通过柱层析分离[V(石油醚)∶V(乙酸乙酯)=15∶1],得3-甲基-3-乙基氧化吲哚产物.
2 结果与讨论
2.1 反应条件优化
以N-芳基丙烯酰胺衍生物1a为模板底物,fac-Ir(ppy)3为催化剂,DMSO为溶剂,从氧化剂、碱等角度对反应条件进行筛选,发现向反应体系中加入过氧化苯甲酸叔丁酯(TBPB)作为氧化剂时可促进甲基化氧化吲哚产物的生成.通过对多种碱进行筛选发现磷酸氢二钾展现出最佳的反应效率.
表1 可见光促进N-芳基丙烯酰胺甲基化的合成反应条件筛选a
Tab.1 Optimization of reaction condition for visible light-inducedmethylation ofN-arylacrylamides1aa


序号氧化剂碱产率 b1TBHPNa2CO3痕量2TBPBNa2CO356%3TBPBNaHCO344%4TBPBK2HPO465%5TBPBKH2PO445%6TBPBCs2CO360%7TBPBPyridine54%8TBPBDBU痕量9TBPBDMAP痕量
a反应条件:1a(0.1 mmol),fac-Ir(ppy)3(0.001 mmol, 1%), 碱(0.2 mmol, 2.0 mol/L氧化剂(0.2 mmol, 2.0 mol/L)溶于1.0 mL DMSO中,室温、空气氛围下经6 W 蓝光-LED照射;b分离产率
2.2 底物普适性考察
在优化后的反应条件下,对该反应的底物普适性进行考察,结果见表2. 由表2可见,该反应表现出良好的底物普适性.先对氮上保护基团对反应的影响进行了考察,发现甲基、苯基、苄基等给电子基团可促进反应的进行,而用吸电子基团如对甲苯磺酰基、酯基作为保护基团时,该反应无法发生.说明给电子保护基团对稳定反应过程中生成的自由基和碳正离子中间体具有重要作用.再对苯环上所含取代基的电性、位置进行了考察,给电子基团(如甲氧基)或吸电子基团(如氯、碘)均可以中等至良好收率得到目标产物. 此外,该反应对空间位阻并不敏感.. 除对位取代外,苯环的邻位、间位均可允许取代基团的存在. 间位存在取代基团时,该反应表现出良好的反应性和中等的区域选择性,反应更倾向于发生在苯环的2位. 多取代底物(2j)也表现出良好的兼容性.
表2 可见光促进3-甲基-3-乙基氧化吲哚的合成反应底物普适性考察
Tab.2 Substrate scope for the synthesis of 3-ethyl-3-methyl oxindoles promoted by visible light

3-ethyl-1,3-dimethylindolin-2-one (2a):产率65%,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.27 (td,J= 7.7,1.1 Hz,1H),7.17 (d,J= 7.3 Hz,1H),7.07 (t,J= 7.4 Hz,1H),6.84 (d,J= 7.7 Hz,1H),3.22 (s,3H),1.93 (dq,J= 14.7,7.4 Hz,1H),1.77 (dq,J= 14.8,7.4 Hz,1H),1.35 (s,3H),0.58 (t,J= 7.4 Hz,3H).13C NMR (151 MHz,CDCl3)δ: 180.82,143.46,133.93,127.63,122.44,107.85,49.00,31.47,26.11,23.34,8.88. HRMS (ESI):m/z= 190.1226,calcd for C12H15NO2([M+H+]) 190.1232.
3-ethyl-3-methyl-1-phenylindolin-2-one(2b):产率89%,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.52 (t,J= 7.5 Hz,2H),7.47~7.35 (m,3H),7.24 (d,J= 7.2 Hz,1H),7.19 (t,J= 7.7 Hz,1H),7.11 (t,J= 7.4 Hz,1H),6.84 (d,J= 7.8 Hz,1H),2.06 (dq,J= 14.3,7.2 Hz,1H),1.86 (dq,J= 14.3,7.3 Hz,1H),1.48 (s,3H),0.71 (t,J= 7.3 Hz,3H).13C NMR (151 MHz,CDCl3)δ: 180.17,143.34,134.60,133.62,129.51,127.87,127.48,126.54,122.86,122.78,109.13,49.00,32.02,23.60,8.89.HRMS (ESI):m/z= 252.1381,calcd for C17H17NO([M+H+]) 252.1388.
1-benzyl-3-ethyl-3-methylindolin-2-one (2c):产率52%,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.34~7.24 (m,5H),7.17 (d,J= 7.3 Hz,1H),7.14 (t,J= 7.7 Hz,1H),7.03 (t,J= 7.4 Hz,1H),6.72 (d,J= 7.8 Hz,1H),4.99 (d,J= 15.7 Hz,1H),4.86 (d,J= 15.7 Hz,1H),2.01 (dq,J= 14.6,7.3 Hz,1H),1.83 (dq,J= 14.6,7.4 Hz,1H),1.41 (s,3H),0.64 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z=266.1538,calcd for C18H19NO([M+H+]) 266.1545.
3-ethyl-1,3,7-trimethylindolin-2-one (2d):产率72%,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.00~6.97 (m,2H),6.95 (d,J= 7.0 Hz,1H),3.50 (s,3H),2.59 (s,3H),1.96~ 1.84 (m,1H),1.77~1.69 (m,1H),1.32 (s,3H),0.56 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z=204.1383,calcd for C13H17NO([M+H+])204.1388.
3-ethyl-5-methoxy-1,3-dimethylindolin-2-one (2e):产率35%,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 6.80~6.76 (m,2H),6.74 (d,J= 9.1 Hz,1H),3.80 (s,3H),3.19 (s,3H),1.97~1.87 (m,1H),1.79~1.70 (m,1H),1.34 (s,3H),0.58 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z= 220.1332,calcd for C13H17NO2([M+H+]) 220.1338.
3-ethyl-1,3,6-trimethylindolin-2-one(2f): 产率71%,m(2f)∶m(2f′)=2∶1,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.04 (d,J= 7.4 Hz,1H),6.88 (d,J= 7.9 Hz,1H),6.67 (s,1H),3.19 (s,3H),2.39 (s,3H),1.94~1.83 (m,1H),1.80~1.71 (m,1H),1.32 (s,3H),0.58 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z= 204.1383,calcd for C13H17NO([M+H+])204.1388.
3-ethyl-1,3,4-trimethylindolin-2-one (2f′):产率71%,m(2f)∶m(2f′)=2∶1,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.16 (t,J= 7.7 Hz,1H),6.83 (d,J= 7.8 Hz,1H),6.69 (d,J= 7.7 Hz,1H),3.20 (s,3H),2.36 (s,3H),2.00 (q,J= 7.4 Hz,2H),1.42 (s,3H),0.48 (t,J= 7.4 Hz,3H). HRMS (ESI):m/z= 204.1383,calcd for C13H17NO([M+H+]) 204.1388.
6-chloro-3-ethyl-1,3-dimethylindolin-2-one (2g):产率58%,m(2g)∶m(2g′)=3∶2,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.06 (d,J= 7.8 Hz,1H),7.03 (dd,J= 7.8,1.8 Hz,1H),6.83 (d,J= 1.7 Hz,1H),3.19 (s,3H),1.92~1.87 (m,1H),1.78~1.69 (m,1H),1.33 (s,3H),0.57 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z=224.0837,calcd for C12H14ClNO([M+H+])224.0842.
4-chloro-3-ethyl-1,3-dimethylindolin-2-one (2g′):产率58%,m(2g)∶m(2g′)=3∶2,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.20 (t,J= 8.0 Hz,1H),6.99 (dd,J= 8.2,0.7 Hz,1H),6.74 (d,J= 7.7 Hz,1H),3.21 (s,3H),2.32~2.21 (m,1H),2.01~1.92 (m,1H),1.48 (s,3H),0.50 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z=224.0837,calcd for C12H14ClNO([M+H+])224.0842.
3-ethyl-5-iodo-1,3-dimethylindolin-2-one (2h):产率44%,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 7.58 (d,J= 8.1 Hz,1H),7.43 (s,1H),6.62 (d,J= 8.1 Hz,1H),3.18 (s,3H),1.91 (dq,J= 14.6,7.3 Hz,1H),1.73 (dq,J= 14.9,7.5 Hz,2H),1.33 (s,3H),0.58 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z= 316.0192,calcd for C12H14INO([M+H+]) 316.0198.
5-chloro-3-ethyl-1,3-dimethylindolin-2-one (2i): 产率72%,无色油状物,1H NMR (600 MHz,Chloroform-d)δ: 7.23 (dd,J= 8.2,2.1 Hz,1H),7.13 (d,J= 2.1 Hz,1H),6.75 (d,J= 8.2 Hz,1H),3.19 (s,3H),1.97~1.88 (m,1H),1.78~1.68 (m,1H),1.33 (s,3H),0.58 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z=224.0837,calcd for C12H14ClNO([M+H+])224.0842.
8-ethyl-6,8-dimethyl-2,3,6,8-tetrahydro-7H-[1,4]dioxino[2,3-f]indol-7-one (2j):产率42%,无色油状物.1H NMR (600 MHz,Chloroform-d)δ: 6.77 (d,J= 8.3 Hz,1H),6.34 (d,J= 8.3 Hz,1H),4.30~4.26 (m,2H),4.26~4.22 (m,2H),3.16 (s,3H),2.09~2.00 (m,1H),1.94~1.86 (m,1H),1.42(s,3H),0.54 (t,J= 7.4 Hz,3H).HRMS (ESI):m/z=248.1280,calcd for C14H17NO3([M+H+])248.1287.
2.3 反应机理研究
通过对照实验、自由基抑制实验以及甲基来源实验,对反应机理进行了初步研究. 在对照实验中(见表3)发现,在无光催化剂或光照时反应均不能发生.在自由基抑制实验中(见图3)发现,向反应体系中加入自由基捕捉剂TEMPO可以有效抑制该反应.
以DMSO-d6为反应溶剂对甲基化来源进行了探究(见图4),发现TBPB和DMSO均可作为甲基自由基前体参与反应进行.当使用氯苯或TBPB作为反应溶剂时反应无法发生,由此可见,在该反应中DMSO扮演自由基前体和溶剂的双重角色.
表3 对照实验a
Tab.3 Control experimenta


序号与标准条件差别产率/%b1无652不添加fac-Ir(ppy)303黑暗 (无 Blue-LED照射)0
a反应条件:1a(0.1 mmol),fac-Ir(ppy)3(0.001 mmol,1 %),K2HPO4(0.2 mmol),TBPB(0.2 mmol)溶于1.0 mL DMSO中,室温、空气氛围下经6 W 蓝光-LED照射;b分离产率

图3 自由基抑制实验Fig.3 Radical inhibition experiment

图4 甲基化来源实验Fig.4 Methylation source experiment
基于文献和前期反应机理研究,对反应机理进行如下推测:Ir(III)在可见光照射下被激发到激发态Ir(III)*,随后将电子提供给TBPB以产生叔丁氧基自由基.产生的叔丁氧基自由基可脱除一分子丙酮生成甲基自由基,也可与DMSO发生加成反应生成自由基中间体A,进而得到甲基自由基.生成的甲基自由基与N-芳基丙烯酰胺1的碳碳双键发生加成反应得到自由基中间体B,进而发生自由基分子内环化反应得到自由基中间体C,其可被Ir(IV)氧化得到相应的阳离子中间体D.在碱性条件下阳离子中间体D去质子生成甲基化产物.
3 结语
以N-苯基丙烯酰胺衍生物为底物,在可见光和光氧化还原催化剂的共同作用下,通过串联自由基加成/环化反应实现了3-甲基-3-乙基氧化吲哚类化合物的高效合成.控制实验表明TBPB和DMSO均可作为甲基自由基来源参与该反应的进行.
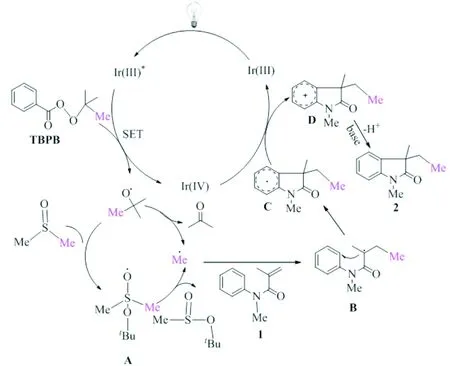
图5 反应机制的研究Fig.5 study of reaction mechanism

