RNaseⅢ RncS 对单核细胞增生李斯特菌毒力的 调控作用研究
王立霞,孟庆玲,乔 军,蔡扩军,王登峰,郭 晶,伍晔晖,才学鹏
(1.石河子大学动物科技学院动物疾病防控兵团重点实验室,石河子 832003;2.乌鲁木齐市动物疾病控制与诊断 中心,乌鲁木齐 830063;3.新疆畜牧科学院兽医研究所,乌鲁木齐 830000;4.中国兽医药品监察所,北京 100081)
单核细胞增生李斯特菌(Listeria monocytogenes,LM)是一种革兰氏阳性兼性厌氧的人畜共患致病菌,可引起人和多种动物的李斯特菌病[1-2]。LM是一种食源性病原体,可在老年人、新生儿、孕妇和免疫功能低下的人群引起严重的胃肠道、全身和中枢神经系统感染,主要表现为败血症、脑膜脑炎、流产和新生儿感染,具有较高的死亡率[3-4]。同时,LM也是一种腐生菌,在土壤和植被中广泛分 布[5],易污染食品及动物饲草料,给食品卫生安全和畜牧业带来严重的威胁。
LM作为一种胞内寄生的致病菌,可感染专职和非专职吞噬细胞,并在胞内长期生存。主要通过吞噬作用或内化作用侵入宿主细胞,内化后,LM利用溶血素O(LLO)的活性从宿主细胞吞噬体中逃逸到宿主细胞质中。一旦进入宿主细胞质中,LM迅速繁殖,并利用肌动蛋白细胞骨架结合表面蛋白ActA在细胞质中的运动感染相邻细胞[6-8]。LM在感染宿主过程中每一步均有特定的毒力因子参与,包括入侵所需的毒力基因(inlA、inlB),逃避吞噬体所需的毒力基因(hly、plcA、plcB),细胞内运动所需的毒力基因(actA)以及细胞间扩散所需的毒力基因(inlC),而这些毒力因子的表达均受正调节蛋白PrfA的调节[9]。LM的耐受性和致病性与多种应激调节因子和毒力因子密切相关,而大多数环境应激因子和毒力因子的表达除了受PrfA和Sigma B的调节之外,ncRNAs(non-coding RNAs,ncRNAs)与PrfA、VirR、Sigma B等调节分子组成的复杂调控网络,对LM毒力及应激相关基因在转录、转录后和翻译水平进行精细调控。
研究发现,RibonucleaseⅢ(RnaseⅢ)是一种调控ncRNA水平的重要酶系[10],LM的致病性与ncRNAs的调控密切相关,然而,LM RnaseⅢ对其毒力的调控作用至今尚未有报道。鉴于此,在前期构建LM-ΔrncS基因缺失突变株的基础上,本研究通过动物感染试验、细胞侵染试验,对强毒株LMSB5及缺失株LM-ΔrncS的毒力、细胞粘附力、侵袭力及胞内生存增殖能力进行检测,分析RnaseⅢ RncS在调控LM毒力中发挥的作用,为进一步揭示RnaseⅢ在LM毒力中的分子调控机制提供了科学依据。
1 材料与方法
1.1 主要试剂、菌株与试验动物LM-SB5强毒株由石河子大学动物疾病防控兵团重点实验室保存;LM-ΔrncS缺失株由本实验室前期构建保存;小鼠巨噬细胞RAW264.7细胞由本实验室保存;8周龄18~ 22 g昆明系小鼠购自石河子大学实验动物中心;胎牛血清、DMEM细胞培养液购自Gibco公司;胰蛋白酶购自美国HyCloneTM公司;Triton X-100购自北京Biotopped公司;6孔板及细胞培养瓶购自Sigma 公司。
1.2 LM-SB5及LM-ΔrncS菌株小鼠半数致死量LD50的测定参考Peng等[11]的方法,分别测出LM-SB5及LM-ΔrncS对小鼠的LD0和LD100。根据预实验结果,将培养好的菌液离心后收集菌体,用无菌PBS缓冲液清洗2遍后制备成悬浮液,并进行一系列的倍比稀释。将100只8周龄昆明系小鼠随机平均分为A、B两组,每组分为5个亚组,每个亚组10只。A组每只小鼠分别腹腔注射0.5 mL不同稀释梯度的LMSB5菌悬液, B组每只小鼠分别腹腔注射0.5 mL不同稀释梯度的LM-ΔrncS菌悬液。攻毒后连续7 d观察,记录小鼠精神状态及临床症状,然后统计各组小鼠的死亡情况,计算死亡率,应用孙氏改良寇氏法分别计算LM-SB5及LM-ΔrncS对小鼠的LD50,并计算其LD50的95%可信限。
1.3 LM-SB5及LM-ΔrncS菌株小鼠生存率的测定将30只8周龄昆明系小鼠随机分成A、B、C 3个组,每组10只,A、B2组每只小鼠分别腹腔注射0.5 mL LM-SB5和LM-ΔrncS细菌悬液,C组每只小鼠腹腔注射0.5 mL PBS缓冲液,攻毒后连续7 d观察、记录小鼠精神状态及死亡情况,并绘制其Kaplan-Meier生存曲线。
1.4 LM-SB5及LM-ΔrncS菌株接种小鼠脏器载菌量及病理组织学分析参考文献[12]的方法,将8周龄昆明系小鼠随机分为3组,分别腹腔注射0.5 mL亚致死剂量的LM-SB5、LM-ΔrncS细菌悬浮液和PBS缓冲液,第1~5 d每组各取1只小鼠,无菌摘取肝脏、脾脏,加入1.0 mL PBS研磨匀浆,连续10倍梯度稀释后,均匀涂布于BHI平板固体培养基上,置于37℃恒温培养16 h。吸取不同稀释梯度的组织研磨液进行标准平板计数,每个稀释梯度设置3个重复,取平均值作为肝脏、脾脏载菌量;第5 d时分别摘取3组小鼠的肝脏、脾脏、肾脏,经4%甲醛溶液固定24 h后,制备切片,HE染色后观察其病理组织学变化。
1.5 LM-SB5及LM-ΔrncS菌株黏附、侵袭小鼠巨噬细胞RAW264.7能力检测挑取生长较好的小鼠巨噬细胞RAW264.7加入6孔板中,置于37℃、5%CO2条件下培养36 h。将0.5 mL培养至对数生长期的LMSB5、LM-ΔrncS菌液,按巨噬细胞:细菌=1∶100的比例分别加至6孔板中继续培养,1 h后吸出细胞培养液100 μL进行一系列的10倍梯度稀释;分别吸取100 μL各梯度稀释液均匀涂布于BHI固体培养基;PBS清洗3遍,加入2 mL含100 μg/mL庆大霉素的DMEM细胞培养液,继续培养1 h;弃去培养液,PBS清洗2遍,加入2 mL 0.5%的Triton X-100裂解细胞15 min,吸取该细胞裂解液用BHI培养液进行系列倍比稀释,分别吸取100 μL各梯度稀释液均匀涂布于BHI固体培养基上,培养16 h后进行标准平板计数。
1.6 LM-SB5及LM-ΔrncS 菌株在小鼠巨噬细胞RAW264.7内生存增殖能力检测按上述方法侵染小鼠巨噬细胞RAW264.7,PBS清洗2遍,加入2 mL含100 μg/mL庆大霉素的DMEM细胞培养液,以杀灭细胞外细菌;1 h后,PBS清洗2遍,向各孔中分别加入2 mL含10 μg/mL庆大霉素的DMEM细胞培养液,分别在2、4、6、8、10、12 h吸出孔中培养液,PBS清洗细胞2遍,按1.5方法裂解细胞,菌落计数,并绘制细菌在细胞内的生长曲线。试验重复3次,每次3个平行。
1.7 数据统计分析 所有数据均使用GraphPad Prism5.0软件进行数据统计分析,数据表示为平均值±标准偏差,P<0.05表示差异显著,具有统计学意义。
2 结果
2.1 LM-SB5及LM-ΔrncS菌株的LD50测定结果通过预实验,测出LM-SB5的LD0为1.08×105CFU,LD100为1.72×106CFU;LM-ΔrncS的LD0为 1.0×105CFU,LD100为1×109CFU。分别以此剂量为LD50测定的最大剂量,并进行一系列倍比稀释,小鼠腹腔分别注射LM-SB5和LM-ΔrncS细菌悬浮液后进行观察及LD50测定。12 h后发现部分小鼠出现精神萎靡、食欲不振、畏寒打颤等症状,第1 d后部分小鼠开始死亡;注射LD100组的小鼠在第2~3 d开始死亡,第3~4 d大部分死亡,病理解剖发现小鼠肝脏、脾脏肿大,部分肠道出现充血、出血的现象。注射LD0组的小鼠尽管出现精神沉郁、食欲下降、嗜睡等现象,但在第3 d后基本恢复正常。利用孙氏改良寇氏公式计算得到LM-SB5和LM-ΔrncS对昆明系小鼠的LD50分别为105.60、106.90CFU,LM-SB5 LD50的95%可信限:105.456CFU~105.750CFU(表1),LMΔrncSLD50的95%可信限:106.412CFU~107.388CFU,LM-ΔrncS的LD50升高了1.30个对数数量级,表明rncS基因缺失对小鼠的毒力显著下降,提示rncS基因对LM毒力发挥着重要的调控作用。

表1 LM-SB5 与LM-ΔrncS 的LD50 测定结果Table 1 LD50 measurement results of LM-SB5 and LM-ΔrncS
2.2 LM-SB5及LM-ΔrncS菌株小鼠存活率的测定结果Kaplan-Meier生存曲线显示,感染LM-SB5的小鼠平均存活时间为2.1 d,第2 d死亡率高达50%;而感染LM-ΔrncS的小鼠平均存活时间为5.8 d,第 4~7 d小鼠未出现死亡,存活率为70%,与强毒株LM-SB5组相比,存活时间显著延长,而对照组小鼠未出现死亡的现象(图1),提示rncS基因对LM的毒力具有重要的调控作用。

图1 腹腔注射LM-SB5 和LM-ΔrncS 后小鼠的生存曲线Fig.1 Survival curves of mice infected by intraperitoneal injection of LM-SB5 and LM-ΔrncS
2.3 LM-SB5及LM-ΔrncS菌株接种小鼠脏器载菌量的测定结果感染后第1 d,LM-SB5与LM-ΔrncS接种组小鼠肝脏和脾脏的载菌量差异不显著(p>0.05);第2 d,脾脏的载菌量差异不显著(p>0.05),肝脏的载菌量差异显著(p<0.05);第3~5 d,二者差异均显著(p<0.05),且第4 d差异极显著(p<0.01),LM-SB5接种组肝脏和脾脏的载菌量均显著高于注射LM-ΔrncS组(p<0.05)(图2),提示rncS基因对LM在宿主体内的生存增殖中具有调控作用。
2.4 LM-SB5及LM-ΔrncS菌株接种小鼠脏器病理组织学分析经HE染色镜检发现,与正常对照组(图3A)相比,LM-SB5接种组(图3B)和LM-ΔrncS接种组(图3C)肝脏、脾脏、肾脏均出现了不同程度的病理变化。LM-SB5组小鼠部分肝脏细胞坏死,肝小叶中有炎性细胞浸润,组织结构不清晰,出现网状丝状结构;脾脏的网状纤维中出现透明变性和纤维蛋白渗出物,淋巴组织坏死,脾小结体积增大,细胞间结构疏松,间质增宽;肾脏有明显的颗粒样变性,小静脉出血,出现炎性细胞,结缔组织增生,间质扩大,肾小管上皮细胞核溶解,间质充血。LM-ΔrncS组肝组织结构较清晰,肝小叶出现炎性细胞浸润;脾脏部分坏死,脾小结体积增大,但结构较完整;肾小球肿胀,结缔组织增生,间质增宽,表明rncS基因缺失降低了LM对小鼠组织器官的病理损伤能力。
2.5 LM-SB5及LM-ΔrncS菌株侵染小鼠巨噬细胞RAW264.7能力的测定细胞侵染试验结果显示,LM-SB5及LM-ΔrncS对巨噬细胞RAW264.7的粘附率分别为39.908%、26.774%(图4A),侵袭率分别为3.086%和0.961%(图4B);与LM-SB5相比,LM-ΔrncS对RAW264.7细胞的粘附率和侵袭率均显著降低(P<0.01),提示rncS基因在LM侵袭、粘附RAW264.7细胞过程中发挥了调控作用;在侵染后不同时间段内对细胞内细菌量进行平板计数,发现LM-SB5及LM-ΔrncS的数量均随时间的变化呈先下降再上升的趋势。在各个时间点,LM-ΔrncS的数量均低于LM-SB5(图5)。2~4 h时,LM-SB5及LM-ΔrncS的数量均迅速下降至最低值,且LMΔrncS下降趋势更明显(P<0.01);4~6 h时,二者均迅速上升,差异显著(P<0.05),但在8~12 h时,差异不显著(P>0.05),基本保持稳定。结果表明,rncS基因缺失降低了LM-SB5在RAW264.7细胞内的生存增殖能力,证实RnaseⅢ RncS对LM在RAW264.7细胞内的早期生存过程中发挥了调控作用。
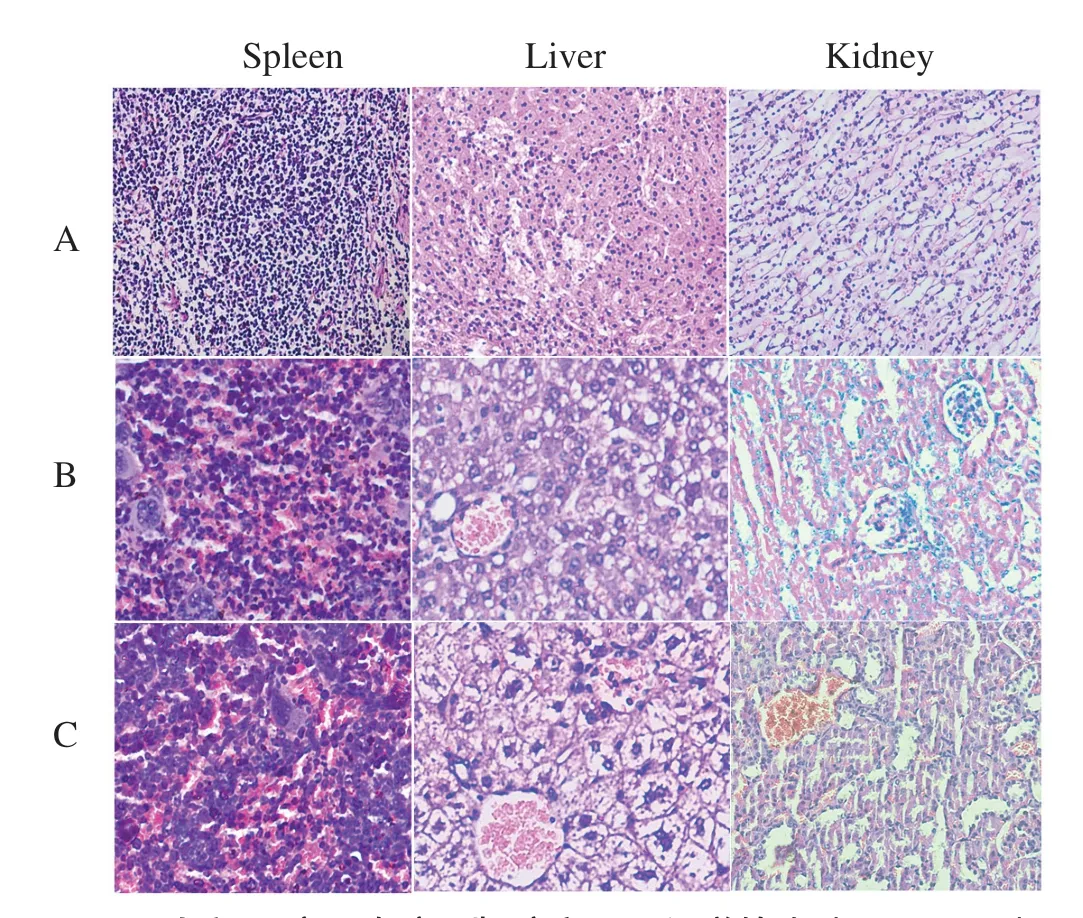
图3 小鼠肝脏、脾脏、肾脏病理组织学检查(HE×400)Fig.3 Histopathological examination of mice liver, spleen and kidney(HE×400)

图4 LM-SB5 及LM-ΔrncS 菌株对巨噬细胞RAW264.7 的侵染结果Fig.4 Infection results of LM-SB5 and LM-ΔrncS on macrophage RAW264.7
3 讨论
小RNA(sRNA)是调控细菌基因表达的重要元件之一,可参与许多细菌的应激耐受和毒力调控,目前被认为是细菌致病的重要调控因子[13]。一些sRNA可以与蛋白质直接结合,调节它们的活性,或直接通过碱基配对其靶mRNA发挥调控作用。sRNA和靶RNA之间的碱基配对可阻断翻译、RNA翻译活化或RNase对复合物的特异性切割[14]。利用上述机制,sRNA可以抑制肠道沙门氏菌[15]和单核细胞增生李斯特菌[16]的转座,调节大肠杆菌中某些转录调节因子的合成[17],并影响细菌的一些代谢和毒力因子的表达[18]。
LM是一种广泛存在于环境中的革兰氏阳性胞内寄生致病菌,具有在专职吞噬细胞和许多非吞噬细胞内侵入、存活和增殖的能力,其产生受sRNA介导的时空调控。目前研究发现,在感染期间,LM可产生许多的毒力因子,这些毒力因子除了受到转录调节因子调控之外,ncRNAs对其毒力基因表达的转录、转录后和翻译水平也发挥着重要的调控作 用[19]。目前,LM EGD-e中报道了304个非编码RNA元件,包括154个sRNA、104个反义和46个顺式编码RNA[20]。研究表明,LM中的sRNA在毒力调控中发挥重要作用[16],Chaudhuri等[21]研究发现,sRNA LhrA通过与LM的毒力因子几丁质酶chiA mRNA碱基互补配对,阻止核糖体的结合,在转录后水平负调控chiA的表达来提高LM的毒力;Sievers等[22]证实sRNA LhrC通过与LM表面蛋白lapB基因mRNA互补配对在转录后水平负调控LapB的表达。

图5 LM-SB5 及LM-ΔrncS 菌株不同时间点在RAW264.7胞内的细菌数Fig.5 Numbers of LM-SB5 and LM-ΔrncS in the RAW264.7 cells after infection at various time
核糖核酸酶Ⅲ(RNaseⅢ)是一种能够切割具有双链结构RNA的核酸内切酶,广泛存在于真核生物、细菌、真菌中,是一种高度保守的水解酶。它不仅在rRNA和tRNA成熟中起重要作用,而且在维持mRNA稳定性方面也发挥重要的作用[19]。RNaseⅢ家族的酶在起初真核生物非编码RNA调控机制中发挥重要作用[23],近年来研究发现RNaseⅢ在细菌sRNA调节中也有类似的作用。2007年,Darfeuille等[24]报道,在大肠杆菌中,RNaseⅢ主要在IstR-1 sRNA结合后切割tisAB mRNA;此外,在sRNA与其mRNA靶标的5"-UTR碱基配对后,体内RyhB sRNA衰变依赖于RNaseⅢ[25]。2011年,Abidat等[26]发现RNaseⅢ是其毒力所必需的,可直接作用于毒力相关基因,同时也可以结合小非编码反义RNA分子与mRNA靶标复合物[27],进而调控毒力基因的表达。2013年,Haddad等[28]发现RNaseⅢ在空肠弯曲杆菌感染期间也发挥着重要作用。2015年,Bonnin等[30]在研究金黄色葡萄球菌时证实,RNaseⅢ通过降解sRNA/mRNA双链体调节参与细胞粘附和逃避免疫因子的表达。2016年,Wu等[29]在布鲁氏菌中发现,RNaseIII可以有效地结合和切割小RNA的茎环结构,并推测其可能参与布鲁氏菌的毒力调节。LM具有跨越宿主屏障,逃避免疫防御,侵入宿主细胞和操纵细胞机制的独特能力,已成为研究宿主-病原体相互作用的模型[20,31],因此开展RNaseⅢ介导的sRNA表达调控研究,对揭示LM在宿主细胞内的生存与致病机制具有重要意义。本研究通过动物感染试验、细胞侵染试验,发现LM-ΔrncS对LM毒力、巨噬细胞粘附、侵袭能力及其在肝脏、脾脏巨噬细胞内生存增殖能力均显著降低,表明rncS基因对LM毒力发挥着重要的调控作用,为进一步揭示RnaseⅢ RNcS参与LM ncRNA调控毒力的分子机制奠定了基础。

